Большая Энциклопедия Нефти и Газа. Оксид хрома
формула, характеристика и химические свойства :: SYL.ru
Среди многообразия химических элементов и их соединений сложно выделить наиболее полезное для человечества вещество. Каждое уникально по своим свойствам и возможностям применения. Технический прогресс значительно облегчает исследовательский процесс, но и ставит перед ним новые задачи. Химические элементы, открытые несколько сотен лет назад и изученные во всех проявлениях, получают в современном мире более технологичные направления использования. Данная тенденция распространяется на соединения, существующие в природе и созданные людьми.
Оксид
В земной коре и на просторах Вселенной существует множество химических соединений, которые отличаются по классам, типам, характеристикам. Одним из самых распространенных видов соединений является оксид (окись, окисел). К нему относят песок, воду, углекислый газ, т. е. основополагающие вещества для существования человечества и всей биосферы Земли. Оксидами называют вещества, которые имеют в составе атомы кислорода со степенью окисления -2, при этом связь между элементами является бинарной. Их образование происходит в результате химической реакции, условия которой разнятся в зависимости от состава оксида.
Характерными признаками данного вещества являются три позиции: вещество сложное, состоит из двух атомов, один из них – кислород. Большое количество существующих оксидов объясняется тем, что многие химические элементы образуют несколько веществ. Они идентичны по составу, но атом, вступающий в реакцию с кислородом, проявляет несколько степеней валентности. Например, оксид хрома (2, 3, 4, 6), азота (1, 2, 3, 4 ,5) и т. д. При этом их свойства зависят от степени валентности элемента, вступающего в окислительную реакцию.
По принятой классификации оксиды бывают основными и кислотными. Также выделяется амфотерный вид, который проявляет свойства основного окисла. Кислотные оксиды – это соединения неметаллов или элементов с высокой валентностью, их гидратами являются кислоты. К основным окислам относят все вещества, имеющие связь кислород + металл, их гидратами являются основания.

Хром
В 18 веке химик И. Г. Леман обнаружил неизвестный минерал, который был назван красным сибирским свинцом. Профессор Парижской минералогической школы Вокелен провел ряд химических реакций с полученным образцом, в результате которых был выделен неизвестный металл. Основными свойствами, обозначенными ученым, стали его устойчивость к кислотным средам и тугоплавкость (жаропрочность). Название "хром" (Chromium) возникло из-за широкой цветовой гаммы, которая характеризуется соединениям элемента. Металл достаточно инертен, в чистом виде не встречается в природных условиях.
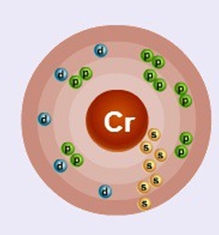
Основными минералами, содержащими хром, являются: хромит (FeCr2O4), меланохроит, вокеленит, дитцеит, тарапакаит. Химический элемент Cr располагается в 6 группе периодической системы Д. И. Менделеева, имеет атомный номер 24. Электронная конфигурация атома хрома позволяет элементу иметь валентность +2, +3, +6, при этом наиболее устойчивыми являются соединения трехвалентного металла. Возможны реакции, при которых степень окисления равна +1, +5, +4. Хром химически не активен, поверхность металла покрывается пленкой (эффект пассивирования), предотвращающей реакции с кислородом и водой при нормальных условиях. Оксид хрома, образующийся на поверхности, предохраняет металл от взаимодействия с кислотами и галогенами при отсутствии катализаторов. Соединения с простыми веществами (не металлами) возможны при температуре от 300 оС (хлор, бром, сера).
При взаимодействии со сложными веществами требуются дополнительные условия, например, с раствором щелочи реакция не происходит, с ее расплавами процесс происходит очень медленно. С кислотами хром вступает в реакцию при наличии в качестве катализатора высокой температуры. Оксид хрома можно получить из различных минералов путем воздействия температуры. В зависимости от будущей степени окисления элемента применяются концентрированные кислоты. При этом валентность хрома в соединении варьируется от +2 до +6 (высший оксид хрома).

Применение
За счет уникальных антикоррозийных свойств и жаропрочности большое практическое значение имеют сплавы на основе хрома. При этом в процентном соотношении его доля не должна превышать половины общего объема. Большим недостатком хрома является его хрупкость, что уменьшает возможности обработки сплавов. Наиболее распространенным способом применения металла является изготовление покрытий (хромирование). Защитная пленка может составлять слой в 0,005 мм, но она будет надежно предохранять металлическое изделие от коррозии и внешних воздействий. Соединения хрома используются для изготовления жаропрочных конструкций в металлургической промышленности (плавильные печи). Антикоррозийные покрытия декоративного направления (металлокерамика), специальная легированная сталь, электроды для сварочных аппаратов, сплавы на основе кремния, алюминия являются востребованными на мировых рынках. Оксид хрома за счет низкой возможности окисления и высокой жаропрочности служит катализатором многих химических реакций, протекающих при высоких температурах (1000 оС).

Двухвалентные соединения
Оксид хрома (2) CrO (закись) является порошком ярко-красного или черного цвета. В воде нерастворим, при нормальных условиях не окисляется, проявляет ярко выраженные основные свойства. Вещество твердое, тугоплавкое (1550 оС), не является токсичным. В процессе нагревания до 100 оС окисляется до Cr2O3. В слабых растворах азотной и серной кислот не растворяется, реакция происходит с хлороводородной кислотой.

Получение, применение
Данное вещество считается низшим оксидом. Имеет достаточно узкую сферу применения. В химической промышленности оксид хрома 2 используется для очистки углеводородов от кислорода, который он притягивает в процессе окисления при температуре свыше 100 оС. Получить закись двухвалентного хрома можно тремя способами:
- Разложением карбонила Cr(CO)6 при наличии в качестве катализатора высокой температуры.
- Восстанавливая при помощи фосфорной кислоты оксид хрома 3.
- Амальгама хрома окисляется кислородом или азотной кислотой.
Трехвалентные соединения

Для оксидов хрома степень окисления +3 является самой устойчивой формой вещества. Cr2O3 (хромовая зелень, сесквиоксид, эсколаид) в химическом отношении инертен, нерастворим в воде, имеет высокую температуру плавления (более 2000 оС). Оксид хрома 3 – зеленый тугоплавкий порошок, очень твердый, имеет амфотерные свойства. Вещество растворимо в концентрированных кислотах, реакция со щелочами происходит в результате сплавления. Может восстанавливаться до чистого металла при взаимодействии с сильным восстановителем.
Получение и применение
За счет высокой твердости (сопоставимой с корундом) наиболее распространено использование вещества в абразивных и полирующих материалах. Оксид хрома (формула Cr2O3) имеет зеленый цвет, поэтому его применяют в качестве пигмента при изготовлении стекол, красок, керамики. Для химической промышленности данное вещество используется как катализатор для протекания реакций с органическими соединениями (синтез аммиака). Трехвалентный оксид хрома применяется для создания искусственных драгоценных камней и шпинелей. Для получения используется несколько видов химических реакций:
- Окисление закиси хрома.
- Нагревание (прокаливанием) бихромата или хромата аммония.
- Разложение гидроксида трехвалентного хрома или шестивалентного оксида.
- Прокаливание хромата или бихромата ртути.
Шестивалентные соединения

Формула высшего оксида хрома – CrO3. Вещество фиолетового или темно-красного цвета, может существовать в виде кристаллов, игл, пластин. Химически активен, токсичен, при взаимодействии с органическими соединениями существует опасность самовозгорания и взрыва. Оксид хрома 6 - хромовый ангидрид, трёхокись хрома - хорошо растворим в воде, при нормальных условиях взаимодействует с воздухом (расплывается), температура плавления – 196 оС. Вещество имеет ярко выраженные кислотные характеристики. При химической реакции с водой образуется дихромовая или хромовая кислота, без дополнительных катализаторов взаимодействует со щелочами (хроматы желтого цвета). Для галогенов (йод, сера, фосфор) является сильным окислителем. В результате нагревания свыше 250 оС образуется свободный кислород и трехвалентный оксид хрома.

Как получают и где применяют
Оксид хрома 6 получают обработкой хроматов (бихроматов) натрия или калия концентрированной серной кислотой либо при реакции хромата серебра с хлороводородной кислотой. Высокая химическая активность вещества обуславливает основные направления его применения:
- Получение чистого металла - хрома.
- В процессе хромирования поверхностей, в том числе электролитическим способом.
- Окисление спиртов (органических соединений) в химической промышленности.
- В ракетной технике используется в качестве воспламенителя топлива.
- В химических лабораториях очищает посуду от органических соединений.
- Используется в пиротехнической отрасли.
www.syl.ru
Оксид хрома
Несколько химических соединений, состоящих из двух простых элементов — Cr и O, — относятся к классу неорганических соединений — оксидов. Их общее название — оксид хрома, далее в скобках принято римскими цифрами указывать валентность металла. Другие их названия и химические формулы:
- хром (II) оксид — закись хрома, CrO;
- хром (III) оксид — хромовая зелень, сесквиоксид хрома, Cr2O3;
- хром (IV) оксид — окись хрома, CrO2;
- хром (VI) оксид — хромовый ангидрид, трехокись хрома, CrO3.
Соединение, в котором металл шестивалентен, и есть высший оксид хрома. Это твердое вещество без запаха, по внешнему виду представляющее собой темно-красные кристаллы (на воздухе они расплываются из-за сильной гигроскопичности). Молярная масса — 99,99 г/моль. Плотность при 20 °С равняется 2,70 г/см³. Температура плавления — 197 °С, кипения — 251 °С. При 0 °С в воде растворяется 61,7 г/100, при 25 °С — 63 г/100 мл, при 100 °С — 67,45 г/100 мл. Окисел также растворяется в серной кислоте (это хромовая смесь, которую используют в лабораторной практике для мытья химической посуды) и азотной кислоте, этиловом спирте, этиловом эфире, уксусной кислоте, ацетоне. При 450 °С разлагается до Cr2O3.
Хром (VI) оксид применяется в процессе электролиза (для получения чистого хрома), для хроматирования оцинкованных изделий, в электролитическом хромировании, как сильный окислитель (для производства индиго и изатина). Высший оксид хрома используется для обнаружения алкоголя в выдыхаемом воздухе. Взаимодействие протекает по схеме: 4CrO3 + 6h3SO4 + 3C2H5OH → 2Cr2(SO4)3 + 3Ch4COOH +9h3O. На наличие алкоголя указывает изменение окраски раствора (приобретает зеленый цвет).
Хром (VI) оксид, как и все соединения шестивалентного Cr, является сильным ядом (летальная доза — 0,1 г). Из-за своей высокой активности CrO3 вызывает возгорание (со взрывами) органических веществ при соприкосновении с ними. Несмотря на малую летучесть, высший оксид хрома опасен при вдыхании, так как вызывает рак легких. При контакте с кожей (даже при скором его удалении) вызывает раздражения, дерматиты, экземы, провоцирует развитие рака.
Окисел с четырехвалентным хромом CrO2 по внешнему виду представляет собой твердое вещество в виде черных тетраэдрических ферромагнитных кристаллов. Оксид хрома 4 имеет молярную массу 83,9949 г/моль, плотность 4,89 г/см³. Вещество плавится, одновременно разлагаясь, при температуре 375 °С. В воде не растворяется. Используется в носителях магнитной записи в качестве рабочего вещества. С ростом популярности компакт-дисков и DVD-дисков использование хрома (IV) оксида снизилось. Был впервые синтезирован в 1956 году химиком из компании EI DuPont Норман Л. Коксом путем разложения триоксида хрома в присутствии воды при температуре 640 °С и давлении 200 МПа. По лицензии DuPont выпускается компаниями Sony в Японии и BASF в Германии.
Оксид хрома 3 Cr2O3 представляет собой твердое мелкокристаллическое вещество от светло- до темно-зеленого цвета. Молярная масса равняется 151,99 г/моль. Плотность — 5,22 г/см³. Температура плавления — 2435 °С, кипения — 4000 °С. Показатель преломления чистого вещества — 2,551. Этот окисел не растворяется в воде, в спирте, ацетоне, кислоте. Поскольку его плотность приближается к плотности корунда, его вводят в составы полирующих средств (например, пасты ГОИ). Это один из основных оксидов хрома, который используется в качестве пигмента. Впервые по секретной технологии он был получен в 1838 году в виде прозрачной гидратированной формы. В природе встречается в виде хромистого железняка FeO•Cr2O3.
Окисел двухвалентного хрома — твердое вещество черного или красного цвета с температурой плавления 1550 °С. Плавится с разложением. Молярная масса — 67,996 г/моль. Оксид хрома (II) красного цвета не пирофорен, а это же вещество черного цвета является пирофорным. Порошок самовоспламеняется на воздухе, поэтому его можно хранить только под слоем в воды, так как с ней он не взаимодействует. Черную закись хрома получить в чистом виде очень сложно.
Для оксидов хрома с низшей валентностью характерны основные свойства, а для окисла с высшей валентностью — кислотные.
fb.ru
63. Хром
Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы.
Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. Природный хром состоит из смеси 5 изотопов: 50, 52, 53, 54, 56. Это самый твердый из всех известных металлов, его плотность 7,2 г/см3. Температура плавления – 1855 °C, температура кипения – 2642 °C. При обычной температуре хром устойчив к воздействию воды и воздуха.
Химические свойства: электронная конфигурация: 1s22s22p23s23p63d54s1. В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня.
При высокой температуре хром горит в кислороде: 4Cr + 3О2 = 2Cr2О3.
Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: 2Cr + 3Н2О = Cr2О3 + 3Н2?.
При нагревании реагирует с галогеноводородами, S, N2, P4, C, Si, B:
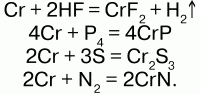
С галогенами реагирует не одинаково:
а) со фтором взаимодействует даже на холоде: Cr + 3F2 = CrF6;
б) с хлором реагирует при нагревании: 2Cr + 3Cl2 = 2CrCl3.
Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: CrО, Cr2О3 и CrО3.
Получение: В чистом виде хром получают двумя способами:
1) металлотермический – восстановление металла из его оксида с помощью другого металла;
2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме.
Металлический хром получают алюмотерми-ческим способом (способ Бекетова) из оксида Cr2О3: Cr2О3 + 2Al = Al2О3 + 2Cr.
Нахождение в природе: в природе хром встречается только в виде соединений, важнейшим из которых является хромистый железняк FeCrO4 или Fe(CrO)2, из которого путем восстановления углеродом в электропечах получают сплав – феррохром. Используется хром в инструментальной и автомобильной промышленности: хромирование – покрытие хромом других металлов; в металлургии – при производстве легированной стали.
64. Оксиды и гидроксиды хрома
Хром образует три оксида: CrО, Cr2О3 и CrО3. Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте: CrО + 2НСl = CrСl2 + Н2О.
При нагревании на воздухе выше 100 °C CrО превращается в Cr2О3: 4CrО + О2 = 2Cr2О3.
Оксид хрома III (Cr2О3) – тугоплавкий порошок зеленого цвета (температура плавления – 2265 °C). Твердость кристаллов близка к корунду, поэтому его вводят в состав полирующих средств. Получают из хромистого железняка (FeCr2O4). При окислительно-щелочном сплавлении последнего с содой образуются хромат натрия NaCrO4: 2Fe(CrO2)2 + 4Na2CO3 + 1/2O2 = 4Na2CrO4 + Fe2O3 + 4CO2.
Затем Na2CrO4 переводят в Na2Cr2O7 – дихромат: Na2CrO4 + Н2SO4 = Na2Cr2O7 + Н2О + Na2SO4.
Далее дихромат восстанавливают углем и получают Cr2О3: Na2Cr2O7 + 2С = Na2CO3 + Cr2О3 + СО?.
В лаборатории Cr2О3 получают термическим разложением дихромата аммония: (Nh5)2Cr2O7?Cr2О3 + N2 + 4Н2О.
Cr2О3 – амфотерный оксид: реагирует с основаниями и кислотами при сплавлении его со щелочами образует хромиты: Cr2О3 + NaОН = 2NaCrO2 + Н2О.
Оксид хрома VI (CrО3) – темно-красные кристаллы, хорошо растворимые в воде. CrО3 – кислотный оксид, с избытком воды образует хромовую кислоту: CrO3 + h3O?h3CrO4.
CrO3 – ангидрид хромовой кислоты. При большой концентрации CrO3 образуются дихромовая кислота: 2CrO3 + h3O?h3CrO7.
CrO3 при нагревании до 250 °C разлагается: 4CrO3?2Cr2О3 + 3О2?.
Получение: взаимодействием дихромата калия с концентрированной h3S04: К2CrO7 + Н2SO4 = CrO3? + К2SO4 + h3O. CrO3 – сильный окислитель – окисляет йод, серу, уголь, фосфор, превращаясь при этом в Cr2О3.
Гидроксид хрома II Сг(ОН)2 желтого цвета, в воде не растворим, обладает основными свойствами, является восстановителем, получается действием щелочи на хлорид хрома CrСl2, получаемого при взаимодействии Cr c НСl:

Соединения Cr II неустойчивы и легко окисляются кислородом воздуха:
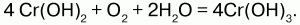
Гидроксид хрома III (Cr(OH)3)n – это сложный полимер зеленого цвета, не растворимый в воде, обладает амфотерными свойствами – растворяется в кислотах и в щелочах; реагирует с кислотами с образованием солей хрома (III):

со щелочами – с образованием сине-фиолетовых растворов – гидроксохромитов:

При сплавлении Cr(ОН)3 со щелочами получают хромиты, а с избытком – метахромиты:
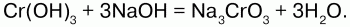
studfiles.net
Оксид хрома(III) - это... Что такое Оксид хрома(III)?

 Оксид хрома(III)
Оксид хрома(III) Окси́д хро́ма (III) Cr2O3 (сесквиоксид хрома, хромовая зелень) — очень твёрдый тугоплавкий порошок зелёного цвета.
Температура плавления 2435 °C, кипения ок. 4000 °C. Плотность 5,21 г/см³. Нерастворим в воде. По твердости близок к корунду, поэтому его вводят в состав полирующих средств.Способы получения
Термическое разложение:
1. Дихромата аммония:
(Nh5)2Cr2O7 → Cr2O3 + N2↑ + 4h3Oпри этом ощущается слабый запах аммиака, так как при разложении бихромата аммония также идет параллельная реакция с выделением аммиака. Полученная окись хрома (III) имеет в своем составе примесь хрома (II) и хрома (VI), вероятно в виде хроми-хроматов (в частности Cr5O10). Внешний вид: зелёный, с вкраплениями серого и чёрного цвета, плотность 4,6 г/см³.
2.Дихромата калия:
4K2Cr2O7 → 2Cr2O3 + 4K2CrO4 + 3O2↑,
3. Гидроксида хрома(III):
2Cr(OH)3 → Cr2O3 + 3h3O.
Химические свойства
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
Cr2O3 + 6HCl → 2CrCl3 + 3h3O
В присутствии кислорода может идти реакция: Cr2O3+h3O→Cr6+, реакция идет крайне медленно (наблюдается появление слабой жёлтой окраски), видимо за счет образования гидроксокомплекса Cr6+.
Cr2O3 + 6H+ + 9h3O → 2[Cr(h3O)6]3+.
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
Cr2O3 + 2KOH → 2KCrO2 + h3O,
Cr2O3 + Na2CO3 → 2степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата:
Cr2O3 + 3KNO3 + 2Na2CO3 → 2Na2CrO4 + 3KNO2 + 2CO2↑.,
а сильные восстановители его восстанавливают:
Cr2O3 + 2Al → Al2O3 + 2Cr.
Применение
- основной пигмент для зелёной краски
- абразив — компонент полировальных паст (например ГОИ)
- катализатор в ряде органических реакций
- компонент шихт для получения шпинелей и искусственных драгоценных камней
См. также
dic.academic.ru
Оксид хрома(VI) - это... Что такое Оксид хрома(VI)?

 Хромовый ангидрид, сохраняемый герметично.
Хромовый ангидрид, сохраняемый герметично. Окси́д хро́ма(VI) (трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде.
Ангидрид хромовой и дихромовой кислот.Свойства
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + h3O → h3CrO4,
или дихромовая кислота (при избытке CrO3):
2CrO3 + h3O → h3Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + h3O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»). Окисляет йод, серу, фосфор, уголь, например:
4CrO3 + 3S → 2Cr2O3 + 3SO2↑.
Получение
Получают действием h3SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Na2Cr2O7 + h3SO4 → 2CrO3 + Na2SO4 + h3O
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,1 г.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, и исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
См. также
dic.academic.ru
Оксид хрома (VI) - это... Что такое Оксид хрома (VI)?

Хромовый ангидрид, сохраняемый герметично.
Окси́д хро́ма(VI) (трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде.
Ангидрид хромовой и дихромовой кислот.Свойства
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл 196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см3; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + h3O → h3CrO4,
или дихромовая кислота (при избытке CrO3):
2CrO3 + h3O → h3Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + h3O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»).
Получение
Получают действием h3SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Применение
Используется для получения хрома электролизом, электролитического хромирования, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. При попадании на кожу он вызывает сильнейшие раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Весьма опасно вдыхание паров хромового ангидрида.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, и исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
См.также
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид - хром - Большая Энциклопедия Нефти и Газа, статья, страница 1
Оксид - хром
Cтраница 1
Оксид хрома ( Ш) Сг2Оз отличается очень высокой устойчивостью: на него не действуют вода, кислоты и щелочи в водном растворе. В лаборатории Сг2Оз получают термическим разложением дихромата аммония. [1]
Оксид хрома ( III) получают разложением хромата или бихромата аммония при нагревании на электроплитке. В фарфоровой чашке 30 - 35 г свежеприготовленного оксида хрома ( III) перемешивают с 60 - 65 г прокаленного асбеста, просеивают и прокаливают в потоке кислорода при 1000 С в течение 1 - 2 ч, охлаждают в потоке кислорода, ссыпают в склянку с пробкой и хранят в эксикаторе. Приготовленный хромированный асбест имеет зеленый цвет и волокнистую структуру. [2]
Оксид хрома ( Ш) проявляет амфотерные свойства: он ограниченно растворяется в кислотах и щелочах. При дальнейшем увеличении рН идет глубокий гидролиз и полимеризация, и в итоге получается гидратирован-ный оксид Сг2О3 гаН2О, который легко растворяется в минеральных кислотах и растворах щелочей. Кристаллические хромиты имеют состав М [ Сг ( ОН) 4 ] и M2 [ Cr ( OH) 5 ], M К, Na. Зеленый оксид хрома ( Ш) под названием хромовая зеленая применяется в качестве красителя. Сильнопрокаленный Сг2О3 инертен по отношению к кислотам и щелочам. [3]
Оксид хрома ( Ш) поможет показать, как вещество бесследно исчезает, исчезает без пламени и дыма. Нет пламени, нет дыма, а горка постепенно уменьшается в размерах. [4]
Оксид хрома ( Ш) поможет показать, как вещество бесследно исчеза ет, исчезает без пламени и дыма Для этого складывают горкой несколько таблеток сухого спирта ( твердого горючего на основе уротропина), а сверху насыпают щепотку предварительно разогретого в металличе ской ложечке оксида хрома ( Ш) Сг2О3 И что же. [5]
Оксид хрома Сг203 нерастворим в кислотах, сплавляется с карбонатом натрия или с бисульфатом калия, образуя соответственно хромат натрия или сульфат хрома. [6]
Оксиды хрома образуются при электродуговой сварке и наплавке сталей аустенитными электродами. Попадая в организм через органы дыхания, оксиды хрома в малых концентрациях раздражают слизистую оболочку носа, вызывая насморк и небольшое кровотечение. Отравления обычно характеризуются головными болями и общей слабостью. [7]
Оксид хрома расширяет интервал обжига эмали, повышает прочность покрытия, понижает краевой угол смачивания, являясь поверхностно-активным веществом. [9]
Оксиды хрома образуются при электродуговой сварке и наплавке сталей аустенитными электродами. Попадая в организм через органы дыхания, оксиды хрома в малых концентрациях раздражают слизистую оболочку носа, вызывая насморк и небольшое кровотечение. Отравления обычно характеризуются головными болями и общей слабостью. [10]
Оксид хрома ( 3) представляет собой порошок темно-зеленого цвета, нерастворимый в воде, кислотах и щелочах. [11]
Оксиды хрома, молибдена и вольфрама в степени окисления ( VI) проявляют в основном кислотные свойства. [13]
Оксид хрома ( Ш) Сг20з - зеленый порошок, не реагирует с водой, кислотами и щелочами. Гидроксид хрома ( Ш) Сг ( ОН) з выпадает в виде серо-голубовато-зеленого осадка из растворов солей хро-ма ( Ш) при добавлении щелочей. Сульфат хрома ( 111) - калия образует кристаллогидрат KCr ( S04) S 12h30 фиолетовой окраски, известный под названием хромокалиевых квасцов. Раствор этого соединения в зависимости от концентрации, температуры и толщины слоя окрашивается в темно-красный, фиолетовый или зеленый цвет. [14]
Оксид хрома ( 1У) CrOj - черный ферромагнитный порошок, который используется для изготовления видео - и звукомагнитных лент. [15]
Страницы: 1 2 3 4
www.ngpedia.ru