8. Хром и его соединения. Биологическая роль. Соединения хрома
Соединения хрома
Оксид хрома(II) и гидроксид хрома(II) имеют основной характер
Cr(OH) +2HCl→CrCl
+2HCl→CrCl +2H
+2H O
O
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl + 2HCl → 2CrCl
+ 2HCl → 2CrCl + H
+ H
4Cr(OH)
 + 2H
+ 2H O→4Cr(OH)
O→4Cr(OH)
Оксид хрома(III) Cr O
O - зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH) -
- →Cr
→Cr O
O + 3H
+ 3H O
O
4K
 O
O -
- → 2Cr
→ 2Cr O
O + 4K
+ 4K CrO
CrO + 3O
+ 3O
(NH )
) Cr
Cr O
O
 → Cr
→ Cr O
O + N
+ N + H
+ H O
OС концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Гидроксид хрома (III) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (III):
СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
Сr(ОН)3 + 3КОН = К3[Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH)3 + KOH = KCrO2(метахромит К) + 2h3O
Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3h3O
Соединения хрома(VI).
Оксид хрома (VI) - СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО3 + Н2О = Н2СrО4 (хромовая кислота – образуется при избытке воды)
СrО3 + Н2О =Н2Сr2О7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 2500С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат - ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr2О3 | СrО3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 Н2Сr2О7 |
Характер гидроксида | основной | амфотерный | кислотный |
| → ослабление основных свойств и усиление кислотных→ | |||
Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: h3S, SO2, FeSO4
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
studfiles.net
Соединения трехвалентного хрома
Оксид хрома (III) Cr2O3. Зеленые гексагональные микрокристаллы. tпл=2275°С, tкип=3027°С, плотность равна 5,22 г/см3. Проявляет амфотерные свойства. Антиферромагнитны ниже 33°С и парамагнитны выше 55°С. Растворяется в жидком диоксиде серы. Мало растворим в воде, разбавленных кислотах и щелочах. Получают прямым взаимодействием элементов при повышенной температуре, нагреванием CrO на воздухе, прокаливанием хромата или бихромата аммония, гидроксида или нитрата хрома (III), хромата ртути (I), бихромата ртути. Применяют в качестве зеленого пигмента в живописи и для окрашивания фарфора и стекла. Кристаллический порошок используется в качестве абразивного материала. Применяют для получения искусственных рубинов. Служит катализатором процесса окисления аммиака на воздухе, синтеза аммиака из элементов и других.
Таблица 6. [12].
| Δ H°обр | -1140,6 кДж/моль; | Δ G°298 | -1059,0 кДж/моль; | Δ S°298 | 81,2 Дж/моль.K |
Его можно получить при непосредственном взаимодействии элементов, прокаливанием нитрата хрома(III) или хромового ангидрида, разложением хромата или дихромата аммония, нагреванием хроматов металлов с углем или серой:
4Cr + 3O2 → 2Cr2O3
4Cr(NO3)3 → 2Cr2O3 + 12NO2 + 3O2
4CrO3 → 2Cr2O3 + 3O2
K2Cr2O7 + S → Cr2O3 + K2SO4
K2Cr2O7 + 2C → Cr2O3 + K2CO3 + CO .
Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен и его трудно растворить в водных кислотах и щелочах. При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
Cr2O3 + 4KOH + KClO3 →2K2CrO4 + KCl + 2h3O.
Твердость кристаллов оксида хрома(III) соизмерима с твердостью корунда, поэтому Cr2O3 является действующим началом многих шлифовальных и притирочных паст в машиностроении, оптической, ювелирной и часовой промышленности. Его также применяют в качестве зеленого пигмента в живописи и для окрашивания некоторых стекол, как катализатор гидрирования и дегидрирования некоторых органических соединений. Оксид хрома(III) довольно токсичен. Попадая на кожу, способен вызывать экзему и другие кожные заболевания. Особенно опасно вдыхание аэрозоля оксида, так как это может вызвать тяжелые заболевания. ПДК 0,01 мг/м3. Профилактика – использование средств индивидуальной защиты.
Гидроксид хрома (III) Cr(OH)3. Обладает амфотерными свойствами. Мало растворим в воде. Легко переходит с коллоидное состояние. Растворяется в щелочах и кислотах. Молярная электропроводность при бесконечном разведении при 25оС равна 795,9 Cм.см2/моль. Получают в виде студнеобразного зеленого осадка при обработке солей хрома (III) щелочами, при гидролизе солей хрома (III) с карбонатами щелочных металлов или сульфидом аммония.
Таблица 7. [12].
| Δ H°обр | -1013 кДж/моль; | Δ G°298 | -867 кДж/моль. |
Фторид хрома (III) CrF3. Парамагнитные зеленые ромбические кристаллы. tпл=1200°С [13], tкип=1427°С, плотность равна 3,78 г/см3. Растворяется в плавиковой кислоте и мало растворим в воде. Молярная электропроводность при бесконечном разведении при 25оС равна 367,2 см2/моль. Получают действием плавиковой кислоты на оксид хрома (III), пропусканием фтороводорода над нагретым до 500-1100оС хлоридом хрома (III). Водные растворы используют в производстве шелка, при переработке шерсти и фторировании галогенпроизводных этана и пропана.
Хлорид хрома (III) CrCl3. Гексагональные парамагнитные кристаллы имеют окраску цветов персикового дерева. Расплываются на воздухе. tпл=1150°С, плотность равна 2,87 г/см3. Безводный CrCl3 мало растворим в воде, спирте, эфире, ацетальдегиде, ацетоне. Восстанавливается при высокой температуре до металлического хрома кальцием, цинком, магнием, водородом, железом. Молярная электропроводность при бесконечном разведении при 25оС равна 430,05 см2/моль. Получают прямым взаимодействием элементов при нагревании, действием хлора на нагретую до 700-800оС смесь оксида хрома (III) с углем или на нагретый до красного каления сульфид хрома (III). Применяют в качестве катализатора в реакциях органического синтеза.
Таблица 8.
| Δ H°обр | -570 кДж/моль; | Δ G°298 | -501 кДж/моль; | Δ S°298 | 124,7 Дж/моль.K [12]. |
в безводном состоянии кристаллическое вещество, имеющее окраску цветов персикового дерева (близкая к фиолетовой), трудно растворимое в воде, спирте, эфире и пр. даже при кипячении. Однако в присутствии следовых количеств CrCl2 растворение в воде наступает быстро с большим выделением тепла. Может быть получен при взаимодействии элементов при температуре красного каления, обработкой хлором смеси оксида металла и угля при 700–800°С, или взаимодействием CrCl3 с парами CCl4 при 700-800°С:
Cr2O3 + 3C + 3Cl2 → 2CrCl3 + 3CO
2Cr2O3 + 3CCl4 → 4CrCl3 + 3CO2.
Образует несколько изомерных гексагидратов, свойства которых зависят от числа молекул воды, находящихся во внутренней координационной сфере металла. Хлорид гексааквахрома (III) (фиолетовый хлорид Рекура) [Cr(h3O)6]Cl3 – кристаллы серовато-синего цвета, хлорид хлорпентааквахрома(III) (хлорид Бьеррума) [Cr(h3O)5Cl]Cl2•h3O – гигроскопичное светло-зеленое вещество; хлорид дихлортетрааквахрома (III) (зеленый хлорид Рекура) [Cr(h3O)4Cl2]Cl•2h3O – темно-зеленые кристаллы. В водных растворах устанавливается термодинамическое равновесие между тремя формами, зависящее от многих факторов. Структуру изомера можно определить по количеству осаждаемого им хлорида серебра из холодного азотнокислого раствора AgNO3, так как хлорид-анион, входящий во внутреннюю сферу, с катионом Ag+ не взаимодействует. Безводный хлорид хрома применяется для нанесения покрытий хрома на стали химическим осаждением из газовой фазы, является составной частью некоторых катализаторов. Гидраты CrCl3 – протрава при крашении тканей. Хлорид хрома(III) токсичен.
Бромид хрома (III) CrBr3. Зеленые гексагональные кристаллы. tпл=1127°С, плотность равна 4,25 г/см3. Сублимируется при 927°С. Восстанавливается до CrBr2 водородом при нагревании. Разлагается щелочами и растворяется в воде только в присутствии солей хрома (II). Молярная электропроводность при бесконечном разведении при 25оС равна 435,3 см2/моль. Получают действием паров брома в присутствии азота на металлический хром или на смесь оксида хрома (III) с углем при высокой температуре.
Иодид хрома (III) CrI3. Фиолетово-черные кристаллы. Устойчив на воздухе при обычной температуре. При 200°С реагирует с кислородом с выделением йода. Растворяется в воде в присутствии солей хрома (II). Молярная электропроводность при бесконечном разведении при 25оС равна 431,4 см2/моль. Получают действием паров йода на нагретый до красного каления хром.
Оксифторид хрома (III) CrOF. Твердое зеленое вещество. Плотность равна 4,20 г/см3 [5]. Устойчив при повышенной температуре и разлагается при охлаждении. Получают действием фтороводорода на оксид хрома (III) при 1100оС.
Сульфид хрома (III) Cr2S3. Парамагнитные черные кристаллы. Плотность равна 3,60 г/см3. Гидролизуется водой. Плохо реагирует с кислотами, но окисляется азотной кислотой, царской водкой или расплавами нитратов щелочных металлов. Получают действием паров серы на металлический хром при температуре выше 700оС, сплавлением Cr2O3 с серой или K2S, пропусканием сероводорода над сильно нагретыми Cr2O3 или CrCl3.
Сульфат хрома (III) Cr2(SO4)3. Парамагнитные фиолетово-красные кристаллы. Плотность равна 3,012 г/см3. Безводный сульфат хрома (III) мало растворим в воде и кислотах. При высокой температуре разлагается. Водные растворы окрашены в фиолетовый цвет на холоду и в зеленый - при нагревании. Известны кристаллогидраты CrSО4•nН2О (n=3, 6, 9, 12, 14, 15, 17, 18). Молярная электропроводность при бесконечном разведении при 25оС равна 882 см2/моль. Получают дегидратацией кристаллогидратов или нагреванием Cr2O3 с метилсульфатом при 160-190оС. Применяют при дублении кож и в качестве протравы при крашении в ситценабивном производстве.
Ортофосфат хрома (III) CrPO4. Черный порошок. tпл=1800°С, плотность равна 2,94 г/см3. Мало растворим в воде. Медленно взаимодействует с горячей серной кислотой. Известны кристаллогидраты CrРО4•nН2О (n=2, 3, 4, 6). Молярная электропроводность при бесконечном разведении при 25оС равна 408 см2/моль. Получают дегидратацией кристаллогидратов.
Хромокалиевые квасцы K2SO4•Cr2(SO4)3•24h3O, темно-фиолетовые кристаллы, довольно хорошо растворимые в воде. Могут быть получены при выпаривании водного раствора, содержащего стехиометрическую смесь сульфатов калия и хрома, или восстановлением дихромата калия этанолом:
Cr2(SO4)3 + K2SO4 + 24h3O →K2SO4•Cr2(SO4)3•24h3O↓ (при выпаривании)
K2Cr2O7 + 3C2H5OH + 4h3SO4 + 17h3O→K2SO4•Cr2(SO4)3•24h3O↓ + 3Ch4CHO
Хромокалиевые квасцы применяются главным образом в текстильной промышленности, при дублении кожи.
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью [9].
studfiles.net
Соединения двухвалентного хрома
Оксид хрома (II) CrO. Пирофорный черный порошок. На воздухе при температуре выше 100°С превращается в Cr2O3. Обладает основными свойствами. Растворяется в разбавленной хлороводородной кислоте. Мало растворим в разбавленных серной и азотной кислотах. Восстанавливается водородом до металлического хрома при 1000°С. Получают окислением амальгамы хрома CrHg3 или CrHg азотной кислотой или кислородом воздуха.
Гидроксид хрома (II) Cr(OH)2. Получают в виде желтого осадка, обрабатывая растворы солей хрома (II) щелочами в отсутствие кислорода. При высушивании этого осадка получают коричневый порошок, который обладает основными свойствами, мало растворим в воде и в разбавленных кислотах. Растворяется в концентрированных кислотах. Является восстановителем. При прокаливании превращается в Cr2O3.
Фторид хрома (II) CrF2. Зеленые нелетучие кристаллы. tпл=1100°С, tкип=2127°С [5], плотность равна 4,11 г/см3. Ограниченно растворим в воде, мало растворим в спирте. Растворяется в горячей хлороводородной кислоте. Восстанавливается водородом при повышенной температуре. Получают действием плавиковой кислоты на раскаленный металлический хром или на оксид хрома (II) при обычной температуре.
Хлорид хрома (II) CrCl2. Сильно гигроскопичные блестящие белые кристаллы. tпл=824°С, tкип=1302°С, плотность равна 2,93 г/см3. Растворяется в воде. Проявляет восстановительные свойства. Известны кристаллогидраты CrCl2•nН2О (n=2, 3, 4). Получают нагреванием до красного каления металлического хрома в токе газообразного HCl, дегидратацией кристаллогидратов и электролизом хлорида хрома (III) в щелочной среде.
Катион Cr2+ бесцветен, но в водных растворах находится в гидратированном состоянии и окрашен в синий цвет. Гидрат хлорида хрома(II) можно получить растворением металлического хрома в соляной кислоте без доступа воздуха или восстановлением водного раствора хлорида хрома(III) цинком в кислой среде без доступа воздуха:
Cr + 2HCl(aq) = CrCl2(aq) + h3
2CrCl3(aq) + 2Zn(Hg) = 2CrCl2(aq) + ZnCl2.
Безводная соль получается путем взаимодействия хрома с газообразным хлороводородом при температуре красного каления или восстановлением безводного хлорида хрома(III) водородом при 450°С:
Cr + 2HCl = CrCl2 + h3↑
2CrCl3 + h3 = 2CrCl2 + 2HCl.
Хлорид хрома(II) – очень сильный восстановитель, легко окисляется даже кислородом воздуха, что используется в газовом анализе для количественного поглощения О2. Находит ограниченное применение при получении хрома электролизом расплавов солей и хроматометрии.
Бромид хрома (II) CrBr2. Желтовато-белые гексагональные кристаллы. tпл=842°С, tкип=1127°С [5], плотность равна 4,356 г/см3. Растворяется в воде и спирте, устойчив в сухом и окисляется во влажном воздухе. Получают действием бромоводородной кислоты на нагретый до красного каления хром, восстановлением бромида хрома (III) водородом.
Иодид хрома (II) CrI2. Сильно гигроскопичные коричнево-красные игольчатые кристаллы. tпл=795°С, tкип=827°С, плотность равна 5,02 г/см3. Хорошо растворяется в воде. Термически диссоциирует при 600оС с выделением металлического хрома. Эту реакцию используют для хромирования железа и стали. Получают пропусканием паров йода над нагретым до 700-800°С порошкообразным хромом, а также растворением хрома в йодоводородной кислоте.
Сульфид хрома (II) CrS. Парамагнитные черные кристаллы в форме призм (или аморфный темно-серый порошок). tпл=1550°С, плотность равна 4,85 г/см3 . Разлагается (перед плавлением) при 1350оС, легко окисляется в нагретом воздухе и превращается в CrCl3 под действием хлора. Получают прямым взаимодействием элементов при 700оС, действием сероводорода на металлический хром или хлорид хрома (II) при нагревании.
Сульфат хрома (II) CrSO4. Белый порошок. Растворим в воде. Водный раствор обладает восстановительными свойствами, энергично поглощает кислород из воздуха. Легко окисляется и восстанавливает соли висмута (III) и олова (IV). Известны кристаллогидраты CrSО4•nН2О (n=1, 5, 7). Водные растворы получают восстановлением водных растворов сульфата хрома (III), а также действием разбавленной серной кислоты на металлический хром.
Из-за высокой восстановительной способности хрома в щелочной среде, получить гидроксид хрома Cr(OH)2 желтого цвета при взаимодействии CrCl2 со щелочью достаточно трудно. Осадок, обычно, содержит хром в более высоких степенях окисления и окрашен в коричневый цвет. Чистый Cr(OH)2 не проявляет амфотерности и растворяется только в кислотах:
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединения хрома (II) проявляют сильные восстановительные свойства и легко окисляются кислородом воздуха до соединений хрома (III):
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3 [12]
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
Cr(OH)3 + NaOH + 2h3O → Na[Cr(OH)4(h3O)2] + 2NaOH→ Na3[Cr(OH)6]
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na3[Cr(OH)6] + 3h3O2 → 2Na2CrO4 + 2NaOH + 8h3O.
Гидроксид хрома (III) получают осаждением из соответствующих солей:
CrCl3+ 3NaOH → Cr(OH)3↓ + 3NaCl
При растворении гидроксида хрома (III) в соляной кислоте образуются соли, которые могут быть окрашены в различный цвет. Различная окраска солей хрома обусловлена гидратной изомерией, то есть числом координированных хромом (III) молекул воды: [Cr(h3O)6]Cl3 — фиолетовый, [Cr(h3O)5Cl]Cl2 — темно-зеленый, [Cr(h3O)5Cl2]Cl — светло-зеленый.
Гидроксокомплексы хрома Na[Cr(OH)4(h3O)2] и Na3[Cr(OH)6] окрашены в ярко-зеленый цвет. Степень окисления +3 наиболее устойчива для хрома, поэтому перевести хром в состояние со степенью окисления +2 и +6 можно только сильными восстановителями и сильными окислителями соответственно. Например, окислить гидроксохромат (III) натрия до Cr(VI) можно бромной водой:
Na3[Cr(OH)6] + Br2 + 2NaOH → Na2CrO4 + 2NaBr + 4h3O
Растворимые соли хрома (III) в водных растворах сильно гидролизуются. Вследствие этого нельзя получить соли, содержащие хром в степени окисления +3 с анионами слабых кислот по обменным реакциям. Вместо солей в таких случаях образуется гидроксид хрома (III).
2CrCl3 + 3Na2CO3 + 3h3O → 2Cr(OH)3↓ + 3CO2↑ + 6NaCl [9]
studfiles.net
8. Хром и его соединения. Биологическая роль.
Хром – серебристый металл. Совершенно чистый хром довольно вязок, ковок и тягуч.
При малейшем загрязнении углеродом, водородом, азотом и т.д. становится хрупким, ломким и твердым. Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности.
Хром пассивируется разбавленной и концентрированной азотной кислотой, царской водкой, и даже при кипячении металла с этими реагентами растворяется лишь незначительно. Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот.Тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
Cr + 2HCl → CrCl2+ h3.
При нагревании металлический хром соединяется с галогенами, серой, кремнием, бором, углеродом и некоторыми другими элементами:
Cr + 2F2→ CrF4(с примесью CrF5)
2Cr + 3Cl2 → 2CrCl3
2Cr + 3S → Cr2S3
При нагревании хрома с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов получаются соответствующие хроматы(VI):
2Cr + 2Na2CO3 + 3O2 → 2Na2CrO4 + 2CO2.
Для получения хрома необходимо из хромистого железняка получить возможно более чистый оксид хрома (III), а из него хром получают алюмотермическим восстановлением:
Cr2O3+ 2Al → 2Cr + 2Al2O3.
Хром образует множество соединений, в которых он может находиться во всех степенях окисления от 0 до +6. Соединения двухвалентного хрома малоустойчивы. Наиболее устойчивы производные хрома (III). Также довольно устойчивыми являются соединения Cr(VI). Но они легко восстанавливаются до соединений трехвалентного хрома довольно слабыми восстановителями (йодоводород, сероводород, спирт).
Соединения хрома (II)
Для хрома в степени окисления +2 характерно координационное число 6. В этой степени окисления хром имеет небольшое количество соединений (дигалиды CrHal2,оксид CrOи соответствующий ему гидроксидCr(OH)2). Водные растворы соединений хрома(II) небесно-голубого цвета, тогда как безводные соли бесцветны. Все соединения хрома (II) являются сильными восстановителями. Ион Cr2+подобно активным металлам способен восстанавливать водород из воды, переходя в производные Cr(+3):
2CrCl2 + 2h3O → 2Cr(OH)Cl2 + h3
Хлорид хрома (II) CrCl2.Вбезводном состоянии представляет собой белые кристаллы с шелковистым блеском. Безводная соль получается путем взаимодействия хрома с газообразным хлороводородом при температуре красного каления или восстановлением безводного хлорида хрома(III) водородом при 450° С:
Cr+ 2HCl→CrCl2+h3
2CrCl3+h3→ 2CrCl2+ 2HCl.
Оксид хрома(II) CrO (черный) образуется при свободном окислении хрома, растворенного в ртути, на воздухе. При небольшом нагревании CrOдиспропорционирует:
3CrO→Cr2O3 +Cr.
При сильном нагревании в токе водорода CrOвосстанавливается до металла.
Гидроксид хрома(II) Cr(OH)2(желтого цвета) получают взаимодействием дихлорида хрома со щелочами, в отсутствие кислорода воздуха:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl.
Обладает только основными свойствами и легко растворяется в кислотах с образованием соответствующих солей Cr(+2):
Cr(OH)2 + 2HCl → CrCl2 + 2h3O.
Соединения хрома (III)
Оксид хрома(III) Cr2O3представляет собой темно-зеленый порошок, а в кристаллическом состоянии – черный с металлическим блеском. Нерастворим в воде. Его можно получить при непосредственном взаимодействии элементов:
4Cr+ 3O2→ 2Cr2O3,
прокаливанием нитрата хрома(III) или хромового ангидрида:
4Cr(NO3)3 → 2Cr2O3 + 12NO2 + 3O2,
4CrO3→ 2Cr2O3+ 3O2,
разложением хромата или дихромата аммония:
(Nh5)2Cr2O7 → Cr2O3 + N2 + 4h3O,
K2Cr2O7 + S → Cr2O3 + K2SO4,
K2Cr2O7 + 2C → Cr2O3 + K2CO3 + CO.
Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен, и его трудно растворить в водных растворах кислот и щелочей:
Cr2O3 + 6HCl→ 2CrCl3+ 3h3O,
Cr2O3 + 6NaOH + 3h3O → 2Na3[Cr(OH)6].
При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
Cr2O3+ 4KOH+KClO3→ 2K2CrO4+KCl+ 2h3O.
Гидрат оксида хрома (III)Cr2O3*nh3O, содержащий переменное количество воды, обычно называется гидроксидом хрома. Его можно получить косвенным путем при взаимодействии раствора аммиака с раствором солиCr(+3):
CrCl3 + 3(Nh4 * h3O) → Cr(OH)3 + 3Nh5Cl.
Свежеполученный Cr(OH)3хорошо растворяется в растворах кислот и щелочей:
Cr(OH)3 + 3HCl → CrCl3 + 3h3O,
Cr(OH)3 + 3NaOH → 2Na3[Cr(OH)6]
Хлорид хрома(III) CrCl3. В безводном состоянии кристаллическое вещество, имеющее окраску близкую к фиолетовой, трудно растворимое в воде, спирте, эфире даже при кипячении. Однако в присутствии CrCl2растворение в воде наступает быстро с большим выделением тепла. Может быть получен при взаимодействии элементов при температуре красного каления:
2Cr+ 3Cl2→ 2CrCl3,
Хромовые квасцы. Из смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль KCr(SO4)2* 12h3O, которая по составу и кристаллической структуре полностью соответствует квасцам KAl(SO4)2* 12h3O. Эту двойную соль называют хромовыми (хромокалиевыми) квасцами. Хромовые квасцы представляют собой темно-фиолетовые кристаллы, довольно хорошо растворимые в воде. Они могут быть получены при выпаривании водного раствора, содержащего стехиометрическую смесь сульфатов калия и хрома или восстановлением дихромата калия этанолом.
Соединения хрома (VI)
Степень окисления хрома +6 проявляется в галогенидах, оксогалогенидах, оксидах и отвечающих им анионных комплексах. Для хрома (VI) характерно координационное число 4, что отвечает тетраэдрическому строению его анионных комплексов и структурных единиц.
Оксид хрома (VI) (хромовый ангидрид), CrO3, представляет собой расплывающиеся на воздухе красные кристаллы, легко растворимые в воде. Оксид хрома (VI) очень ядовит.
Легче всего CrO3 получается при добавлении концентрированной серной кислоты к раствору дихромата натрия или калия:
К2Cr2O7 + h3SO4(конц.) → 2CrO3 + К2SO4 + h3O,
При растворении в воде, в зависимости от концентрации, образует хромовые кислоты различного состава:
CrO3+ h3O → h3CrO4(желтый раствор)
2CrO3+ h3O → h3Cr2O7(оранжевый раствор)
3CrO3 + h3O → h3Cr3O10(красный раствор)
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3→ 2Cr2O3+ 3O2.
Как и все соединения Cr(VI), CrO3является сильным окислителем (восстанавливается до Cr2O3). Например, этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним.
Хромат калия K2CrO4. Светло-желтые кристаллы, хорошо растворимые в воде. Может быть получен при сплавлении Cr2O3с KOH в присутствии окислителей:
CrO3+ 2KOH→K2CrO4+h3O
Хромат калия, как и все соединения хрома (VI), – сильный окислитель.
Дихромат калия (хромпик) K2Cr2O7. Оранжевое кристаллическое вещество, умеренно растворимое в воде (13% при 25°). Получается при подкислении водного раствора хромата калия:
2K2CrO4+h3SO4→K2Cr2O7+K2SO4+h3O
взаимодействием гидроксида или карбоната калия с хромовым ангидридом:
2CrO3+ 2KOH→K2Cr2O7+h3O
2CrO3+K2CO3→K2Cr2O7+CO2.
Дихромат калия – сильный окислитель, ядовит.
Карбонилы хрома
Для хрома известен карбонил состава Cr(CO)6. Это бесцветное легко возгоняющееся твердое вещество
В нулевой степени окисления атомам хрома соответствует электронная конфигурация d6.
За счет шести свободных орбиталей Cr(0) присоединяет 6 молекул СО. СтабилизацияCr(CO)6достигается за счет π - дативного взаимодействияCrCO, в котором принимают участие 3d–электронные пары атома хрома и свободные πразр- орбитали молекул СО.
Биологическая роль хрома
Хром – микроэлемент, необходимый для нормального развития и функционирования человеческого организма. Установлено, что в биохимических процессах принимает участие только трехвалентный хром. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови, хром принимает участие в регуляции обмена холестерина и является активатором некоторых ферментов.
studfiles.net
Соединения хрома. Оксиды, гидроксиды. Хроматы. Дихроматы. Окислительные свойства соединений хрома (VI).
Количество просмотров публикации Соединения хрома. Оксиды, гидроксиды. Хроматы. Дихроматы. Окислительные свойства соединений хрома (VI). - 916
Хром и его соединения активно используются в промышленном производстве, в частности, в металлургии, химической и огнеупорной промышленности.
Хром Cr - химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996, радиус атома 0,0125, радиусы ионов Cr2+ - 0,0084; Cr3+ - 0,0064; Cr4+ - 6,0056.
Хром проявляет степени окисления +2, +3, +6, соответственно имеет валентности II, III, VI.
Хром представляет собой твердый, пластичный, довольно тяжелый, ковкий металл серо-стального цвета.
Кипит при 24690С, плавится при 1878± 220С. Обладает всеми характерными свойствами металлов - хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет блеск, присущий большинству металлов. И в то же время, устойчив к коррозии на воздухе и в воде.
Примеси кислорода, азота и углерода, даже в самых малых количествах, резко изменяют физические свойства хрома, к примеру, делая его очень хрупким. Но, к сожалению, получить хром без этих примесей очень трудно.
Структура кристаллической решетки - объёмноцентрированная кубическая. Особенностью хрома является резкое изменение его физических свойств при температуре около 37°С.
6. Виды соединений хрома.
1.Оксиды
Оксид хрома (II) CrO (основной) - сильный восстановитель, чрезвычайно неустойчив в присутствии влаги и кислорода. Практического значения не имеет.
Оксид хрома (III) Cr2O3 (амфотерный) устойчив на воздухе и в растворах.
Cr2O3 + h3SO4 = Cr2(SO4)3 + h3O
Cr2O3 + 2NaOH = Na2CrO4 + h3O
Образуется при нагревании некоторых соединений хрома (VI), к примеру:
4CrO3 2Cr2O3 + 3О2
(Nh5)2Cr2O7 Cr2O3 + N2 + 4h3O
4Cr + 3O2 2Cr2O3
Оксид хрома (III) используется для восстановления металлического хрома невысокой чистоты с помощью алюминия (алюминотермия) или кремния (силикотермия):
Cr2O3 +2Al = Al2O3 +2Cr
2Cr2O3 + 3Si = 3SiO3 + 4Cr
Оксид хрома (VI) CrO3 (кислотный) - темно малиновые игольчатые кристаллы.
Получают действием избытка концентрированной h3SO4 на насыщенный водный раствор бихромата калия:
K2Cr2O7 + 2h3SO4 = 2CrO3 + 2KHSO4 + h3O
Оксид хрома (VI) - сильный окислитель, одно из самых токсичных соединений хрома.
При растворении CrO3 в воде образуется хромовая кислота h3CrO4
CrO3 + h3O = h3CrO4
Кислотный оксид хрома, реагируя со щелочами, образует желтые хроматы CrO42
CrO3 + 2KOH = K2CrO4 + h3O
2.Гидроксиды
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в
кислотах (ведет себя как основание),так и в щелочах (ведет себя как кислота):
2Cr(OH)3 + 3h3SO4 = Cr2(SO4)3 + 6h3O
Cr(OH)3 + KOH = K[Cr(OH)4]
Cr(OH)3 + NaOH = NaCrO2 + 2h3O
При прокаливании гидроксида хрома (III) образуется оксид хрома (III) Cr2O3.
Нерастворим в воде.
2Cr(OH)3 = Cr2O3 + 3h3O
3.Кислоты
Кислоты хрома, отвечающие его степени окисления +6 и различающиеся соотношением числа молекул CrO3 и h3O, существуют только в виде растворов. При растворении кислотного оксида CrO3, образуется монохромовая кислота (просто хромовая) h3CrO4.
CrO3 + h3O = h3CrO4
Подкисление раствора или увеличение в нем CrO3 приводит к кислотам общей формулы nCrO3 h3O
при n=2, 3, 4 это, соответственно, ди, три, тетрохромовые кислоты.
Самая сильная из них - дихромовая, то есть h3Cr2O7. Хромовые кислоты и их соли- сильные окислители и ядовиты.
4.Соли
Различают два вида солей: хромиты и хроматы.
Хромитами с общей формулой RCrO2 называются соли хромистой кислоты HCrO2.
Cr(OH)3 + NaOH = NaCrO2 + 2h3O
Хромиты обладают различной окраской - от темно коричневой до совершенно черной и обычно встречаются в виде сплошных массивов. Хромит мягче многих других минералов, температура плавления хромита зависит от его состава 1545-1730 0С.
Хромит имеет металлический блеск и почти нерастворим в кислотах.
Хроматы - соли хромовых кислот.
Соли монохромовой кислоты h3CrO4 называют монохроматами (хроматы) R2CrO4, соли дихромовой кислоты h3Cr2O7 дихроматы (бихроматы) - R2Cr2O7. Монохроматы обычно окрашены в желтый цвет. Οʜᴎ устойчивы только в щелочной среде, а при подкислении превращаются в оранжево-красные бихроматы:
2Na2CrO4 + h3SO4 = Na2Cr2O7 + Na2SO4 + h3O
referatwork.ru
Исследование свойств хрома и его соединений
Министерство образования Российской Федерации
ГИМНАЗИЯ №1
Кафедра Химии
ТВОРЧЕСКАЯ РАБОТА
ИССЛЕДОВАНИЕ СВОЙСТВ ХРОМА И ЕГО СОЕДИНЕНИЙ
Пояснительная записка
Руководитель Г.И. Астахова
Выполнил ученик 9 "В" класса Б.А.Кулаев
Красноярск, 2001 г.
Содержание
Содержание.............................................................................................................................. 2
Введение...................................................................................................................................... 3
1.Исторические сведения............................................................................................ 4
2. Хром в природе.................................................................................................................. 6
3. Свойства хрома. Теоретическая часть...................................................... 7
3.1 Общие сведения............................................................................................................... 7
3.2 Физические свойства.................................................................................................... 8
3.4 Соединения хрома....................................................................................................... 12
3.4.1 Оксиды....................................................................................................................... 12
3.4.2 Гидроксиды.............................................................................................................. 13
3.4.3 Кислоты.................................................................................................................... 13
3.4.4 Соли............................................................................................................................ 14
4. Свойства хрома. Экспериментальная часть...................................... 14
4.1 Опыт №1. Получение оксида хрома (III)............................................................ 14
4.2 Опыт №2. Исследование свойств оксида хрома (III)................................... 15
4.3 Опыт №3.Окислительные свойства солей хрома (VI).................................. 16
4.4 Опыт №4. Исследование свойств солей хрома (VI)...................................... 16
4.5 Опыт №5. Переход хромата в бихромат и обратно....................................... 17
4.6 Опыт №6. Получение малорастворимых солей хромовых кислот....... 17
4.7 Опыт №7. Получение гидроксида хрома........................................................... 18
5. Применение хрома...................................................................................................... 18
5.1 Хромирование................................................................................................................ 20
5.2 Сплавы............................................................................................................................... 22
6. Экологические проблемы................................................................................... 24
Заключение........................................................................................................................... 26
Литература.............................................................................................................................. 27
Приложение А....................................................................................................................... 28
Введение
Хром и его соединения активно используются в промышленном производстве, особенно в металлургии, химической, огнеупорной промышленности. Область его применения достаточно широка, поэтому углубленное изучение свойств хрома является необходимым дополнением к соответствующим разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует.
Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента.
1. Исторические сведения
В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец. Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.Паллас. «Березовские копи, - писал он, - состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная... Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в ква рц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску...». Минерал был назван «сибирским красным свинцом». Впоследствии за ним закрепилось название «крокоит».
Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу. «Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, - писал Воклен в своем отчете, - были получены из этого (Березовского) золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились и теперь этот минерал покупают на вес золота, в особенности, если он желтый. Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе... Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден; большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале...»
В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был оксид шестивалентного хрома) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был выделен новый элемент. Один из друзей Воклена предложил ему назвать элемент хромом (по-гречески «хрома» - окраска) из-за яркого разнообразного цвета его соединений. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово «хром» в списки известных науке элементов.
В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома. В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом - феррохром. Впервые феррохром был получен в 1820 году восстановлением смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан первый патент на хромистую сталь.
2. Хром в природе
Среднее содержание хрома в земной коре 83 г/т, по массе содержание хрома в земной коре составляет 0,035%, в воде морей и океанов 2´10-5 мг/л. Мировые подтвержденные запасы хромовых руд составляют 1,8 млрд. т. Более 60% сосредоточено в ЮАР. Крупными запасами обладают Зимбабве, Казахстан Турция, Индия, Бразилия. Руды хрома имеются в Новой Каледонии, на Кубе, в Греции, Югославии. В то же время такие промышленные страны, как Англия, Франция, ФРГ, Италия, Швеция, совершенно лишены хромового сырья, а США и Канада располагают лишь очень бедными рудами [1]. Запасы хромовых руд России сосредоточены главным образом в группе Сарановских месторождений (Верблюжьегорское, Алапаевское, Халиловское и др.) на Урале (Пермская область) и составляют 6,4 млн. т. (0,36% от мировых запасов).
Добыча хромовых руд в мире составляет около 12 млн. т. в год, в том числе 108 тыс. т. в России. Главные производители товарной хромовой руды - ЮАР, Казахстан, на долю которых приходится более 60% добычи сырья ежегодно.
В Красноярском крае месторождения хрома отсутствуют. Но на правом берегу р.Енисей, в устье р.Березовой (к югу от устья р. Подкаменная Тунгуска) есть рудопроявление с выходом пород 1,5´4 м, возраст пород оценивается в 500 млн. лет. Содержание чистого хрома в руде порядка 42% .
По содержанию Cr2 O3 хромовые руды подразделяются на очень богатые (более 65%), богатые (65-52%), средние (52-45%), бедные (45-30%), убогие (30-10%). Руды, содержащие более 45% Cr2 O3 не требуют обогащения.
3. Свойства хрома. Теоретическая часть
3.1 Об щие сведения
Хром Cr - химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996, радиус атома 0,0125, радиусы ионов Cr2+ - 0,0084; Cr3+ - 0,0064; Cr4+ - 6,0056. Имеет четыре стабильных изотопа с атомными массами 50, 52, 53, 54, распространенность которых в природе составляет 4,35%, 83,79%, 9,50%, 2,36%. Обычно хром проявляет степени окисления +2, +3, +6 (валентности II, III, VI соответственно) [4].Рисунок 1- Структура атома хрома
mirznanii.com
Металлоорганические соединения хрома - Справочник химика 21
Известны металлоорганические соединения хрома(П1), в которых органические радикалы присоединены к хрому тремя валентными связями. [c.243]Окислы, соли, металлоорганические и другие соединения хрома [c.482]
Металлоорганические соединения могут быть определены наиболее просто как соединения, содержащие связь углерод — металл. Такое определение исключает вещества, подобные ацетату и метилату натрия, поскольку они содержат связи кислород — металл. К числу обычных металлов, образующих относительно устойчивые органические производные, относятся щелочные металлы 1 группы периодической системы (литий, натрий и калий), щелочноземельные металлы 2 группы (магний и кальций), алюминий из 3 группы, олово и свинец из 4 группы и переходные металлы, такие, как цинк, кадмий, железо, никель, хром и ртуть. Органическими остатками могут быть алкил, алкенил, алкинил или арил. Ниже приведены некоторые типичные примеры. [c.306]
На примере металлоорганических соединений хрома, при химическом связывании которых с поверхностью алюмосиликата или силикагеля протекает полимеризация, изучен механизм образования гракс-полимеров и сополимеров диенов. Металлоорганический катализ на поверхности открывает новые перспективы и для полимеризации олефинов. [c.115]Карабанов Н. Т., Прохорова Л. Ю. Исследование неподвижных жидких фаз для газохроматографического разделения металлоорганических соединений хрома и ванадия. Сб. Физико-химические методы анализа . Горький, 1981, с. 72. [c.243]
Металлы, имеющие каталитическое действие в виде металлоорганических соединений, следующие алюминий, кобальт, железо, хром, цирконий, ванадий, натрий, калий, литий, цинк и др. Их каталитическое действие проявляется эффективно особенно в присутствии хлористого никеля и четыреххлористого титана [187 [. [c.321]
| Рис. 16. Спектры металлического хрома с объемноцентрированной кубической решеткой, некубического карбида (СГ7С3) и двух металлоорганических соединений хрома. | 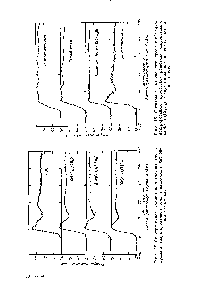 |
Кроме диспергирования воды в мазуте, уменьшить содержание сажистых частиц в продуктах его сгорания можно за счет применения присадок. В качестве таких присадок в большинстве случаев используют металлоорганические соединения, которые в процессе сгорания топлива распадаются с образованием окисла металла, являющегося катализатором в реакциях окисления частиц сажи. Проведенные исследования по изучению действия присадок показали, что железо, марганец, кобальт, никель и хром существенно снижают образование сажи при сжигании нефтепродуктов, а эффективность применения натрия, цинка, свинца, ванадия мала. [c.353]
Среди других металлоорганических соединений высокими антидетонационными свойствами обладают некоторые соединения, содержащие железо, медь, кобальт, хром, калий, теллур, таллий и др. Наиболее исследованы в качестве антидетонаторов соединения железа и меди пентакарбонил железа (ПКЖ), дициклонентадиенил железа (ферроцен) и внутрикомплексные солн меди. Физические свойства железоорганических антидетонаторов приведены в табл. 5. 36. [c.306]
Электрохимия относится к тем разделам химической науки, которые на протяжении последних десятилетий развивались особенно быстро и достигли уровня, при котором, подобно химической термодинамике, могут служить надежной основой химической технологии. Уже в настоящее время электрохимические методы широко и плодотворно используют в промышленности. Они лежат в основе таких многотоннажных производств, как получение хлора и каустической соды, кислородных соединений хлора, марганца, хрома, надсерной кислоты, элементного фтора, некоторых органических и металлоорганических соединений. Эти методы составляют основу технологии получения многих металлов, включая алюминий, магний, медь, цинк, свинец, бериллий, титан. С их помощью наносят защитные декоративные металлические покрытия на изделия мащиностроения и приборостроения. [c.5]
Кроме фосфитов и сернистых соединений в качестве антикоррозийных присадок заявлены некоторые соли высших жирных кислот, например олеат хрома, а также некоторые металлоорганические соединения. [c.711]
Карбонильные соединения хрома и других металлов VI группы взаимодействуют с ароматическими соединениями при повышенных температурах, а также, возможно, и высоких давлениях с образованием арнлкарбонильных соединений, как, например, СбНбСг (СО) 3 — твердого вещества с температурой плавления 162—163° С. Эти арилкарбонильные соединения предложено использовать в качестве присадок к топливам, катализаторов в органических синтезах и для производства металлических зеркал Указывается, что при использовании металлоорганических соединений хрома в качестве антидетонационных присадок снижаются отложения на стенках цилиндров двигателей по сравнению с обычными добавками [c.143]
Процесс заключается в следующем. Пары МОС из испарителя поступают в реактор, где помещаются предметы, которые требуется покрыть слоем металла, нагретые до температуры, превышающей температуру разложения хроморганического соединения. При контакте с нагретой поверхностью происходит разложение МОС и образуется хромовая пленка. В связи с тем, что каждое из входящих в смесь хроморганических соединений обладает индивидуальной температурой кипения и давлением паров, а а также определенной температурой разложения, возникают трудности в поддержании требуемой концентрации паров металлоорганического соединения хрома в реакторе, а следовательно, и в постоянстве скорости образования хромового покрытия и, главное, в воспроизводимости электрофизических параметров, таких, как сопротивление хромовых пленок. В связи с этим при использовании бисареновых соединений переходных металлов для получения металлических покрытий термическим разложением возникает необходимость разделения этих соединений на индивидуальные вещества. [c.104]
Можно видеть, что в основном продукте содержатся элементы, способные образовывать соединения данного типа. В большом количестве в синтезируемом МОС присутствуют примеси непрореа-гировавших исходных веществ и побочных продуктов реакции. Так, при синтезе бисареновых зт-комплексов получается смесь гомологов и изомеров [4—6]. Содержание основных продуктов син теза металлоорганических соединений хрома, молибдена и ванадия приведены в табл. 2. [c.135]
Однако несмотря на хорошее разделение хроматографических полос очищаемое МОС методом препаративной газовой хроматографии может быть загрязнено продуктами взаимодействия с жидкой фазой. Был испытан метод жидкостной термодиффузии для разделения смеси металлоорганических соединений хрома. Работа проводилась на колонне высотой 0,5 м. Разделение смеси бисэтилбензолхрома и эти.тбензолдиэтилбензолхрома в течение 5 суток работы колонны не привело к положительному результату. Однако, как и при кристаллизации, отделение инородных примесей шло успешно. [c.147]
В металлоорганических соединениях хром, как правило, пятивалентен, например в производных с 3, 4 или 5 фенильпыми группами. [c.259]
В. Н. Кострюков — термодинамические функции веществ в конденсированном состоянии, температуры и изменения энтальпии при фанзовых переходах металлоорганических соединений хрома, молибдена, вольфрама и частично марганца и рения [c.8]
Для повышения скорости горения смесевых топлив используют катализаторы, содержащие окислы меди, хрома, железа, магния, железных, медных и магниевых солей хромовой и метахромистой кислот, металлоорганических соединений. Так, ферроцен увеличивает скорость горения топлива на основе перхлората аммония в 2 раза. Для снижения скорости горения в качестве ингибиторов горения применяют фтористые соединения (1лР, Сар2, ВаРз) и гетеромолибдаты. Так, добавка 2 % Ь1Р к полиуретановому топливу снижает скорость горения в 2 раза. [c.8]
Влияние металлоорганических соединений на обессеривание нефтяного кокса. Ранее нами рассмотрены вероятные варианты реагирования сернистых соедипеиий с зольными компонентами с образованием сульфатов, сульфидов и др., влияющих существенно на процесс обессеривания. Все эти реакции возможны в условиях ирокаливання и обессеривания нефтяных коксов также в среде активных составляющих дымовых газов. Поэтому представляет интерес обобщить экспериментальный материал по превращениям в процессе прокаливаиия соединений железа, кремния, кальция, натрия, ванадия и алюминия, распространенных в материнской золе, а также окислов, которые могут попасть в нефтяной кокс при разрушении прокалочных иечей (окислы хрома, магния и др.). [c.225]
Компонентами катализатора Циглера являются а) металлоорганическое соединение металлов II или III группы, особенно алкила-ты алюминия, цинка или магния, или гидриды щелочных металлов, алкилгидриды металлов типа Rn М — X, б) соль, например галогенид, алкоголят или ацетилацетоиат металла IV, V и VI групп, особенно хрома, молибдена, тория, ванадия или циркония. По-видимому, между двумя компонентами происходит реакцня, в которой металл компонента [б)] частично алкилируется и восстанавливается, например в случае титана — до степени окисления 3 или ниже. [c.436]
Исследованию подвергались различные катализаторы хромит меди, окись никеля, окись магния, окись цинка, двуокись марганца и металлический никель. Существе 1ным моментом при исследовании был контроль за содержанием добавок металлов, захваченных катализаторами при обработке их металлоорганическими соединениями. Для определения содержания добавок в различных образцах катализатора использовались специальные методы анализа полярография, спектральный анализ, колориметрия. [c.152]
В. Б. Шуром) реакцию фиксации молекулярного азота при комнатной температуре и нормальном давлении посредством комплексных металлоорганических соединений титана, хрома, молибдена, вольфрама и железа. Осуществил реакцию азота с водородом в присутствии металлоорганических соединений в мягких условиях. Показал (1970, совместно с сотрудником И. С. Коломннковым) возможность фиксации углекислого газа комплексами переходных металлов. Создал новые катализаторы гомогенного гидрирования олефинов, тримеризации ацетиленов, полициклотримеризацни. Впервые получил соединения, в которых графит выступает в качестве органического лиганда. [c.115]
Синтез Фишера — Гафнера, помимо быс-аренных комплексов хрома, молибдена и вольфрама, оказался применим и для получения подобных комплексов многих остальных переходных металлов различных групп. Этот метод явно непригоден для синтеза бис-аренных комплексов марганца и технеция. Физические свойства аренных металлоорганических соединений представлены в табл. 8-2. [c.459]
Тетрагидрофурановые растворы производных диалкил- и ди-арилникеля (II) сравнительно нестабильны, если не поддерживать низкой температуры. Однако эти металлоорганические соединения способны циклизовать ацетиленовые углеводороды, хотя несколько иначе, чем хроморганические соединения [125]. Димезитилникель, например, конденсирует дифенилацетилен с образованием гексафенилбензола и не поддающегося дальнейшей переработке полимерного вещества, близкого по своему составу к тетрамерной форме дифенилацетилена, содержащей один атом никеля. Определяющее влияние соотношения реагентов на соотношение продуктов в этом случае также указывает на наличие весьма реакционноспособного промежуточного продукта, подобного тому, который предполагается при конденсации ацетиленов на хроме. Так, когда полученный из 1 моля бромистого никеля и 2 молей гриньяровского реагента в тетрагидрофуране [c.477]
Приведенные примеры иллюстрируют трудность рассмотрения механизма формирования микроструктур па циглеровских системах, характеризующихся весьма сложным составом. Первые исследования, проведенные в этой области, исходили из того, что стереоспецифическая полимеризация диенов и олефинов не имеет принципиальных отличий и что процесс протекает в ооювном по связи С—А1 с тем или иным участием переходного металла. Одиако, по мере развития исследований, стало ясно, что главная роль в этом процессе принадлежит переходному металлу и что алю-минийоргапич. соедипеиия, хотя и пригашают участие в образовании каталитич. комплекса, пе являются необходимыми компопентами систем. Наиболее интересными в этом свете представляются работы последних лот по полимеризации диенов под влиянием я-аллиль-ных комплексов переходных металлов. Из указанных в табл. 6 систем особое место занимают высшие окислы хрома, действующие без участия металлоорганических соединений и проявляюпцм высокую стереоспецифичность для траве-полимеризации диенов. [c.355]
С ЭТОЙ ТОЧКИ Зрения можно предположить, что металлооргаиические соединения циркония, таллия и хрома в опытах Вудса реагируют через стадию образования свободных радикалов, а термически относительно более устойчивые ароматические соединения кобальта в опытах Хараша и металлоорганические соединения серебра и золота в опытах Вудса реагируют без образования кинетически независимых частиц—через стадию возникновения активного комплекса. [c.287]
Значение алюминийорганических соединений резко возросло после открытия Циглером каталитических свойств алюмипийалкилов при полимеризации а-олефинов. Для достижения хороших результатов необходим смешанный катализатор наиболее часто применяют комбинацию триэтил-алюминия с три- или тетрахлоридами титана (СК, 58, 541). Для приготовления катализаторов могут быть использованы диэтилалюминийхлорид и многие другие металлоорганические соединения. Полимеризация по Циглеру, впервые описанная на примере этилена, проходит при комнатной температуре и атмосферном давлении. По одной из методик катализатор получают добавлением четыреххлористого титана к дизельному маслу, получаемому синтезом Фишера — Тропша (стр. 564) и содержащему диэтилалюминийхлорид все операции проводят в атмосфере азота. При пропускании через эту смесь этилена образуется полиэтилен. В других случаях могут быть использованы металлы типа хрома, никеля, циркония и молибдена. [c.415]
Не так давно был получен ряд металлоорганических соединений тяжелых металлов, в том числе элементов нечетных рядов. Получены соединения меди, серебра, золота, хрома, железа, платины и пр. Свойства этих соединений сильно отличаются от свойств обычных металлоорганических соединений. Большей ч астью они отличаются значительной неустойчивостью уже при обыкновенной температуре. [c.356]
В литературе имеются сообщения о новых путях получения полиэтилена при низком давлении, исключающих применение металлоорганических соединений [158]. Катализатором полимеризации в этом случае служит окись хрома, нанесенная на носитель, состоящий из Si02 и АЬОз. Оптимальные условия полимеризации этилена в среде растворителя (пентан, октан) температура 135—190 и давление 35 а/иж в этих условиях этилен полностью превращается в полиэтилен, который имеет средний мол. в. 5000—30 ООО, среднюю плотность 0,952, т. пл. 113—127° и характеризуется высокой механической прочностью и морозоустойчивостью. (Метод Филипнса). [c.180]
Активньши катализаторами полимеризации олефинов [209] могут служить комбинации соединений металлов подгрупп А IV—VI групп, например титана, циркония, ванадия, тантала и хрома, с соединениями металлов подгрупп Б тех ше групп, обладающими восстанавливающей способностью, нанример с гидридами или алкидами германия, олова, свинца, мышьяка, сурьмы и висмута. Активность этих катализаторов возрастает при добавлении галогенидов металлов II—V групп [256—257]. Наиболее подходящие соотношения между металлоорганическим соединением [c.109]
Л. Мейер, профессор химии в Тюбингене, известен также различными исследованиями по физиологической химии, неорганической химии (хлориды иода, молибдена, хрома) и органической химии (насыщенные углеводороды, металлоорганические соединения и т. д.). Его книга Современные теории химии и их значение для химической статики имепа большой успех (5-е немецкое издание вышло в 1884 г.) и была переведена на английский и французский языки Мейер написал, кроме того, Основы теоретической химии (1890) и в сотрудничестве с К. Зейбертом Атомные веса элементов, вновь пересчитанные из первоначальных чисел (1883) [c.271]
В соответствии с современными представлениями считается, что при дегидрировании парафиновых углеводородов до олефино-вых на АХ катализаторах возможны два механизма гомолитичес-кий и гетеролитический (6, 7, 10]. В обоих случаях предполагается, что хемосорбция углеводорода является первой стадией рассматриваемого процесса, которая происходит на поверхности катализатора с разрывом С—Н связи, причем алкильная группа присоединяется к иону хрома с образованием поверхностного, металлоорганического соединения активными центрами реакции дегидрирования являются координационно ненасыщенные ионы хрома, и хемосорбция реагентов происходит путем заполнения октаэдрической координации этих ионов (10]. [c.6]
Непереходные элементы — неметаллы (галогены, кислород, азот и т. д.) и металлы (литий, натрий, магний и т. д.) — образуют алкильные (и подобные им) производные со связью углерод — элемент. Переходные элементы (железо, кобальт, никель, марганец, хром, ванадий и т. д.) резко отличаются от непереходных элементов характером связи углерод — металл. К металлоорганическим соединениям этого типа относятся комплексы переходных элементов с непредельными углеводородами (этилен, галогеноаллилы, ацетилен), циклическими углеводородами (циклопентадиен, бензол) — дициклопентадиенильные и бис-ароматические (ареновые) производные — и другие комплексы, например карбонилы переходных металлов Fe( O)5, Ni( 0)4, [Со(СО)4]2 цианиды переходных металлов ферро- и феррицианидные анионы [Ре(СМ)б] ", [Ре(СМ)б] и т.д. Органические соединения этой группы элементов, в частности сендвичевые соединения, будут описаны позднее (с. 527). [c.322]
Ha пиридилметильных производных Джонсон и oTp. i изучили также механизм передачи алкильного радикала от хрома к таллию. В этой связи следует упомянуть аналогичное образование ст-связан-ного кобальторганического соединения . Интересно, что из оптически активного а-(2-пиридил)-этилбромида было получено рацемическое металлоорганическое соединение, однако нельзя утверждать, является ли это следствием механизма реакции или последующей рацемизации [c.68]
Иодметильное или дигалоидное производные хрома дают с нитратом ртути не металлоорганические соединения, а только продукты окисления. [c.69]
chem21.info