Соединения шестивалентного хрома. Шестивалентный хром
Шестивалентный хром. Влияние директивы о замене шестивалентного хрома на отрасль
Главная » Литература » Статьи » Влияние директивы о замене шестивалентного хрома на отрасльАвтор: Пол Винн
«MacDermidplc», Великобритания
Шестивалентный хром всегда широко применялся при нанесении защитных покрытий для придания поверхности антикоррозионных свойств. Однако недавние постановления экологических и законодательных органов заставили гальванические предприятия перейти на использование технологий, в основу которых лег трехвалентный хром и не содержащие хром составы. Этот переход затронул интересы всех участников цепи поставок. Конечные потребителям и пользователям также придется задуматься о том, как это может сказаться на надежности продукта, его стоимости и пригодности для конкретных условий применения. Опыт нескольких предприятий наглядно свидетельствует, что для успешного перехода на альтернативные технологии необходимо тесное сотрудничество всех игроков рынка. Поставщик химических веществ становится важным звеном в цепочке «гальванический цех – конечный потребитель» и может существенно повлиять на протекание процесса. В идеале производители должны лично наблюдать за внедрением своих технологий, способствуя сокращению затрат, связанных с подобной заменой и обеспечивая безупречное качество покрытий. В данное статье будут рассмотрены последние разработки в области пассивации трехвалентным хромом, а также оценена необходимость использования специализированной программы оценки качества для успешного перехода на использование трехвалентного хрома.
Обработка поверхности становится решающим фактором в борьбе с коррозией для большинства отраслей промышленности. Нанесение различных покрытий позволяет сочетать объемные свойства одного металла с поверхностными свойствами другого. Благодаря внешнему слою продлевается срок службы изделия, улучшается его внешний вид, увеличивается износостойкость.
В борьбе с коррозией наибольшей популярностью всегда пользовались покрытия на основе цинка, нанесенные на стальную подложку, поскольку обладали рядом уникальных и крайне важных свойств, обеспечиваемых наличием в из составе шестивалентного хрома. В случае с электроосажденным цинком и цинковыми сплавами шестивалентный хром наносился в качестве завершающего покрытия путем погружения детали в водный раствор хромовой кислоты. Эта технология не только защищала поверхность от образования оксида или «белой» ржавчины, но и окрашивала ее в различные цвета: небесно-голубой, желтый, зеленый и черный.
Первый патент на технологию хроматирования был получен в 1936 году, а широкое промышленное применение она получила в 50-х годах прошлого столетия. С тех пор технология не претерпела каких-либо значительных изменений, однако совсем недавно было доказано, что шестивалентный хром представляет собой значительную угрозу как для окружающей среды, так и для здоровья человека.
Экологические изменения
Основной причиной, побудившей гальванические предприятия активно заняться поиском и внедрением альтернативных технологий, стала разработка нескольких директив ЕС, таких, как директива о транспортных средствах с выработанным ресурсом (ELV), директива об отходах электрического и электронного оборудования (WEEE) 2002/95/EC и директива об ограничении использования некоторых вредных веществ в электрическом и электронном оборудовании (RoHS). Издание вышеперечисленных актов сказалось на всех игроках рынка целого ряда отраслей промышленности, поскольку обычно каждая международная компания с целью сократить издержки за счет объемов и упростить механизм материально-технического обеспечения следует единой технической и закупочной стратегии. В этом отношении автомобилестроение впервые за всю свою историю столкнулось с подобным скачком активности по переводу производства на новые технологии антикоррозийных покрытий.
Директива ELVпризвана сократить объемы отходов, вырабатываемых транспортными средствами, общий вес которых не превышает 3,5 т, путем повторного использования, переработки и восстановления автомобилей с выработанным ресурсом и их составных частей. Этот документ вызвал массу дискуссий и обсуждений, однако его основной смысл сводится к тому, чтобы заставить производителей машин сократить использование опасных веществ.
Начиная с 1июля 2003 года, страны-участницы обязаны проверять, не содержат ли применяемые материалы кадмий, свинец, ртуть или шестивалентный хром. В Приложении IIк данному закону перечисляются исключения, которые составляют специфические случаи применения. Что касается антикоррозийных покрытий, в одном автомобиле допускается общее содержание шестивалентного хрома, не превышающее 2 г.
Следовательно, это приведет к отказу от материалов, содержащих шестивалентный хром и использующихся при обработке поверхности, как например, хроматные пленки при цинковании. Запрет на шестивалентный хром приведет к следующим последствиям:
исчезновению желтых и зеленых пленок: они будут заменены на бесцветные или черные, замене шестивалентного хроматирования трехвалентным пассивированием.
В случаях, когда необходимо обеспечить особенно высокую коррозионную устойчивость и термостойкость, это повлечет еще иограничения в нанесении цинковых покрытий, вызванные переходом на цинковые сплавы, сокращение применения хроматирования в связи с переходом на пассивацию.
Приложение II к директиве было пересмотрена в июне 2002 года. Дата замены шестивалентного хрома была изменена на 1 июля 2007 года, со следующими замечаниями:
допускается концентрация шестивалентного хрома в однородном веществе, не превышающая 0,1% по весу, при условии, что шестивалентный хром не был включен в состав вещества намеренно, под «намеренно включенным» следует понимать сознательное использование материала или вещества при компоновке составов.
Следующая поправка к приложению IIвышла в свет 20 сентября 2005 года. Она содержала положение, касающееся исключения под п. 13:антикоррозионные покрытия – дата вступления в силу: 1 июля 2007 года, антикоррозионные покрытия болтов и гаек, предназначенных для ходовой части: 1 июля 2008 года.
На сегодняшний день от производители оборудования не поступило никаких ясных комментариев к данной поправке, однако из неофициальных источников, известно, что, скорее всего, исследования в области внедрения покрытий, не содержащих шестивалентный хром, позволят выполнить предписания в установленный срок.
Трехвалентное голубое покрытие
Наверняка, многим уже встречались прозрачные голубоватые пленки на оцинкованной поверхности, успешно получаемые с помощью неорганических компонентов, содержащих трехвалентный хром. Первоначально технология их нанесения, запатентованная в 1978 году, была разработана, как решение проблемы обесцвечивания, вызванного взаимодействием шестивалентного хромата с металлическими примесями (в частности, с железом), содержащимися в бесцианистых цинковых электролитах. Толщина пленок, обеспечивающих неплохую коррозионную устойчивость цинкового покрытия, составляла, как видно на снимке, полученном на автоэлектронном микроскопе, около 30-40 нм. Последующие исследования велись в направлении использования ионов других металлов, а именно кобальта, и позволили добиться некоторых улучшений, запатентованных в 1982 году.
Голубые пленки теперь обеспечивают изделиям лучшие эксплуатационные характеристики и особенно широко используются для финишной обработки оцинкованной поверхности. Возросшая стоимость и сложность нанесения компенсируются надежностью, долговечностью, устойчивостью цвета и коррозионной стойкостью получаемого покрытия.
В наше время голубые пленки, характеризующиеся улучшенными декоративными свойствами, получают с помощью трехвалентного хрома, без добавления фтористых соединений и кобальта. Они малочувствительны к железу и образуют тонкое покрытие ярко-голубого цвета. Повышения коррозионной устойчивости удалось добиться за счет увеличения содержания хрома, а также использования кобальта и противокоррозионных ингибиторов. Пленка, толщина которой также была увеличена и составляет около 75-100 нм, не образует микротрещин, что подтверждают снимки автоэлектронного микроскопа, и, по результатам испытаний при обливании нормальной солевой струёй, гарантируют высокую коррозионную стойкость изделий.
Трехвалентное радужное покрытие
Возросшие требования, предъявляемые в частности предприятиями автомобильной промышленности к декоративным качествам покрытия, сместили внимание на радужные покрытия большой толщины. Известные и запатентованные разработки основываются на увеличении содержания трехвалентного хрома с добавлением кобальта и органических кислот. Процесс происходит при повышенной до 55-650С температуре раствора и обеспечивает достаточную (около 300 нм) толщину наносимого на цинк красно-зеленого желтым хроматированием. Многочисленные испытания, включая испытания на тепловой удар, при условиях 1200С/1ч, 1200С/24ч, и 1500С/5ч подтвердили значительное улучшение характеристики жароустойчивости, отвечающее требованиям конечных пользователей. Хроматирование же, наоборот, всегда считалось недостаточно надежным покрытием для работы с высокими температурами, поскольку образуемая им пленка склонна к обезвоживанию и потере функциональных свойств. Толстая радужная пленка трехвалентного хрома не отличается этим недостатком и, таким образом, обеспечивает лучшую защиту.
Эти характеристики радужной пленки были зафиксированы с помощью автоэлектронного микроскопа, а испытания под действием солевого тумана подтвердили, что с ее помощью удалось добиться равной с хроматированием, а в некоторых случаях – и лучшей антикоррозийной стойкости.
Низкотемпературное радужное покрытие
Совсем недавно в массовое производство была запущена новая технология трехвалентного хромирования. Она обеспечивает свойства покрытия, не уступающие обычной радужной пленке, однако при более предпочтительных условиях – нужная толщина достигается и без нагревания раствора, что существенно экономит расход энергии и снижает производственные издержки. Толщина пленки, согласно результатам анализа поверхности, составляет около 300 нм. На поверхности не образуется микротрещин, а испытания на коррозионную стойкость в соляной камере доказали соответствие антикоррозионных свойств действующим стандартам.
Трехвалентное черное хроматирование
Черное хроматирование, известное своими прекрасными декоративными качествами, издавна используется для финишной обработки цинка. Содержащееся в растворе серебро повышает коррозионную стойкость, но в то же время увеличивает стоимость электролита. В конце 80-х были разработаны новые технологии, позволяющие осуществлять процесс черного хроматирования, не используя серебро, не сказываясь на свойствах получаемого покрытия.
В 90-х годах велись активные разработки по фосфатированию сплавов цинка с железом и никелем с использованием трехвалентного хрома, успешно завершившиеся и запатентованные в 1995 г. Однако с течением времени возросли требования конечных пользователей, и теперь эта технология используется только в сочетании с покрывными композициями.
Функциональное хроматирование цинка вызвало гораздо больше сложностей. Попытки наносить защитное покрытие с использованием бесхромового молибдата не принесли желаемых результатов в отношении антикоррозионной защиты. Однако исследования были продолжены, и в настоящее время в производство запущено несколько технологий, которые в сочетании с соответствующими покрывными композициями, обеспечивают приемлемые декоративные и противокоррозионные свойства.
Поверхностное покрытие
Надежность трехвалентной пассивации повышается с помощью нанесения внешних слоев или поверхностных покрытий, основанных на силикатах или органических веществах. Эти материалы положительно сказываются на таких свойствах, как внешний вид поверхности, абразивный износ и коррозионная стойкость.
Неорганические герметики в сочетании с пассивированным слоем образуют блестящую пленку и обычно используются, когда сопротивление коррозии не является принципиальным требованием и главным решающим фактором становится стоимость. Кроме того, им отдается предпочтение в случае, когда большую роль играет совместимость с агрессивными жидкостями (детали тормозной системы автомобиля). Декоративные свойства обеспечиваются органическими растворами, с помощью которых на поверхности образуется покрытие с высоким блеском толщиной более 500 нм. Для ускорения процесса нанесения существуют специальные внешние покрытия с высокой степенью сопротивления напряжению при скручивании, которые модифицируют трибологические свойства поверхности, обеспечивая достижение характеристик, необходимых для использования в современной автомобильной промышленности.
Установки и оборудование
Отказ от шестивалентного хрома влечет за собой несколько ключевых трудностей для производства, и одной из самых значительных из них является смена оборудования. Технологии, основанные на использовании шестивалентного хрома, заслужили популярность именно благодаря тому факту, что их применение не требует высокого уровня контроля или высокотехнологичного оборудования. Запатентованные материалы для хроматирования доказали свою надежность и обходятся сравнительно дешево; производству гораздо выгоднее регулярно закупать их, чем приобретать материалы с большим сроком использования.
Осуществляя замену шестивалентного хромирования на другую технологию, необходимо учитывать все параметры, ранее не принимаемые в расчет. Теперь поставщикам оборудования и материалов выдвигаются гораздо более высокие требования, что доказывают несколько дополнительных листов отправляемых производителям спецификаций. В результате между цехами, предлагающими услуги по нанесению покрытий и поставщиками материалов выработалось своеобразное «стратегическое партнерство», позволяющее сократить производственные издержки и гарантировать высокий уровень качества. Это, в свою очередь, сказывается на отношении конечного пользователя к выбранным поставщикам услуг и оборудования.
Примером успешного сотрудничества разработчика технологий и гальванического производства может служить инновационный проект, известный как «ZinKlad», запущенный в 1999 году в качестве программы замены шестивалентного хрома. Программа включала поставку необходимых химических веществ, а также системы контроля за процессом нанесения и протоколы испытаний, с последующей выдачей сертификатов предприятиям, успешно внедрившим новую технологию.
Вывод
Природоохранное законодательство, требующее замены опасных веществ, таких, как шестивалентный хром, послужило своеобразным катализатором перехода на альтернативные технологии.
Составы, содержащие трехвалентный хром, доказали свою конкурентоспособность и уже успешно применяются на многих предприятиях. Однако порой ощущается нехватка финишных покрытий, обеспечивающих улучшение функциональных характеристик, требуемое заказчиками.Как показывает опыт, такая серьезная смена технологий требует активного сотрудничества всех участников рынка. Наличие собственных квалифицированных специалистов позволит компании ввести протоколы контроля качества, способствующие успешному внедрению новой технологии, усилению входящего контроля и надзору за процессами нанесения покрытий. Это, в свою очередь, обеспечит высокое качество изготовляемых изделий и доверие заказчика. Компания «MacDermid» на своем примере доказала, что открытие сети специализированных сервисных центров по нанесению покрытий действительно повлияло на успешное внедрение новой стратегии среди конечных пользователей.
Укрепление сотрудничества и взаимной поддержки внутри отрасли не может не сказаться положительно на каждом отдельном предприятии и поможет всем участникам рынка противостоять социальным, экономическим и экологическим реформам в будущем.
echemistry.ru
NEWS.BCM.RU :: Чем опасен шестивалентный хром?
10 лет назад на мировой экран вышел голливудский фильма "Эрин Брокович", рассказывающий подлинную историю адвоката Эрин Брокович, которая выиграла иск на $333 млн. у компании, отравлявшей местных жителей веществом, известным как шестивалентный хром. Этот особо опасный канцероген не был широко известен, но после фильма "Эрин Брокович" Стивена Содерберга, в котором главную роль сыграла Джулия Робертс, о нём узнал весь мир. Картина демонстрировала, насколько опасен этот химический элемент, который чаще всего используется при производстве нержавеющих сталей, текстильных красок, консервантов дерева, а также при процессах хромирования. Попадание шестивалентного хрома в организм вызывает различные формы рака. Но вот на днях новостные ленты сообщили о двух новостях, касающихся этого канцерогена. 1. Шестивалентный хром обнаружен в водопроводной воде 31 из 35 американских городов. Об этом сообщило Агентство по защите окружающей среды США. В первом национальном отчёте по качеству питьевой воды, результаты которого вскоре будут опубликованы публично, американская компания Environmental Working Group обнаружила следы шестивалентного хрома в 31 из 35 городов США. Наиболее заражена им водопроводная вода в городах Норман, Гонолулу, Риверсайд и Мэдисон. В настоящее время Агентство по защите окружающей среды раздумывает над тем, чтобы определить предельно допустимый уровень содержания шестивалентного хрома в питьевой воде. В 2008 году Национальный институт здоровья назвал это вещество "вероятным канцерогеном". Новость о неблагополучном состоянии питьевой воды узнала и Эрин Брокович. "Шестивалентный хром используется в разных отраслях так широко, что это меня совершенно не удивляет, – заявила она. – Наши муниципальные системы водопроводов в опасности на всей территории США". 2. Шведские учёные обнаружили в обувной коже трёхвалентный хром, который почти безвреден для здоровья человека, но при сжигании преобразуется в шестивалентный канцероген, поражающий организм через кожу и лёгкие. Эксперты изучили материал нескольких пар обуви, основная часть которой была куплена в Швеции. Остальные были приобретены в разных странах – от Уганды до Белоруссии. В нескольких образцах были выявлены канцерогенные краски, которые являются сильнейшими аллергенами. Кроме того, в обуви были найдены такие ядовитые вещества, как свинец, мышьяк и ртуть. Обе новости говорят о том, что даже в таких хвалёных странах, как США и Швеция, не всё благополучно с охраной окружающей среды, несмотря на то, что существуют жёсткие природоохранные законы и директивы, регламентирующие применение особо опасных веществ. Например, в странах Европейского Союза (ЕС) действуют три директивы, касающиеся ограничения применения вредных веществ. 1. Директива 2000/53/ЕС: "Конец жизни транспортных средств" ("End of Life Vehicle"). Проект директивы, нацеленной на то, чтобы ограничить использование четырёх тяжёлых основных металлов (кадмия, свинца, ртути, шестивалентного хрома) в машинах, был предложен в 1997 году. Список был утверждён парламентом ЕС в мае 2000 года и в сентябре 2000 года стал директивой 2000/53/ЕС. Особенно жёсткие требования в документе предъявляются к содержанию шестивалентного хрома. Эта директива допускает использование шестивалентного хрома только для защиты от коррозии и ограничивает его общее содержание до 2 г на машину. Для всех других целей использование шестивалентного хрома не допускается. 2. Директива 2002/95/ЕС: "Ограничение вредных веществ". ("Restriction of Hazardous Substance"). Эта директива ограничивает содержание вредных веществ в электрических и электронных устройствах. К вредным веществам относятся: кадмий, ртуть, свинец, шестивалентный хром, РВВ (полибромированные дифенилы), PBDE (эфир полибромированного дифенила). Согласно данной директиве, максимальная концентрация ртути, свинца, шестивалентного хрома, РВВ и PBDE в гомогенных материалах не должна превышать 0,1масс.%, содержание кадмия в гомогенных материалах не должно быть выше 0,01масс.%. Термин "гомогенный" подразумевает однородность состава по всему образцу. Примерами "гомогенных материалов" являются индивидуальные типы пластиков, керамики, резины, покрытий. Примером "негомогенного материала" может служить электрический кабель, который состоит из металлической проволоки, окружённой неметаллическим изолирующим материалом, так как его можно механически разделить на отдельные материалы. В этом случае предельные значения директивы будут применяться индивидуально к каждому из материалов. Устройства, которых касается директива, должны зависеть от электрического тока или электромагнитных полей. Это означает, что когда ток выключен, устройство не может выполнять свою основную функцию. Если электроэнергия используется только для функций поддержки или контроля, то этот тип устройства не охватывается директивой. Примером таких продуктов являются: пьезоэлектрическая зажигалка, двигатель сгорания с зажиганием, пневматическое оружие, газовые плиты с электрическими часами, игрушки на батарейках, высоковольтные выключатели, медицинское оборудование, измерительное и контролирующее оборудование, машинные радио. Также из директивы исключено военное оборудование. Эта директива вступила в силу 1 июля 2006 года и касается только устройств, выпущенных на рынок с 1 июля 2006 года. В Китайской и Корейской республиках также подготовлены аналогичные директивы, касающиеся тех же шести вредных веществ. В КНР она вступила в силу с 1 марта 2007 года, а в Корее – с 1 июля 2007 года. 3. Директива 2002/96/ЕС: "Отходы электрического и электронного оборудования". ("Waste Electrical and Electronic Eqvipment"). Цель этой директивы: предотвратить попадание в природу отходов электрического и электронного оборудования, а также стимулировать их повторное использование, переработку и другие формы восстановления этих отходов с тем, чтобы уменьшить их захоронение. Эта директива также создана для того, чтобы улучшить рабочую среду всех людей, вовлечённых в жизненный цикл электрического и электронного оборудования, то есть производителей, дистрибуторов, потребителей и в особенности тех операторов, которые непосредственно принимают участие в обработке этих отходов. Под термином "электронное и электрическое оборудование" подразумеваются приборы, для правильной работы которых необходим электрический ток или электромагнитные поля, а также приборы для создания, переноса и измерения тока и электромагнитных полей, разработанные для использования при напряжении, не превышающим 1 В для переменного тока и 1,5 В для постоянного тока. Электронное и электрическое оборудование, подпадающее под действие этой директивы: бытовые приборы, телекоммуникационное, осветительное, спортивное, медицинское оборудование, электрические и электронные инструменты (за исключением крупномасштабных стационарных промышленных инструментов), игрушки, контролирующие инструменты. Эта директива вступила в силу с 31 декабря 2006. Так что же делать, если этот химикат, без которого не представляли свою жизнь металлурги, автомобильные производители, текстильщики, лесопромышленники, так опасен? Для справки: Шестивалентный хром входит в состав коррозионностойких, защитных конверсионных хроматных покрытий (плёнок), которые наносят на многочисленные ответственные детали транспортных средств, таких, как крепежные детали, кронштейны, скобы, рычаги, элементы сцепления, подвески и т.д. Он также может быть обнаружен в полимерных пигментах, чернилах, в нержавеющей стали (Cr6+ выделяется в ходе литья, плавления, факельной резки), текстильных красителях (хроматы натрия и калия и бихроматы аммония и калия). Хроматы цинка и хрома являются канцерогенными веществами. Наиболее широко шестивалентный хром применяется в качестве коррозионно-защитного хроматного слоя на оцинкованных стальных поверхностях. Это влажные, студенистые плёнки, высыхающие на поверхности. После механического повреждения, нарушения сплошности, появления трещин плёнки проявляют способность к самозалечиванию, самовосстановлению, что делает их очень эффективными коррозионно-защитными покрытиями. В автомобильной промышленности в среднем используется от 4 до 8, а иногда даже свыше 10 г шестивалентного хрома на один автомобиль. Каждый год в странах ЕЭС отработанные транспортные средства образуют от 8 до 9 миллионов тонн отходов. В настоящее время из-за вступления в действие директив, ограничивающих применение шестивалентного хрома, наиболее остро встает проблема его замены. Было разработано большое количество вариантов для замены шестивалентного хрома, включающих толстые цинк–органические покрытия, цинковые порошковые сплавы, составы на основе трёхвалентного хрома и т.д. Коммерчески приемлемыми являются несколько заменителей на основе трёхвалентного хрома. Министерство Обороны и ВМФ США разработали состав на основе трёхвалентного хрома, названный ТСР. Этот уникальный процесс по своим показателям превосходит все обычные процессы на основе трёхвалентного хрома. Он может быть применён на стали, покрытой алюминием, цинком, а также на других подложках. TCP-растворы работают при комнатной температуре, они "экологичны" и удовлетворяют всем трём директивам ЕЭС. Из этих растворов получаются более твёрдые и плотные плёнки (по сравнению с обычным "трёхвалентными" хроматными), по коррозионной стойкости сопоставимые или даже превышающие плёнки, содержащие шестивалентный хром. Эти покрытия обладают электрической проводимостью и, что наиболее важно, не требуют применения дополнительного защитного верхнего слоя. Отрадно, что промышленность откликается на требование следить за состоянием окружающей среды и здоровья людей. Важно только при этом, чтобы передовые технологии, способствующие защите Природы и Человека как можно быстрее распространялись по миру. Для справки: на фото Сукинда, Индия. Число потенциально пострадавших людей: 2 600 000. Загрязняющие вещества: шестивалентный хром и другие металлы. Источники загрязнения: шахты по добыче хрома и заводы по его обработке. Если Вы смотрели фильм "Эрин Брокович", то Вы знаете, что шестивалентный хром используется для производства нержавеющей стали и для дубления кожи, а также является довольно токсичным веществом и опасен для вдыхания и глотания. В Сукинде находится один из крупнейших хромовых карьеров. 60% питьевой воды содержит вдвое больше хрома, чем разрешено международными стандартами. 87% смертей в этом районе обусловлены заболеваниями, вызванными отравлением хромом. Никаких попыток улучшения экологической ситуации не проводится. В сточных водах отходы производства, мусор, бытовые отходы. Там же купаются дети…
Этот особо опасный канцероген не был широко известен, но после фильма "Эрин Брокович" Стивена Содерберга, в котором главную роль сыграла Джулия Робертс, о нём узнал весь мир. Картина демонстрировала, насколько опасен этот химический элемент, который чаще всего используется при производстве нержавеющих сталей, текстильных красок, консервантов дерева, а также при процессах хромирования. Попадание шестивалентного хрома в организм вызывает различные формы рака. Но вот на днях новостные ленты сообщили о двух новостях, касающихся этого канцерогена. 1. Шестивалентный хром обнаружен в водопроводной воде 31 из 35 американских городов. Об этом сообщило Агентство по защите окружающей среды США. В первом национальном отчёте по качеству питьевой воды, результаты которого вскоре будут опубликованы публично, американская компания Environmental Working Group обнаружила следы шестивалентного хрома в 31 из 35 городов США. Наиболее заражена им водопроводная вода в городах Норман, Гонолулу, Риверсайд и Мэдисон. В настоящее время Агентство по защите окружающей среды раздумывает над тем, чтобы определить предельно допустимый уровень содержания шестивалентного хрома в питьевой воде. В 2008 году Национальный институт здоровья назвал это вещество "вероятным канцерогеном". Новость о неблагополучном состоянии питьевой воды узнала и Эрин Брокович. "Шестивалентный хром используется в разных отраслях так широко, что это меня совершенно не удивляет, – заявила она. – Наши муниципальные системы водопроводов в опасности на всей территории США". 2. Шведские учёные обнаружили в обувной коже трёхвалентный хром, который почти безвреден для здоровья человека, но при сжигании преобразуется в шестивалентный канцероген, поражающий организм через кожу и лёгкие. Эксперты изучили материал нескольких пар обуви, основная часть которой была куплена в Швеции. Остальные были приобретены в разных странах – от Уганды до Белоруссии. В нескольких образцах были выявлены канцерогенные краски, которые являются сильнейшими аллергенами. Кроме того, в обуви были найдены такие ядовитые вещества, как свинец, мышьяк и ртуть. Обе новости говорят о том, что даже в таких хвалёных странах, как США и Швеция, не всё благополучно с охраной окружающей среды, несмотря на то, что существуют жёсткие природоохранные законы и директивы, регламентирующие применение особо опасных веществ. Например, в странах Европейского Союза (ЕС) действуют три директивы, касающиеся ограничения применения вредных веществ. 1. Директива 2000/53/ЕС: "Конец жизни транспортных средств" ("End of Life Vehicle"). Проект директивы, нацеленной на то, чтобы ограничить использование четырёх тяжёлых основных металлов (кадмия, свинца, ртути, шестивалентного хрома) в машинах, был предложен в 1997 году. Список был утверждён парламентом ЕС в мае 2000 года и в сентябре 2000 года стал директивой 2000/53/ЕС. Особенно жёсткие требования в документе предъявляются к содержанию шестивалентного хрома. Эта директива допускает использование шестивалентного хрома только для защиты от коррозии и ограничивает его общее содержание до 2 г на машину. Для всех других целей использование шестивалентного хрома не допускается. 2. Директива 2002/95/ЕС: "Ограничение вредных веществ". ("Restriction of Hazardous Substance"). Эта директива ограничивает содержание вредных веществ в электрических и электронных устройствах. К вредным веществам относятся: кадмий, ртуть, свинец, шестивалентный хром, РВВ (полибромированные дифенилы), PBDE (эфир полибромированного дифенила). Согласно данной директиве, максимальная концентрация ртути, свинца, шестивалентного хрома, РВВ и PBDE в гомогенных материалах не должна превышать 0,1масс.%, содержание кадмия в гомогенных материалах не должно быть выше 0,01масс.%. Термин "гомогенный" подразумевает однородность состава по всему образцу. Примерами "гомогенных материалов" являются индивидуальные типы пластиков, керамики, резины, покрытий. Примером "негомогенного материала" может служить электрический кабель, который состоит из металлической проволоки, окружённой неметаллическим изолирующим материалом, так как его можно механически разделить на отдельные материалы. В этом случае предельные значения директивы будут применяться индивидуально к каждому из материалов. Устройства, которых касается директива, должны зависеть от электрического тока или электромагнитных полей. Это означает, что когда ток выключен, устройство не может выполнять свою основную функцию. Если электроэнергия используется только для функций поддержки или контроля, то этот тип устройства не охватывается директивой. Примером таких продуктов являются: пьезоэлектрическая зажигалка, двигатель сгорания с зажиганием, пневматическое оружие, газовые плиты с электрическими часами, игрушки на батарейках, высоковольтные выключатели, медицинское оборудование, измерительное и контролирующее оборудование, машинные радио. Также из директивы исключено военное оборудование. Эта директива вступила в силу 1 июля 2006 года и касается только устройств, выпущенных на рынок с 1 июля 2006 года. В Китайской и Корейской республиках также подготовлены аналогичные директивы, касающиеся тех же шести вредных веществ. В КНР она вступила в силу с 1 марта 2007 года, а в Корее – с 1 июля 2007 года. 3. Директива 2002/96/ЕС: "Отходы электрического и электронного оборудования". ("Waste Electrical and Electronic Eqvipment"). Цель этой директивы: предотвратить попадание в природу отходов электрического и электронного оборудования, а также стимулировать их повторное использование, переработку и другие формы восстановления этих отходов с тем, чтобы уменьшить их захоронение. Эта директива также создана для того, чтобы улучшить рабочую среду всех людей, вовлечённых в жизненный цикл электрического и электронного оборудования, то есть производителей, дистрибуторов, потребителей и в особенности тех операторов, которые непосредственно принимают участие в обработке этих отходов. Под термином "электронное и электрическое оборудование" подразумеваются приборы, для правильной работы которых необходим электрический ток или электромагнитные поля, а также приборы для создания, переноса и измерения тока и электромагнитных полей, разработанные для использования при напряжении, не превышающим 1 В для переменного тока и 1,5 В для постоянного тока. Электронное и электрическое оборудование, подпадающее под действие этой директивы: бытовые приборы, телекоммуникационное, осветительное, спортивное, медицинское оборудование, электрические и электронные инструменты (за исключением крупномасштабных стационарных промышленных инструментов), игрушки, контролирующие инструменты. Эта директива вступила в силу с 31 декабря 2006. Так что же делать, если этот химикат, без которого не представляли свою жизнь металлурги, автомобильные производители, текстильщики, лесопромышленники, так опасен? Для справки: Шестивалентный хром входит в состав коррозионностойких, защитных конверсионных хроматных покрытий (плёнок), которые наносят на многочисленные ответственные детали транспортных средств, таких, как крепежные детали, кронштейны, скобы, рычаги, элементы сцепления, подвески и т.д. Он также может быть обнаружен в полимерных пигментах, чернилах, в нержавеющей стали (Cr6+ выделяется в ходе литья, плавления, факельной резки), текстильных красителях (хроматы натрия и калия и бихроматы аммония и калия). Хроматы цинка и хрома являются канцерогенными веществами. Наиболее широко шестивалентный хром применяется в качестве коррозионно-защитного хроматного слоя на оцинкованных стальных поверхностях. Это влажные, студенистые плёнки, высыхающие на поверхности. После механического повреждения, нарушения сплошности, появления трещин плёнки проявляют способность к самозалечиванию, самовосстановлению, что делает их очень эффективными коррозионно-защитными покрытиями. В автомобильной промышленности в среднем используется от 4 до 8, а иногда даже свыше 10 г шестивалентного хрома на один автомобиль. Каждый год в странах ЕЭС отработанные транспортные средства образуют от 8 до 9 миллионов тонн отходов. В настоящее время из-за вступления в действие директив, ограничивающих применение шестивалентного хрома, наиболее остро встает проблема его замены. Было разработано большое количество вариантов для замены шестивалентного хрома, включающих толстые цинк–органические покрытия, цинковые порошковые сплавы, составы на основе трёхвалентного хрома и т.д. Коммерчески приемлемыми являются несколько заменителей на основе трёхвалентного хрома. Министерство Обороны и ВМФ США разработали состав на основе трёхвалентного хрома, названный ТСР. Этот уникальный процесс по своим показателям превосходит все обычные процессы на основе трёхвалентного хрома. Он может быть применён на стали, покрытой алюминием, цинком, а также на других подложках. TCP-растворы работают при комнатной температуре, они "экологичны" и удовлетворяют всем трём директивам ЕЭС. Из этих растворов получаются более твёрдые и плотные плёнки (по сравнению с обычным "трёхвалентными" хроматными), по коррозионной стойкости сопоставимые или даже превышающие плёнки, содержащие шестивалентный хром. Эти покрытия обладают электрической проводимостью и, что наиболее важно, не требуют применения дополнительного защитного верхнего слоя. Отрадно, что промышленность откликается на требование следить за состоянием окружающей среды и здоровья людей. Важно только при этом, чтобы передовые технологии, способствующие защите Природы и Человека как можно быстрее распространялись по миру. Для справки: на фото Сукинда, Индия. Число потенциально пострадавших людей: 2 600 000. Загрязняющие вещества: шестивалентный хром и другие металлы. Источники загрязнения: шахты по добыче хрома и заводы по его обработке. Если Вы смотрели фильм "Эрин Брокович", то Вы знаете, что шестивалентный хром используется для производства нержавеющей стали и для дубления кожи, а также является довольно токсичным веществом и опасен для вдыхания и глотания. В Сукинде находится один из крупнейших хромовых карьеров. 60% питьевой воды содержит вдвое больше хрома, чем разрешено международными стандартами. 87% смертей в этом районе обусловлены заболеваниями, вызванными отравлением хромом. Никаких попыток улучшения экологической ситуации не проводится. В сточных водах отходы производства, мусор, бытовые отходы. Там же купаются дети… Геннадий А. Мингазов, Журналист BCM.ru Все публикации этого автора (148)
Другие публикации этого автора
28.01.2011 17:23 Экологический рейтинг России
28.01.2011 16:53 Природоохранная организация WWF России предупреждает: пострадавшим от ледяного дождя лесам грозит новая опасность
27.01.2011 17:50 Химкомбинат "Азот" - главный загрязнитель Кемеровской области
news.bcm.ru
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3. Слабо парамагнитные расплывающиеся на воздухе красные (с фиолетовым оттенком) бипирамидальные орторомбические призмы (плотность равна 2,8 г/см3), tпл=197°С. Хорошо растворим в воде. Обладает окислительными свойствами. Получают действием воды на хлористый хромил, обработкой растворов хромата или бихромата калия или натрия избытком концентрированной серной кислоты, действием хлороводородной кислоты на хромат серебра. Применяют в качестве катализатора автоокисления углеводородов и ненасыщенных алифатических эфиров, для восстановления чувствительности фотопластинок, а также в медицине как прижигающее средство.
Таблица 9.[12].
| Δ H°обр | -590 кДж/моль; | Δ G°298 | -513 кДж/моль; | Δ S°298 | 73,2 Дж/моль.K |
Легче всего получается при добавлении концентрированной серной кислоты к насыщенному раствору дихромата натрия или калия или обработкой раствором h3SO4 хромата бария с последующей перекристаллизацией CrO3 из водного раствора:
Na2Cr2O7 (конц.) + h3SO4 (конц.) = 2CrO3↓ + Na2SO4 + h3O.
При растворении в воде, в зависимости от концентрации, образует хромовые кислоты различного состава:
CrO3 + h3O → h3CrO4 (желтый р-р)
2CrO3 + h3O → h3Cr2O7 (оранжевый р-р)
3CrO3 + h3O → h3Cr3O10 (красный р-р) и т.д.
Пероксид хрома (VI) CrO5. Диамагнитное соединение, которое в водном растворе взаимодействует с щелочами, оксидами щелочных металлов, с кислотами. Раствор в эфире имеет синий цвет. Получают обработкой на холоду раствора хромата щелочного металла эфирным раствором пероксида водорода и разбавленной серной кислоты.
Фтористый хромил CrO2F2. Красновато-коричневое газообразное вещество, которое при охлаждении ниже 29,6оС превращается в фиолетово-красные ромбоэдрические кристаллы (плотность равна 2,9 г/см3). tпл=30°С. Гидролизуется водой. Действует на стекло. Восстанавливается цинком и натрием с образованием хрома. Получают действием концентрированной серной кислоты на смесь фторида кальция с хроматом свинца или с бихроматом калия при нагревании, обработкой безводной плавиковой кислотой CrO3 или K2Cr2O7.
Хлористый хромил CrO2Cl2. Кроваво-красная диамагнитная жидкость (плотность равна 1,92 г/см3), tпл=-97°С, tкип=117°С. Неустойчив на свету и при нагревании. Дымит во важном воздухе вследствие гидролиза. Растворяется в диэтиловом эфире, сероуглероде, тетрахлорметане. Является окислителем и хлорирующим агентом. Получают нагреванием смеси порошка хромата или бихромата щелочного металла с концентрированной серной кислотой и каким-нибудь хлоридом или действием хлороводорода на CrО3.
Хромокалиевые квасцы KCr(SO4)2•12h3O. Фиолетовые октаэдрические кристаллы. Плотность равна 1,83 г/см3. Хорошо растворяются в воде, мало растворимы в спирте. Выпадают при выпаривании водного раствора, полученного смешением сульфата калия и сульфата хрома (III) в стехиометрических количествах или восстановлением с помощью этилового спирта подкисленного раствора K2Cr2O7. Применяют при дублении кож и в качестве протравы в текстильном производстве.
Хромат натрия Na2CrO4. Желтые ромбические бипирамидальные кристаллы. tпл=792°С, плотность равна 2,723 г/см3. Растворяется в воде, метаноле. Мало растворим в этаноле. Под действием кислот превращается в би-, три-, или полихромат. Известны кристаллогидраты Na2CrO4•nН2О (n=4, 6, 10). Устойчив в щелочной среде.
Хромат калия K2CrO4. Слабо парамагнитные желтые ромбические бипирамидальные кристаллы. Плотность равна 2,732 г/см3, tпл=975°С. Растворяется в воде, в жидком диоксиде серы и мало растворим в спирте. Обладает окислительными свойствами. Под действием кислот превращается в би-, три-, или полихромат. Устойчив в щелочной среде.
Таблица 10. [12].
| Δ H°обр | -1407,9 кДж/моль; | Δ G°298 | -1299,8 кДж/моль; | Δ S°298 | 200 Дж/моль.K |
Может быть получен при сплавлении Cr2O3 с KOH в присутствии окислителей, окислением щелочных растворов Cr3+, подщелачиванием раствора дихромата калия:
2K[Cr(OH)4] + 3Cl2 + 8KOH → 2K2CrO4 + 6KCl + 8h3O
K2Cr2O7 + 2KOH → 2K2CrO4 + h3O
CrO3 + 2KOH → K2CrO4 + h3O.
Хромат калия – сильный окислитель. Применяется при дублении кож, отбеливании воска, как протрава в текстильной промышленности, в производстве красителей. ПДК 0,01 мг/м3 (в пересчете на CrO3).
Дихромат натрия Na2Cr2O7. Слабо парамагнитные расплывающиеся на воздухе оранжево-желтые ромбические кристаллы. Обладает окислительными свойствами. tпл=320°С. Растворяется в воде и спирте. Известен кристаллогидрат Na2Cr2O7•2Н2О. Устойчив в кислой среде. Используют при дублении кож и в электрических элементах.
Дихромат калия K2Cr2O7. Оранжевые триклинные кристаллы. tпл=398°С, плотность равна 2,73 г/см3. Токсичный и горький на вкус. Растворяется в воде, в жидком диоксиде серы и мало растворим в жидком аммиаке и спирте. Обладает сильными окислительными свойствами. Устойчив в кислой среде. Применяют при дублении кож, в производстве спичек и в качестве окислителя в химической лаборатории.
Таблица 11. [12].
| Δ H°обр | -2062 кДж/моль; | Δ G°298 | -1882 кДж/моль; | Δ S°298 | 291 Дж/моль.K |
Получается при подкислении водного раствора хромата калия, взаимодействием гидроксида или карбоната калия с хромовым ангидридом:
2K2CrO4 + 2h3SO4 → K2Cr2O7 + 2KHSO4 + h3O
2CrO3 + 2KOH → K2Cr2O7 + h3O
2CrO3 + K2CO3 → K2Cr2O7 + CO2 .
Дихромат калия – сильный окислитель, ядовит. Области применения: в производстве спичек, при дублении кож, протрава при крашении тканей, в лабораторной практике, ингибитор коррозии металлов и сплавов. Широко известна так называемая хромовая смесь, содержащая дихромат калия, концентрированную серную кислоту и немного воды. Хромовая смесь находит применение в лабораторной практике в качестве эффективного средства для мытья химического стекла, обращаться с ней нужно крайне осторожно.
Дихромат аммония (Nh5)2Cr2O7. Оранжево-красные моноклинные кристаллы. Плотность равна 2,15 г/см3. Устойчив на воздухе. Растворяется в воде и спирте. Разлагается при нагревании с образованием азота, оксида хрома (III) и воды.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N) [12].
Таблица 12. Свойства некоторых соединений хрома.
| Соединение | Сингония | Параметры решетки, им | Т.пл., °С | Плотн., г/см3 | CHобр кДж/моль | ||
| а | b | с | |||||
| Сr2В | Ромбич. | 1,471 | 0,741 | 0,425 | 1870 | 6,07 | _ |
| Сr5В3 | Тетрагон. | 0,546 | — | 1,064 | 1890" | 6,03 | — |
| СrВ | Ромбич. | 0,2969 | 0,7858 | 0.2932 | 2090 | 6,17 | — |
| Сr3В4 | " | 0,2986 | 1,302 | 0,2952 | 2070 | 5,22 | — |
| СrВ2 | Гексагон. | 0,2969 | _ | 0,3066 | 2200 | 5,6 | -125,6 |
| CrB4 | Ромбич. | 0,4744 | 0,5477 | ОД866 | 1600б | _ | _ |
| Сr23С6 | Кубич. | 1,0638 | _ | _ | 1520 | 7,0 | -209,4 |
| Сr7С3 | Гексагон. | 1,398 | — | 0,4532 | 1780 | 6,9 | -178 |
| Сr3С2 | Ромбич. | 0,2821 | 0,552 | 1,146 | 1895 | 6,68 | -88 |
| Cr3Si | Кубич. | 0,4564 | — | — | 1770 | — | -138 |
| Cr5Si3 | Тетрагон. | 0,9178 | — | 0,4659 | 1680 | 5,5 | -327 |
| CrSi | Кубич. | 0,4629 | _ | _ | 1475a | 5,37 | -71 |
| CrSi2 | Гексагон. | 0,4422 | — | 0,6351 | 1490 | -101 | |
| Cr2N | Гексагон. | 0,4806 | — | 0,4479 | 1650 | 6,5 | -128,6 |
| CrN | Кубич. | 0,4148 | — | — | 1500б | 5,8 | -123,4 |
Хром является хорошим комплексообразователем. Подробно изучена одна из реакций медленного образования комплекса:
Cr(h3О)63+ + NCS- → Cr(h3O)5NCS2+ + h3O
Изучено большое число реакций трисоксалатохроь(III)-иона [Cr(C2O4)3]3-
[Cr(C2O4)3]3- + 2h3O→ [Cr(C2O4)2(h3O)2]- +С2O42-
Реакции идут в такой последовательности [15]:
[Cr(C2O4)3]3- + h4O+→[Cr(C2O4)2(OC2O3H)(h3O)]2-
[Cr(C2O4)2(OC2O3H)(h3O)]2- + h3O→ [Cr(C2O4)2(h3O)2]- + HС2O42-
[Cr(C2O4)2(OC2O3H)(h3O)]2- + h4O+ → [Cr(C2O4)2(h3O)2]- + h3С2O4
Реакция быстро достигает равновесия. Для хрома известен и такой комплекс: [Cr(h3О)4Cl2]Cl – дихлортетраквохром (III) хлорид [8].
Широко были исследованы обычные комплексы – нейтральные ацетилацетонаты, внутрикомплексное кольцо образует квазиароматическую систему, и могут быть осуществлены такие реакции, как галогенирование, нитрование и ацетилирование, например:
H 3C h4C
3C h4C
C O C O
H C Cr(acac)2 Br2, B Br C Cr(acac)2 +HBr , CHCl3
C O C O
h4C h4C
где acac – анион ацетилацетона.
Вывод. Хром интересен своими свойствами не только как элемент, но и как металл, чистый или участвующий в образовании соединений. Электронная конфигурация [Ar] 3d5 4s1. Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Известны соединения двухвалентного, трехвалентного, четырехвалентного и шестивалентного хрома.
studfiles.net
Хром как промышленный яд
Хром используют в производстве хромовых солей (монохроматы, бихроматы, хромовый ангидрид и др.), при хромировании металлов, выплавке качественных сталей, сплавов, металлического хрома, производстве фунгицидов, катализаторов, а также в пиротехнической, кожевенной, текстильной, деревообрабатывающей и других отраслях промышленности.
В производственных условиях хром проникает в организм главным образом через дыхательные пути, а также через желудочно-кишечный тракт, кожу и слизистые оболочки.
Токсичность соединений хрома зависит от их химического состава, структуры и физического состояния. Наиболее токсичны шестивалентные соединения хрома, причем бихроматы токсичнее хроматов; менее токсичны трехвалентные соединения хрома; малотоксичны двухвалентные соединения и сам хром. Токсичность соединений хрома связана с их растворимостью в воде и жидкостях организма. Пыль его плохо растворимых соединений (хромита, феррохрома) может вызывать пневмокониозы (см.).
Предельно допустимая концентрация хромового ангидрида, хроматов, бихроматов (в пересчете на CrO3) в воздухе производственных помещений — 0,01 мг/м3.
Для воздействия шестивалентных соединений хрома на организм характерны выраженные местные поражения кожи и слизистых оболочек, а также общетоксическое действие. Являясь сильными окислителями, соединения хрома могут нарушать нормальное течение процессов обмена в организме и угнетать активность ряда ферментных систем. Хром оказывает также канцерогенное действие, в частности может вызвать бронхопульмональный рак.
Острое отравление соединениями хрома в условиях производства наблюдается редко. Оно возможно при авариях, чистке реакторов, гальванических ванн. При этом возникают явления острого гастроэнтерита, поражения печени, почек, легких и нервной системы, иногда со смертельным исходом.
При работе с хромовыми солями на коже могут возникать хромовые язвы и аллергические дерматиты, а также некротически-язвенные поражения носовой перегородки и ее прободение.
В клинической картине хронической хромовой интоксикации могут быть выделены две формы: одна характеризуется преимущественным поражением органов дыхания, другая — желудочно-кишечного тракта. В первом случае уже на ранних этапах заболевания обнаруживается бронхит; может возникнуть бронхиальная астма. В дальнейшем присоединяются явления выраженной эмфиземы, хронического бронхита, пневмосклероза. Хромовый пневмосклероз часто осложняется бронхоэктатической болезнью. Развивающаяся легочная недостаточность нередко сочетается с сердечной вследствие дистрофических изменений миокарда.
При другой форме поражения особенно выражены диспептические явления, связанные с развитием дискинетических, токсико-воспалительных и язвенных процессов в желудочно-кишечном тракте. В начальном периоде интоксикации наблюдается дискинезия желудка и двенадцатиперстной кишки с выраженными секреторными изменениями, сменяющаяся в последующем гастритом, сначала гиперацидным, а в более поздние сроки — анацидным. Довольно часто наблюдается язвенная болезнь двенадцатиперстной кишки. Эта форма интоксикации нередко сочетается с изменениями печени и поджелудочной железы с нарушениями пигментного, углеводного и белкового обменов.
Изменения со стороны почек характеризуются микрогематурией и умеренной альбуминурией. Со стороны нервной системы наблюдаются явления вегетативно-сосудистой дистонии, артериальной гипотонии, брадикардии. Морфологический состав крови существенно не изменяется.
Диагностика поражений основывается на учете данных профессионального анамнеза и характеристики санитарного состояния цеха. Обнаружение хрома в биологических субстратах приобретает значение только при наличии клинических данных.
Лечение общетоксических поражений имеет комплексный характер. Принимают меры для удаления хрома из организма и устранения последствий его воздействия. Предложено применять инъекции 5% водного раствора унитиола (50 мл на курс) в сочетании с приемом аскорбиновой кислоты. Диета должна быть щадящей, богатой витаминами и белками. Применяют также внутривенные вливания глюкозы с аскорбиновой кислотой, липокаин, метионин и холин. Хорошие результаты получены при лечении кварцем хромовых язв кожи и некротически-язвенных поражений носа.
Профилактика. Важнейшее значение имеют технические мероприятия: герметизация аппаратуры, автоматизация производственных процессов, вентиляция производственных помещений. Меры индивидуальной защиты: респираторы, защитная одежда, обувь, перчатки, соблюдение правил личной гигиены. Е. А. Бушуева рекомендует в период развития некроза носовой перегородки удалить больного из вредного цеха на 1,5—2 месяца (до образования рубцовой ткани, предупреждающей прободение).
Обязательны периодические медосмотры один раз в год и ежемесячные осмотры отоларингологом.
www.medical-enc.ru
Шестивалентный хром Вики
 Твёрдый металл голубовато-белого цвета Твёрдый металл голубовато-белого цвета | |
| Хром / Chromium (Cr), 24 | |
| 51,9961(6)[1] а. е. м. (г/моль) | |
| [Ar] 3d5 4s1 | |
| 130 пм | |
| 118 пм | |
| (+6e)52 (+3e)63 пм | |
| 1,66 (шкала Полинга) | |
| −0,74 | |
| 6, 3, 2, 0 | |
| 652,4 (6,76) кДж/моль (эВ) | |
| 7,19 г/см³ | |
| 2130 K | |
| 2945 K | |
| 21 кДж/моль | |
| 342 кДж/моль | |
| 23,3[2] Дж/(K·моль) | |
| 7,23 см³/моль | |
| кубическая объёмноцентрированая | |
| 2,885 Å | |
| 460 K | |
| (300 K) 93,9 Вт/(м·К) | |
| 7440-47-3 | |
Хром — элемент побочной подгруппы 6-й группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам.
История[ | код]
Происхождение названия[ | код]
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История[ | код]
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе[ | код]
Хром является довольно распространённым элементом в земной коре (0,012 % по массе)[3]. Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения[ | код]
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[4], Бразилии, на Филиппинах[5].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире)[5].
Геохимия и минералогия[ | код]
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение[ | код]
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Fe(CrO2)2+4C→Fe+2Cr+4CO{\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2{\displaystyle {\mathsf {4Fe(CrO_{2})_{2}+8Na_{2}CO_{3}+7O_{2}\rightarrow 8Na_{2}CrO_{4}+2Fe_{2}O_{3}+8CO_{2}}}}2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
Na2Cr2O7+2C→Cr2O3+Na2CO3+CO{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+2C\rightarrow Cr_{2}O_{3}+Na_{2}CO_{3}+CO}}}5) с помощью алюминотермии получают металлический хром:
Cr2O3+2Al→Al2O3+2Cr+130kcal{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr+130kcal}}}6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Физические свойства[ | код]
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5[6], один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства[ | код]
Характерные степени окисления[ | код]
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены[7].
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
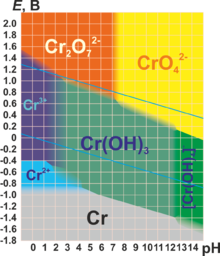
| +6 | CrO3 (красный) | h3CrO4 h3Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество[ | код]
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)[ | код]
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr3+→Zn,HCl[H]2Cr2+{\displaystyle {\mathsf {2Cr^{3+}{\xrightarrow[{Zn,HCl}]{[H]}}2Cr^{2+}}}}Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[8]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)[ | код]
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(h3O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12h3O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr3++3Nh4+3h3O→Cr(OH)3↓+3Nh5+{\displaystyle {\mathsf {Cr^{3+}+3NH_{3}+3H_{2}O\rightarrow Cr(OH)_{3}\downarrow +3NH_{4}^{+}}}}Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr3++3OH−→Cr(OH)3↓{\displaystyle {\mathsf {Cr^{3+}+3OH^{-}\rightarrow Cr(OH)_{3}\downarrow }}} Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}Сплавляя Cr2O3 со щелочами, получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH\rightarrow 2NaCrO_{2}+H_{2}O}}}Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na3[Cr(OH)6]+3h3O2→2Na2CrO4+2NaOH+8h3O{\displaystyle {\mathsf {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O}}}То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O{\displaystyle {\mathsf {2Cr_{2}O_{3}+8NaOH+3O_{2}\rightarrow 4Na_{2}CrO_{4}+4H_{2}O}}}Соединения хрома (+4)[ | код]
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)[ | код]
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая h3CrO4 и двухромовая h3Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую h3CrO4, дихромовую h3Cr2O7 и другие изополикислоты с общей формулой h3CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO42−+2H+→Cr2O72−+h3O{\displaystyle {\mathsf {2CrO_{4}^{2-}+2H^{+}\rightarrow Cr_{2}O_{7}^{2-}+H_{2}O}}}Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
Cr2O72−+2OH−→2CrO42−+h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+2OH^{-}\rightarrow 2CrO_{4}^{2-}+H_{2}O}}}До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3{\displaystyle {\mathsf {H_{2}Cr_{n}O_{3n+1}\rightarrow H_{2}O+nCrO_{3}}}}Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Ba2++CrO42−→BaCrO4↓{\displaystyle {\mathsf {Ba^{2+}+CrO_{4}^{2-}\rightarrow BaCrO_{4}\downarrow }}} 2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+14HCl\rightarrow 2CrCl_{3}+2KCl+3Cl_{2}\uparrow +7H_{2}O}}}Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5(CrO32-O2- , который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение[ | код]
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие[ | код]
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен[9], металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.

Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома.[10] Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании.[11] На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей.[11] В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.[12]
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³).[13][14] В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).[15]
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[16]
См. также[ | код]
Примечания[ | код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 308.
- ↑ 1. Дроздов А. А. и др. Неорганическая химия: В 3 т./Под ред. ЮД Третьякова. T. 2: Химия переходных металлов. – 2004. 2. Greenwood N. N., Earnshaw A. Chemistry of the Elements. – 1984.
- ↑ статья «Минеральные ресурсы». Энциклопедия «Кругосвет». Архивировано 21 августа 2011 года.
- ↑ 1 2 ХРОМ | Онлайн Энциклопедия Кругосвет.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- ↑ Реми Г. Курс неорганической химии. Т. 2. М., Мир, 1966. С. 142—180.
- ↑ Некрасов Б. В. Курс общей химии. М:, ГНХТИ, 1952, С. 334
- ↑ Хром // Большая медицинская энциклопедия : в 30 т. / гл. ред.Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1986. — Т. 27. Хлоракон - Экономика здравоохранения. — 576 с. — 150 000 экз.
- ↑ Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, «Chromium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ 1 2 IARC. Volume 49: Chromium, Nickel, and Welding. — Lyon : International Agency for Research on Cancer, 1999-11-05. — «There is sufficient evidence in humans for the carcinogenicity of chromium[VI] compounds as encountered in the chromate production, chromate pigment production and chromium plating industries.». — ISBN 92-832-1249-5.
- ↑ Salnikow, K. and Zhitkovich, A., «Genetic and Epigenetic Mechanisms in Metal Carcinogenesis and Cocarcinogenesis: Nickel, Arsenic, and Chromium», Chem. Res. Toxicol., 2008, 21, 28-44. DOI:10.1021/tx700198a
- ↑ OSHA: Small Entity Compliance Guide for the Hexavalent Chromium Standards
- ↑ David Blowes (2002). «Tracking Hexavalent Cr in Groundwater». Science 295: 2024–25. DOI:10.1126/science.1070031. PMID 11896259.
- ↑ ПДК воздуха населенных мест
- ↑ Официальный сайт Эрин Брокович, страница, посвящённая фильму
Ссылки[ | код]
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3,W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
ru.wikibedia.ru
Соединение - шестивалентный хром - Большая Энциклопедия Нефти и Газа, статья, страница 1
Соединение - шестивалентный хром
Cтраница 1
Соединения шестивалентного хрома ( хромовая кислота и ее соли) применяются при нанесении гальванических хромовых покрытий, при химической обработке ( травление, пассивирование) поверхности стальных изделий и изделий из медных сплавов, оцинкованных и кадмированных стальных изделий, при электрохимической обработке ( анодировании) изделий из алюминия и его сплавов, при электрополировке стальных изделий. Высокотоксичные соединения шестивалентного хрома содержатся в образующихся в этих процессах промывных сточных водах, а также в отработанных технологических растворах. [1]
Соединения шестивалентного хрома ( хромовый ангидрид, хпомпики, хлористый хромил) используют в качестве сильных окислителей, в частности во многих процессах органического синтеза - при получении ализарина, сахарина, бензойной кислоты, антрахинона, гидрохинона, в производстве резин, пористых пластиков. [2]
Соединения шестивалентного хрома получают окислением металлического хрома или соединений двух - и трехвалентного хрома. Они окрашены в желтый, оранжевый, красный или коричневый цвета и обладают окислительными свойствами. [3]
Соединения шестивалентного хрома в Кислой среде являются сильными окислителями. Окисляя вещества, они переходят в соли трехвалентного хрома и изменяют окраску в зеленый цвет. [4]
Соединения шестивалентного хрома являются сильными окислителями. Хромовый ангидрид при растворении в воде образует смесь полихромовых кислот. Все хромовые кислоты относятся к сильным; по мере усложнения их состава степень их диссоциации в разбавленных растворах возрастает. [5]
Соединения шестивалентного хрома получают окислением различных типов соединений двух - и трехвалентного хрома. Они окрашены в желтый, оранжевый, красный или коричневый цвета и обладают окислительными свойствами. [6]
Соединения шестивалентного хрома ( хромовый ангидрид, хромпики, хлористый хромил) используют в качестве сильных окислителей, в частности во многих процессах органического синтеза - при получении ализарина, сахарина, бензойной кислоты, антрахинона, гидрохинона, в производстве резин, пористых пластиков. [7]
Соединения шестивалентного хрома, особенно в кислом растворе, являются сильными окислителями. Производя окисление, они переходят в соединения трехвалентного хрома. При этом происходит изменение окраски. [8]
Соединения шестивалентного хрома ( хромовый ангидрид, хромпики, хлористый хромил) используют в качестве сильных окислителей, в частности во многих процессах органического синтеза - при получении ализарина, сахарина, бензойной кислоты, антрахинона, гидрохинона, в производстве резин, пористых пластиков. [9]
Нейтрализация соединений шестивалентного хрома протекает при рН 2 - 2 5; поэтому все время происходит автоматическое подкисление раствора 20 - 30-процентной серной кислотой. [10]
Из соединений шестивалентного хрома важнейшими являются: хромовый ангидрид СгО3, соли хромовой кислоты Н2СгО4 - хромат ы и соли двухромовой кислоты Н2Сг2О7 - бихроматы. [11]
Из соединений шестивалентного хрома главными являются хромовый ангидрид Сг03 и соли хромовых кислот. [12]
Из соединений шестивалентного хрома наиболее распространены: хромовый ангидрид, соли хромовой и двухромовой кислот. [13]
Из соединений шестивалентного хрома обычно применяют хромовый ангидрид, а также бихромат аммония, калия и натрия. [14]
Из соединений шестивалентного хрома важнейшими являются: хромовый ангидрид СгО3, соли хромовой кислоты Н2СгО4 - хромат ы и соли двухромовой кислоты Н2Сг2О7 - бихроматы. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Шестивалентный хром - Большая Энциклопедия Нефти и Газа, статья, страница 1
Шестивалентный хром
Cтраница 1
Шестивалентный хром легко проникает через клеточные мембраны и в клетках восстанавливается до трехвалентного хрома. Концентрация хрома в эритроцитах может служить показателем интенсивности воздействия шестивалентного хрома в течение жизни красных кровяных клеток, но к трехвалентному хрому это не относится. [1]
Шестивалентный хром в подкисленных водных растворах двухромовокислого калия восстанавливается под действием ионизирующих излучений до трехвалентного состояния. [3]
Шестивалентный хром в реакции с дифенилкар-базидом в слегка подкисленном растворе дает красновато-фиолетовую окраску. [4]
Шестивалентный хром встречается в щелочных растворах в виде. В твердой фазе присутствует преимущественно гидроокись хрома. [5]
Шестивалентный хром образует трехокись СгО3, соли гипотетической хромовой кислоты Н2СгО4 ( хроматы) и ее хлорангидрид СгО2С12, а также синие перхроматы. Характерно образование изополикислот, известных в виде солей: би -, три - и тетрахроматов. [6]
Шестивалентный хром восстанавливают спиртом до Cr3 и отделяют вместе с магнием едким1 натром. Борную кислоту переводят с помощью глицерина, маннита или инверт-ного сахара в более сильную комплексную кислоту и титруют едким натром в присутствии фенолфталеина. [7]
Дальше шестивалентный хром не мешает, так как он не осаждается ни с кальцием, ни с магнием. Определение хрома допускает присутствие большого числа элементов. [8]
Шестивалентный хром бихромата щелочного металла в присутствии лигносульфоната восстанавливается до трехвалентного, образуя прочные комплексные хромоорганические соединения в виде твердеющих гелей. Концентрация хрома в растворе выше 5 % небезопасна с точки зрения экологии и токсикологии. [9]
Содержание шестивалентного хрома определяют так же, но без окисления хрома персульфатом аммония. [10]
Определение шестивалентного хрома основано на окислении им дифенилкарбазида в кислом растворе. Образующееся при этом соединение окрашивает раствор в красно-фиолетовый цвет. Интенсивность образовавшейся окраски сравнивают с интенсивностью окраски стандартного раствора хрома и определяют его содержание. [11]
Соединения шестивалентного хрома, особенно в кислом растворе, являются сильными окислителями. Производя окисление, они переходят в соединения трехвалентного хрома. При этом происходит изменение окраски. [12]
Соединения шестивалентного хрома ( хромовый ангидрид, хромпики, хлористый хромил) используют в качестве сильных окислителей, в частности во многих процессах органического синтеза - при получении ализарина, сахарина, бензойной кислоты, антрахинона, гидрохинона, в производстве резин, пористых пластиков. [13]
Переход шестивалентного хрома в трехвалентный протекает за счет присоединения 3 электронов. [14]
Соли шестивалентного хрома легко восстанавливаются в кислой среде до трехвалентного состояния. [15]
Страницы: 1 2 3 4
www.ngpedia.ru






![{\mathsf {2Cr^{{3+}}{\xrightarrow[ {Zn,HCl}]{[H]}}2Cr^{{2+}}}}](/800/600/https/wikimedia.org//api/rest_v1/media/math/render/svg/873456269702893f9470b95c7e1b294f21917bb9)

 Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}
Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}![{\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{{3-}}}}](/800/600/https/wikimedia.org//api/rest_v1/media/math/render/svg/c9d64c69e636a79d9927cc08b29d0f22c060e9fc)


![{\mathsf {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O}}](/800/600/https/wikimedia.org//api/rest_v1/media/math/render/svg/57d5eb722c9c304f88a53561b054ea68e446d6d5)




 2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}
2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}









