Большая Энциклопедия Нефти и Газа. Валентные возможности хрома
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова, который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И. Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул (энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными, если электрон 1 – неспаренный. Например:
6C 1s22s22p2
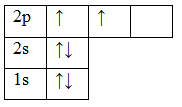
Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и фосфора.
7N 1s22s22p3
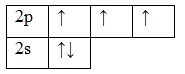
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также все валентности, характерные для этого элемента.
15P 1s22s22p63s23p3
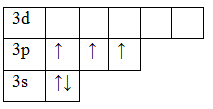
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т.е. переходить в возбужденное состояние.
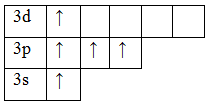
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например, медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
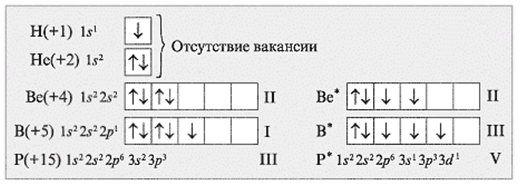
Задания: определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
33As 1s22s22p63s23p63d104s24p3
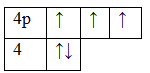
Основное состояние. Валентность равна III.
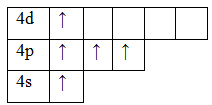
Возбужденное состояние. Валентность равна V.
17Cl 1s22s22p63s23p5
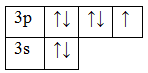
Основное состояние. Валентность равна I.
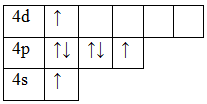
Возбужденное состояние 1. Валентность равна III.
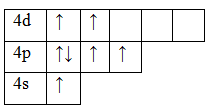
Возбужденное состояние 2. Валентность равна IV.
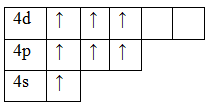
Возбужденное состояние 3. Валентность равна VII.
Валентные возможности - элемент - Большая Энциклопедия Нефти и Газа, статья, страница 1
Валентные возможности - элемент
Cтраница 1
Валентные возможности элементов, Имея в виду оба описанные выше механизма образования - ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. [1]
Интересные валентные возможности элементов проявляются в соединениях типа ферроцена, дибензол-хрома и др. В этих молекулах атом металла ( железо, хром, никель и др.) находится посредине, а по обе стороны от него в параллельных плоскостях расположены органич. По-видимому, связь в этих соединениях осуществляется за счет jt - электропов колец и свободных валентных орбит атома металла. [2]
Интересные валентные возможности элементов проявляются в соединениях типа ферроцена, дибензол-хрома и др. В этих молекулах атом металла ( железо, хром, никель и др.) находится посредине, а по обе стороны от него в параллельных плоскостях расположены органич. По-видимому, связь в этих соединениях осуществляется за счет я-электронов колец и свободных валентных орбит атома металла. [3]
Таким образом, оценивая валентные возможности элементов, следует учитывать наличие неспаренных электронов в основном и валентно-возбужденных состояниях атома, вакантных орбиталей и неподеленных электронных пар. [4]
При образовании комплексных соединений валентные возможности элемента расширяются за счет донорно-акцепторного взаимодействия с лигандами. Устойчивые комплексы образуются в тех случаях, когда у комплексообразователя имеются вакантные орбитали, близкие по энергии к заполненным или заполняющимся. Поэтому-то более прочные связи и наблюдаются, когда в их образовании участвуют вакантные кайносимметричные 2 / 7 -, 3d -, 4 / - орбитали. Кроме того, устойчивость многих комплексов повышается при возможности я-взаимодействия между комплексообразователем и лигандами. Это возможно в тех случаях, когда лиганды имеют не только неподеленные электронные пары, обусловливающие их до-норную активность, но и вакантные орбиталн. При этом образование я-связей осуществляется за счет переноса электронной плотности по донорно-акцепторному механизму с комплексообразователя на лиганды. Именно таким образом возникают соединения, подобные карбонилам переходных металлов. За счет комплексообразования часто стабилизируются такие степени окисления элементов, которые в соединениях первого порядка неустойчивы или вовсе нехарактерны. Так, хорошо известно, что степень окисления 4 для свинца нестабильна и соответствующие соединения являются сильными окислителями. Кроме того, многие из них, например РЬС14, неустойчивы даже при комнатной температуре, а РЬВг, и РЬ14 вообще не существуют. Однако комплексные кислоты HJPbFel и их солеобразные производные весьма устойчивы. [5]
При образовании комплексных соединений валентные возможности элемента расширяются за счет донорно-акцепторного взаимодействия с лигандами. Устойчивые комплексы образуются в тех случаях, когда у комплексообразователя имеются вакантные орбитали, близкие по энергии к заполненным или заполняющимся. Поэтому-то более прочные связи и наблюдаются, когда в их образовании участвуют вакантные кайносимметричные 2р -, 3rf -, 4 / орбитали. Кроме того, устойчивость многих комплексов повышается при возможности тг-взаимодействия между комплексообразователем и лигандами. Это возможно в тех случа. [6]
При образовании комплексных соединений валентные возможности элемента расширяются за счет донорно-акцепторного взаимодействия с лигандами. Устойчивые комплексы образуются в тех случаях, когда у комплексообразователя имеются вакантные орбитали, близкие по энергии к заполненным или заполняющимся. Поэтому-то более прочные связи и наблюдаются, когда в их образовании участвуют вакантные кайносимметричные 2р -, 3rf -, 4 / юрбитали. Кроме того, устойчивость многих комплексов повышается при возможности т-взаимодействия между комплексообразователем и лигандами. Это возможно в тех случаях, когда лиганды имеют не только неподеленные электронные пары, обусловливающие их донорную активность, но и вакантные орбитали. [7]
Проявление донорно-акцепторных возможностей атомов повышает их максимальную валентность по сравнению с максимальной ковалентностью. Рассмотрим, например, максимальные валентные возможности элементов второго периода. [8]
Если глубже рассмотреть известные свойства даже самых простых соединений, то станет ясно, что валентные возможности элементов не исчерпаны. [9]
Ведь кислород никогда не бывает шестивалентным, а фтор - семивалентным. Причина - электронные конфигурации этих элементов. Во-вторых, часто валентные возможности элемента вроде бы велики, но он их почему-то не может до конца использовать. [10]
У элементов 2-го периода имеется четыре валентные орбитали, поэтому максимально возможное число ковалентных связей равно четырем. У элементов 3-го и последующих периодов роль валентных могут играть также свободные внешние d - орбитали, а для элементов 5-го и последующих периодов - даже / - орбитали. В соответствии со сказанным в главных подгруппах периодической системы валентные возможности элементов возрастают. У d - элементов в образовании химических связей принимают участие пять ( п - 1) а -, одна ns - и три / tjp - орбиталей. К сожалению, не всегда представляется возможным установить численное значение максимальной валентности элемента в соединении. Если для элементов 2-го периода этот вопрос решается однозначно, то для элементов других периодов мнения ученых весьма противоречивы. [11]
По каким механизмам возможно образование ковалент юй связи. Чем определяются валентные возможности элемента. От чего зависит пространственная конфигурация молекул. [12]
Страницы: 1
www.ngpedia.ru
Соединения трех.валентного хрома - Справочник химика 21
ХРОМ. Сг. Химический элемент VI группы периодической системы элементов. Валентность 2, 3, 6. Атомный вес 52,00. В природе встречается главным образом в виде хромистого железняка РеО СЮз. Образует три окисла закись X. СгО, окись СгаОз и хромовый ангидрид СЮз Хромовые соединения предложено применять для протравливания семян. X. изучается в качестве микроэлемента в растениеводстве. Хромовые квасцы КСг(304)г НгО применяются для дубления кож. Для этой цели применяются также хромпики — натриевая и калиевая соли двухромовой кислоты. Соли X. ядовиты. [c.351] В природных водах атомы тяжелых металлов присутствуют в различных ионных и молекулярных формах. Такие элементы как железо, хром и марганец могут быть представлены также разными валентными состояниями. Выделяют три формы, в которых атомы тяжелых металлов мигрируют в водных средах истинно растворенная, взвешенная и коллоидная. Валентное состояние атомов этих элементов и формы их соединений в природных водах определяются совокупностью различных факторов и процессов (химических и биотических, гидрологических и гидродинамических). [c.249]Другие пути протекания процессов электроокисления и электровосстановления, Три рассмотренных варианта не исчерпывают всех возможных путей протекания окислительно-восстановительных реакций. В роли восстановительных или окислительных агентов могут выступать также находящиеся в растворе ионы металлов. В этом случае электродный процесс сводится к окислению (или восстановлению) ионов металлов переменной валентности, которые затем восстанавливают (или окисляют) органическое соединение. В качестве примера можно указать на электроокисление суспензии антрацена. При проведении электролиза такой суспензии почти весь ток на аноде расходуется на выделение кислорода. Если, однако, добавить к ней небольшое количество солей церия, хрома или марганца, то на аноде наряду с кислородом образуется также антра-хинон. Реакция идет, по-видимому, следующим образом ионы металла, например церия, окисляются на аноде [c.408]
В хромовом комплексе этого красителя во внутренней координационной сфере атом хрома соединен с четырьмя нейтральными группами и атомами (три молекулы воды и один атом азота) и двумя отрицательно заряженными атомами кислорода. Следовательно, одна положительная валентность трехвалентного хрома насыщается отрицательной сульфогруппой, которая не входит во внутреннюю координационную сферу молекулы комплексного соединения [c.105]
При соединении с кислородом хром образует три окисла закись хрома Сл О — основной окисел, окись хрома rgOg— амфотерный окисел и хромовый аигидрид СгО.,— кислотный окисел. Соответственпо этим окислам существуют и три ряда соединений хрома. Соединения двухвалентного хрома очень неустойчивы и на воздухе быстро окисляются и переходят в соединения трех- валентного хрома. Из трехвалентных соединений окись хрома r. Oj представляет собой твердое вещество зеленого цвета. Применяется для приготовления зеленой краски. Служит добавкой для окраски стекла и фарфора. Гидрат окиси хрома Сг(0Н)з, подобно другим окислам, образуется при действии щелочей па соли трехвалентного хрома. Обладает амфотерными свойствами [c.264]
Все три элемента обладают значительным сходством химических свойств. К таковым относятся, в частности, поливалентность, способность образовывать изополи- и гетерополисоединения. Все три элемента обладают как металлическими, так и неметаллическими свойствами. Основные свойства окислов усиливаются от хрома к вольфраму. Хромовая кислота Н2СГО4 более сильная, чем вольфрамовая. Устойчивость соединений низших валентностей растет от вольфрама к хрому. Соединения молибдена (V) более устойчивы, чем вольфрама (V). Соединения хрома (III) —ярко выраженные ионные соединения. Соединения вольфрама (V) и молибдена (V) почти не имеют ионного характера. Об этом, в частности, говорит их высокая летучесть. [c.272]
Из приведенных схем видно, что у трехвалентного хрома, двух- и четырехвалентного марганца число валентных электронов меньше числа неспаренных электронов. Данное обстоятельство, а также некоторые другие особенности элементов побочных подгрупп в сильной степени усложняют вопрос о валентностях этих элементов. Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
Все три элемента близки по химическим свойствам. Это относится, в частности, к поливалентности, способности образовывать изополи-и гетерополисоединения, проявлению как металлических, так и неметаллических свойств.Основные свойства окислов усиливаются от хрома к вольфраму. Хромовая кислота Н2СГО4 более сильная, чем вольфрамовая. Устойчивость соединений с низшей валентностью растет от вольфрама к хрому. Соединения Мо(У) более устойчивы, чем (V). Соединения Сг(П1) — ярко выраженные ионные соединения. Соединения (У) и Мо(У) почти не имеют ионного характера. Об этом, в частности, говорит их высокая летучесть. Молибден и вольфрам намного более способны образовывать изополи- и гетерополисоединения, чем хром. [c.159]
Специфическое влияние молекулярного соотношения Ti/Al на процесс полимеризации, по-видимому, связано с природой соединения титана. В одном из патентов [28] указывается, что при использовании три-хл оридов титана и ванадия и оксихлоридов хрома при соотношениях Ti/Al или тяжелый металл/А1, меньших 0,5 1, можно получить иолибу-тадиен и полиизопрен, содержащие преимущественно пг/>акс-1,4-структуру. В патенте фирмы Гудрич [58] указывается, что использование этого соотнощения в случае четыреххлористого титана приводит к образованию полибутадиена смешанной 1,4-г мс- и 1,4-транс-структуры и полиизопрена, в основном имеющего вис-структуру. Использование меньших количеств галогенидов титана низшей валентности, по-видимому, эквивалентно исноль. зовашш больших количеств галогенида высшей валентности. [c.151]
Количество кислорода в СО2, СО и Н2О при продолжительности опытов 8 мин в полтора —два раза больше того количества, которое кожет получиться за счет перехода всей аналитически определяемой в катализаторе окиси хрома СгОз в СГ2О3. Следовательно, можно полагать, что после регенерации в катализаторе кроме СгОз (или соединений хрома с валентностью три — шесть), содержится адсорбированный или растворенный кислород. При увеличении объемной скорости бутана от 500 до 1000 ч- количество кислорода в продуктах окисления увеличивается примерно лишь на 20—25%. [c.44]
Из тридцати пяти кристаллических структур, описанных ниже в разделе Хром , одиннадцать относятся к соединениям хрома в его высших состояниях окисления (от IV до VI), шесть — к соединениям трехвалентного хрома, в двух присутствуют одновременно атомы Сг 1 и Сг , шестнадцать структур относятся к карбонильным соединениям (включая полусандви-чевые комплексы с органическими лигандами) и две — к некарбонильным я-комплексам хрома. Все соединения хрома высших валентностей являются кислородными, из восьми соединений, содержащих Сг , три кислородных, остальные содержат в качестве лигандов хлор, циано-, нитрозо- и гидроксогруппы, аммиак, триметиламин, воду и некоторые огранические моно- [c.9]
Она состоит, поскольку речь идет о хромате, в переходе положительного шестивалентного хрома в положительный трехвалентный. Что Сг в СгдО," и попутно в СгО " положительно шестивалентен следует из того, что иону бихромата и хромата отвечает соединение iOg, в котором кислород отрицательно двухвалентен (основанием для этого служит состав Н О и то, что Н образует положительный одновалентный катион). С другой стороны, это вытекает также из правила, что валентность (количество положительных или отрицательных зарядов) иона сложного состава получается суммированием валентностей содержащихся в нем элементов. i Следовательно, если неизвестную валентность Сг обозначить через х 2х—14 = — 2, откуда = -]- 6. — Сера при реакции с Сг. О," испытывает изменение валентности в противополо) ном смысле она из отрицательной двувалентной переходит в состояние с нулевой валентностью. Чтобы СгдО," восстановить до 2Сг (с чем связано падение валентности на 2X3 единиц) должны вступить во взаимодействие три моля HgS, для которых произойдет повышение валентности на 3 X 2 единиц. [c.147]
chem21.info