Хром, химический элемент: описание, свойства, формула и характеристика. Элемент хром
описание, свойства, формула и характеристика
Хром – химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно бихромат калия и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.

Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO4. Сегодня он известен как минерал кроконт.
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной свинцовой руды. Путем смешивания кроконта с соляной кислотой он получил оксид CrO3. Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.

Добыча и производство
Элемент производят из хромита (FeCr2O4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является кимберлитовой трубкой, богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na2CrO4), который восстанавливается углеродом до оксида Сг2O3. Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.

Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром – химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает анодированному алюминию рубиновый оттенок. Сг2O3, используемый для полировки металла, также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром – химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.

Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52Cr, 53Cr и 54Cr. Из них наиболее распространен 52Cr (83,8% всего природного хрома). Кроме того, описаны 19 радиоизотопов, из которых наиболее стабильным является 50Cr с периодом полураспада, превышающим 1,8x1017 лет. У 51Cr период полураспада – 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53Cr образуется при радиоактивном распаде 53Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53Cr/52Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.

Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг2O3, также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи – хромиты.
Бихромат калия
K2Cr2O7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в концентрированной серной кислоте. Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.

Хромовая кислота
Соединение обладает гипотетической структурой h3CrO4. Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом – триоксидом CrO3.
Хромат свинца (II)
PbCrO4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar–Cr–Cr–Ar, где Ar представляет собой специфическую ароматическую группу.

Применение
Хром – химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром – химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента – около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: [Ar]3d54s1.
fb.ru
Характеристика и качества хрома
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С - +3500С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
|
+3 |
Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный |
Cr3+ (зеленые или лиловые соли)[Cr(OH)4]- (зелёный) |
|
| +4 | CrO2 | не существует | Несолеобразующий | - |
Встречается редко, малохарактерна |
| +6 | CrO3 (красный) |
h3CrO4h3Cr2O7 |
Кислотный |
CrO42- (хроматы, желтые)Cr2O72- (дихроматы, оранжевые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
mining-prom.ru
Хром — общая характеристика элемента, химические свойства хрома и его соединений
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.

Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3h3O → Cr2O3 + 3h3
Хром растворяется в разбавленных сильных кислотах (HCl, h3SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3h3O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°→ Cr2O3 + N2+ 4h3O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + h3O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2h3O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4 → Cr2(SO4)3 + 6h3O Сr(ОН)3 + ЗН+ = Сr3+ + 3h3O
Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2h3O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3→(120oC –h3O) СrO(ОН) →(430-10000С –h3O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(Nh4 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8h3O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4 + h3SO4 → CrO3 + K2SO4 + h3O
K2Cr2O7 + h3SO4 → 2CrO3 + K2SO4 + h3O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + h3O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 → K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + h3O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4h3SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4h3O
K2Cr2O7 + 4h3SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4h3O
K2Cr2O7 + 7h3SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7h3O
K2Cr2O7 + 7h3SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7h3O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+h3 SO4(30%)=K2Cr2O7 +K2SO4 +h3O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8h3O+4KCl
2K2CrO4+2h3O+3h3S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8h3O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7h3O+2KCl (кипячение)
K2Cr2O7(т)+2h3SO4(96%) ⇌2KHSO4+2CrO3+h3O (“хромовая смесь”)
K2Cr2O7+KOH (конц ) =h3O+2K2CrO4
Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7h3O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +h3O
Cr2O72- +h3O +3h3S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72-(разб.) +h3O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7h3O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4(30%) = К2Cr2O7 + К2SO4 + Н2O

himege.ru
Хром и его характеристики
Общая характеристика хрома
Хром содержится в земной коре в количестве 0,02% (масс.). В природе он встречается главным образом в виде хромистого железняка FeO×Cr2O3.
Хром представляет собой твердый блестящий металл (рис. 1), плавящийся при 1890oС; плотность его 7,19 г/см 3. При комнатной температуре хром стоек и к воде, и к воздуху. Разбавленные серная и соляная кислоты растворяют хром с выделением водорода. В холодной концентрированной азотной кислоте хром нерастворим и после обработки ею становится пассивным.

Рис. 1. Хром. Внешний вид.
Атомная и молекулярная масса хрома
Поскольку в свободном состоянии хром существует в виде одноатомных молекул Cr, значения его атомной и молекулярной масс совпадают. Они равны 51,9962.
Изотопы хрома
Известно, что в природе хром может находиться в виде четырех стабильных изотопов 50Cr, 52Cr, 53Cr и 54Cr. Их массовые числа равны 50, 52, 53 и 54 соответственно. Ядро атома изотопа хрома 50Cr содержит двадцать четыре протона и двадцать шесть нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные изотопы хрома с массовыми числами от 42-х до 67-ми, среди которых наиболее стабильным является 59Cr с периодом полураспада равным 42,3 минуты, а также один ядерный изотоп.
Ионы хрома
На внешнем энергетическом уровне атома хрома имеется шесть электронов, которые являются валентными:
1s22s22p63s23p63d54s1.
В результате химического взаимодействия хром отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Cr0 -2e → Cr2+;
Cr0 -3e → Cr3+;
Cr0 -6e → Cr6+.
Молекула и атом хрома
В свободном состоянии хром существует в виде одноатомных молекул Cr. Приведем некоторые свойства, характеризующие атом и молекулу хрома:
|
Энергия ионизации атома, эВ |
6,76 |
|
Относительная электроотрицательность |
1,66 |
|
Радиус атома, нм |
0,130 |
Сплавы хрома
Металлический хром используется для хромирования, а также в качестве одного из важнейших компонентов легированных сталей. Введение хрома в сталь повышает её устойчивость против коррозии как в водных средах при обычных температурах, так и в газах при повышенных температурах. Кроме того, хромистые стали обладают повышенной твердостью. Хром входит в состав нержавеющих кислотоупорных, жаропрочных сталей.
Примеры решения задач
ru.solverbook.com
полезные свойства, симптомы недостатка (дефицита) и вред избытка
Описание
 Хром, как химический элемент представляет собой твердое металлическое вещество голубовато-белого цвета (см. фото). Он не окисляется при контакте с воздухом. Иногда его относят к черным металлам. Название свое он заслужил благодаря разнообразным комбинациям цвета своих соединений, и происходит оно от греческого слова chroma – цвет. Интересный факт, что слог «хром» применяется во многих сферах жизни. Например, слово «хромосома» (с греч.) – «тело, которое окрашивается».
Хром, как химический элемент представляет собой твердое металлическое вещество голубовато-белого цвета (см. фото). Он не окисляется при контакте с воздухом. Иногда его относят к черным металлам. Название свое он заслужил благодаря разнообразным комбинациям цвета своих соединений, и происходит оно от греческого слова chroma – цвет. Интересный факт, что слог «хром» применяется во многих сферах жизни. Например, слово «хромосома» (с греч.) – «тело, которое окрашивается».
Открытие этого элемента приходится на 1797 год и принадлежит Л.Н. Воклену. Он обнаружил его в минерале крокоите.
Большой природный запас хрома находится в земной коре, что не скажешь о морской воде. Страны, которые обладают этими запасами - это ЮАР, Зимбабве, США, Турция, Мадагаскар и другие. Биогенные соединения этого микроэлемента входят в состав тканей растений и животных, причем большее содержание приходится на животных.
Важное влияние хрома на организм человека было определено после проведения опыта на крысах в конце 1950-х годов. Двое ученых, Щварц и Мерц, в качестве эксперимента кормили крыс пищей, скудной на хром, что привело к появлению у животных непереносимости сахара, но при добавлении его в рацион, эти симптомы исчезали.
Действие хрома и его роль в организме
 Хром в организме человека задействован во многих сферах и имеет очень важную роль, однако основная его задача заключается в поддержке нормального баланса сахара в сыворотке крови. Это происходит за счет усиления процесса обмена углеводов путем облегчения транспортировки глюкозы внутрь клетки. Данное явление носит название глюкотолерантный фактор (ГТФ). Минерал раздражает рецепторы клетки по отношению к инсулину, который легче вступает с ней в взаимодействие, при этом уменьшается его потребность для организма. Поэтому микроэлемент так жизненно важен для диабетиков, особенно со II типом болезни (инсулин-независимым), так как их способность пополнять запасы хрома с пищей очень мала. Даже, если человек не болен диабетом, но у него присутствуют проблемы с обменом веществ, то он автоматически попадает в категорию риска и его состояние расценивается как диабетоподобное.
Хром в организме человека задействован во многих сферах и имеет очень важную роль, однако основная его задача заключается в поддержке нормального баланса сахара в сыворотке крови. Это происходит за счет усиления процесса обмена углеводов путем облегчения транспортировки глюкозы внутрь клетки. Данное явление носит название глюкотолерантный фактор (ГТФ). Минерал раздражает рецепторы клетки по отношению к инсулину, который легче вступает с ней в взаимодействие, при этом уменьшается его потребность для организма. Поэтому микроэлемент так жизненно важен для диабетиков, особенно со II типом болезни (инсулин-независимым), так как их способность пополнять запасы хрома с пищей очень мала. Даже, если человек не болен диабетом, но у него присутствуют проблемы с обменом веществ, то он автоматически попадает в категорию риска и его состояние расценивается как диабетоподобное.
Выходит, что положительное действие хрома проявляется во всех недугах, связанных со слабым взаимодействием организма с инсулином. Такими болезнями являются гипергликемия (гипогликемия), ожирение, гастриты, колиты, язвы, болезнь Крона, болезнь Миньера, рассеянный склероз, мигрени, эпилепсия, инсульт, гипертония.
Хром участвует в синтезе нуклеиновых кислот и тем самым поддерживает целостность структуры РНК и ДНК, которые несут информацию о генах и отвечают за наследственность.
Если у человека проявляется йододефицит и восполнить его нет возможности — хром может его заменить, что очень важно для нормального функционирования щитовидной железы, которая в свою очередь отвечает за правильный обмен веществ.

Хром снижает риск развития многих сердечнососудистых заболеваний. Как он действует? Макроэлемент принимает участие в метаболизме липидов. Он расщепляет вредный холестерин низкой плотности, который забивает сосуды, тем самым препятствуя нормальной циркуляции крови. При этом повышается содержание холестерина, который выполняет положительные функции в организме.
Повышая степень содержания стероидного гормона, минерал укрепляет кости. В связи с этим полезным свойством ним лечат остеопороз. Хром в сочетании с витамином С участвует в процессе регулирования внутриглазного давления и стимулирует транспортировку глюкозы к кристаллику глаза. Эти свойства позволяют использовать данное химическое вещество в лечебных процессах против глаукомы и катаракты.
Цинк, железо и ванадий оказывают отрицательное воздействие на попадание хрома в тело человека. Для своей транспортировки в крови он образует связь с белковым соединением трансферрином, который, в случае конкуренции хрома с вышеперечисленными элементами, выберет последнего. Поэтому в организме человека с переизбытком железа, всегда присутствует дефицит хрома, что может ухудшить состояние при диабете.
Основная его часть содержится в органах и тканях, а в крови – в десятки раз меньше. Поэтому, если в организме происходит пересыщение глюкозой, то количество макроэлемента в крови резко увеличивается за счет его передислокации из органов-накопителей.
Суточная норма
 Физиологическая потребность в минерале обусловлена возрастом и полом человека. В раннем грудном возрасте эта потребность отсутствует, так как у младенцев он накопился еще до рождения и расходуется до 1 года. Далее, для малышей в возрасте 1-2 лет эта норма составляет 11 мкг в сутки. С 3 до 11 лет — это 15 мкг/сутки. В среднем возрасте (11-14 лет) потребность увеличивается до 25 мкг/сутки, а в подростковом (14-18 лет) — до 35 мкг/сутки. Что же касается взрослого человека, тут уж отметка достигает 50 мкг/сутки.
Физиологическая потребность в минерале обусловлена возрастом и полом человека. В раннем грудном возрасте эта потребность отсутствует, так как у младенцев он накопился еще до рождения и расходуется до 1 года. Далее, для малышей в возрасте 1-2 лет эта норма составляет 11 мкг в сутки. С 3 до 11 лет — это 15 мкг/сутки. В среднем возрасте (11-14 лет) потребность увеличивается до 25 мкг/сутки, а в подростковом (14-18 лет) — до 35 мкг/сутки. Что же касается взрослого человека, тут уж отметка достигает 50 мкг/сутки.
В норме содержание хрома в организме должно быть около 6 мг. Но даже если придерживаться правильного питания, достижение нормы очень затруднительно. Только в органических соединениях идет усваивание микроэлементов, а способствуют этому процессу аминокислоты, которые находятся только в растениях. Поэтому лучшие источники этого минерала находятся в пище, в натуральных продуктах.
Если доза составляет более 200 мг, то он становится токсичен, а 3 г - смертельны.
Недостаток или дефицит хрома
Есть несколько причин возникновения недостатка минерала в организме. Из-за внедрения в почву определенных удобрений она пересыщена щелочными соединениями, что уменьшает содержание элемента в нашем рационе питания. Но даже если поступление этого минерала с продуктами полноценно, усвоение хрома будет затруднено при нарушенном обмене веществ. Также недостаток может возникнуть и по причине тяжелых физических нагрузок, в состоянии беременности, стрессовых состояниях — в случаях, когда минерал активно расходуется и необходимы дополнительные источники для его пополнения.
При нехватке микроэлемента глюкоза усваивается неэффективно, поэтому ее содержание может быть занижено (гипогликемия) или завышено (гипергликемия). Повышается уровень холестерина и сахара в крови. Это приводит к повышенной тяге к сладкому — организм требует углеводов и не только «сладких». Чрезмерное употребление углеводов ведет к еще более значительной потере хрома — замкнутый круг. В конце концов, возникают такие болезни, как избыточный вес (в случае гипогликемии — резкое похудение), сахарный диабет, атеросклероз.
Также при недостатке хрома можно наблюдать такие последствия (симптомы):

- нарушение сна, беспокойные состояния;
- головные боли;
- задержка роста;
- нарушение зрения;
- снижение чувствительности ног и рук;
- нарушается работа нервно-мышечных комплексов;
- снижается репродуктивная функция у мужского пола;
- наблюдается чрезмерная утомляемость.
При дефиците хрома, если нет возможности пополнить его запасы с приемами пищи, необходимо добавлять в свой рацион биодобавки, но перед употреблением нужно провести консультации с доктором о дозах и способах приема.
Избыток хрома - в чем его вред?
В основном переизбыток хрома в органах и тканях происходит из-за отравления на предприятиях, в технологический процесс которых входит наличие хрома и его пыли. Люди, которые работают на вредных производствах и контактируют с этим элементом, болеют раком дыхательных путей в десятки раз чаще, так как хром воздействует на хромосомы и соответственно на структуру клеток. Соединения хрома также присутствуют в шлаках и медной пыли, что проводит к астматическим болезням.

Дополнительная опасность переизбытка микроэлемента может появиться при неправильном приеме биодобавок без рекомендации врача. Если у человека наблюдается дефицит цинка или железа, то вместо них всасывается чрезмерное количество хрома.
Помимо вышеперечисленных недугов, избыто хрома может быть вреден еще и тем, что могут появиться язвы на слизистых оболочках, аллергии, экземы и дерматиты, нервные расстройства.
В каких пищевых источниках содержится?
 Из каких пищевых продуктов можно пополнить запас хрома? Самый ценный продукт в этом случае — это пивные дрожжи, причем можно употреблять и пиво, но в разумных пределах без вреда для здоровья. Также богаты на этот микроэлемент печень, орехи, морепродукты, проросшие зерна пшеницы, арахисовое масло, перловка, ячмень, говядина, яйца, сыр, грибы, хлеб из муки грубого помола. Из овощей выделяют капуста, репчатый лук, редис, бобовые, зеленый горошек, помидоры, кукуруза, ревень, свекла, а из фруктов и ягод — это рябина, яблоки, голубика, виноград, черника, облепиха. Заваривая чайки из лекарственных растений (сушеницы, мелиссы), можно тоже подзарядиться хромом.
Из каких пищевых продуктов можно пополнить запас хрома? Самый ценный продукт в этом случае — это пивные дрожжи, причем можно употреблять и пиво, но в разумных пределах без вреда для здоровья. Также богаты на этот микроэлемент печень, орехи, морепродукты, проросшие зерна пшеницы, арахисовое масло, перловка, ячмень, говядина, яйца, сыр, грибы, хлеб из муки грубого помола. Из овощей выделяют капуста, репчатый лук, редис, бобовые, зеленый горошек, помидоры, кукуруза, ревень, свекла, а из фруктов и ягод — это рябина, яблоки, голубика, виноград, черника, облепиха. Заваривая чайки из лекарственных растений (сушеницы, мелиссы), можно тоже подзарядиться хромом.
Бедны на этот микроэлемент высокоочищенные продукты: сахар, макароны, мука тонкого помола, кукурузные хлопья, молоко, масло, маргарин. Вообще, пища с большим содержанием жиров всегда беднее на микроэлементы, чем пища с пониженным их содержанием. И еще, в продуктах хром сохранится лучше, если приготовлены они были в посуде из нержавеющей стали.
Показания к применению препаратов хрома
Хром (препараты с хромом) назначают как для профилактики, так и для лечения внутренних болезней:
- нарушение обмена веществ: сахарный диабет, ожирение;
- заболевания кишечника;
- болезни печени и сопутствующих ей органов;
- сердечно сосудистая патология;
- воспалительные процессы в мочевыводящих путях и заболевания почек;
- аллергические состояния, сопровождающиеся дисбактериозом;
- различные формы иммунодефицита.
Также хром назначается в соответствии со следующими показаниями:
- для профилактики болезней сердца и онкологических предрасположенностей;
- для защиты от болезни Паркинсона и при депрессии;
- как вспомогательное средство при похудении;
- для укрепления иммунной системы;
- для устранения негативных последствий воздействия окружающей среды;
- при состояниях, сопровождающихся повышенным потреблением хрома (беременность, лактация, период роста и полового созревания, тяжелые физические нагрузки).
xcook.info
Химические свойства
«Национальный исследовательский Томский политехнический Университет»

Институт природных ресурсов Геоэкология и геохимия
РЕФЕРАТ
Хром
по дисциплине:
Химия
Выполнил:
студент группы 2Г41 Ткачева Анастасия Владимировна 29.10.2014
Проверил:
преподаватель Стась Николай Федорович
Томск 2014
Положение в периодической системе
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Строение атома
+17 Cl )2 )8 )7 - схема строения атома
1s 2s
2s 2p
2p 3s
3s 3p
3p - электронная формула
- электронная формула
Атом располагается в III периоде, и имеет три энергетических уровня
Атом располагается в VII в группе, в главной подгруппе – на внешнем энергетическом уровне 7 электронов
Свойства элемента
Физические свойства
Хром - белый блестящий металл с кубической объемно-центрированной решеткой, а = 0,28845 нм, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану), с температурой плавления 1903 град. И с температурой кипения около 2570 град. С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода к хрому еще больше увеличивает его твердость.
Хром при обычных условиях – инертный металл, при нагревании становится довольно активным.
Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3.
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3.
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN
или 4Cr + N2 = 2Cr2N.
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3.
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
С водородом непосредственно не взаимодействует.
Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
2Cr + 3h3O = Cr2O3 + 3h3
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + h3;
Cr + h3SO4 = CrSO4 + h3.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O.
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O.
Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3h3.
Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O.
Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Свойства простого вещества
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr
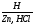 →2Cr
→2Cr
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(h3O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12h3O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr +3NH
+3NH +3h3O→Cr(OH)
+3h3O→Cr(OH) ↓+3NH
↓+3NH

Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr +3OH
+3OH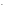 →Cr(OH)
→Cr(OH) ↓
↓
Cr(OH) +3OH
+3OH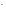 →[Cr(OH)
→[Cr(OH) ]
]
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na [Cr(OH)
[Cr(OH) ]+3H
]+3H O
O →2Na
→2Na CrO
CrO +2NaOH+8H
+2NaOH+8H O
O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O
Соединения хрома (+4)[
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетикоми обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая h3CrO4 и двухромовая h3Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую h3CrO4, дихромовую h3Cr2O7 и другие изополикислоты с общей формулой h3CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO
 +2H
+2H →Cr2O
→Cr2O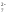 +h3O
+h3O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
Cr2O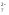 +2OH
+2OH →2CrO
→2CrO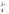 +H
+H O
O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba +CrO
+CrO →BaCrO
→BaCrO ↓
↓
2Ba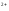 +Cr
+Cr O
O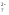 +h3O→2BaCrO
+h3O→2BaCrO ↓+2H
↓+2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
studfiles.net
Элемент хром | Дистанционные уроки
06-Ноя-2012 | комментариев 5 | Лолита Окольнова
За счет большого количества валентных электронов образует большое количество окрашенных соединений.
Электронное строение атома

Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:2Сr + 3F2 = 2CrF34Cr + 3O2 = 2Cr2O3
- Взаимодействие с водой (при нагревании):2Cr + 3h3O = Cr2O3 + 3h3
- Взаимодействие с кислотами— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + h3
Оксиды хрома
СrO — оксид хрома (II), (черного цвета) — основной оксид.
Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(Oh4).
СrO + 2HCl = CrCl2 + h3O (cоли — голубого цвета)
Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 + 2NaOH = 2NaCrO2 + h3O
Cr2O3 + 6HCl = 2CrCl3 + 3h3OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Соли Cr(3+) — зеленого цвета
СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и h3Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
CrO4(2-) — хроматы — желтого цвета
Сr2O7(2-) — бихроматы — оранжевого цвета
В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:

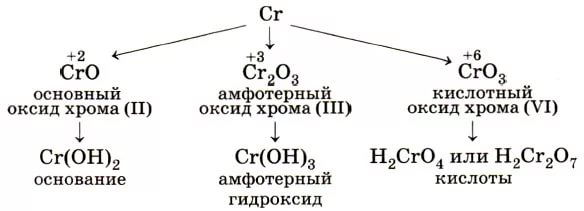
Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:

Отсюда, кстати, и название элемента: «хром» — это «цвет»!
У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Категории: |
Обсуждение: "Элемент Хром"
(Правила комментирования)distant-lessons.ru











