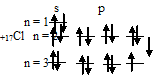Open Library - открытая библиотека учебной информации. Для кристаллической решетки хрома определите координационное число
3 вариант | Выполнение контрольных работ, рефератов, курсовых, чертежей на заказ в Ростове-на-Дону
1. Для кристаллической решетки хрома определите координационное число и рассчитайте коэффициент укладки. Покажите и определите индексы кристаллографических плоскостей и направлений легкого скольжения в решетке.
Хром – Cr имеет кубическую объемноцентрированную решетку (ОЦК).
Под координационным числом понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. В ОЦК решетке на этом расстоянии находятся 8 соседей (К8).
Коэффициентом укладки называют плотность упаковки атомов в объеме кристаллической решетки.
2. Дайте определение твердости. Какими методами измеряют твердость металлов и сплавов? Опишите их.
Твердость – это сопротивление материала проникновению в его поверхность стандартного тела (индентора), не деформирующегося при испытании.
Широкое распространение объясняется тем, что не требуются специальные образцы.
Это неразрушающий метод контроля. Основной метод оценки качества термической обработке изделия. О твердости судят либо по глубине проникновения индентора (метод Роквелла), либо по величине отпечатка от вдавливания (методы Бринелля, Виккерса, микротвердости).
3. Вычертите диаграмму состояния железо — карбид железа, укажите структурные составляющие во всех областях диаграммы, опишите процессы кристаллизации и превращений в твердом состоянии для сплава, содержащего 2,2 % С, напишите для этих процессов фазовые реакции с указанием составов реагирующих фаз и температурных интервалов превращений, изобразите схему кривой охлаждения заданного сплава и обоснуйте ее вид с применением правила фаз. Какова структура этого, сплава при комнатной температуре и как такой сплав называется?
Первичная кристаллизация сплавов системы железо-углерод начинается по достижении температур, соответствующих линии ABCD (линии ликвидус), и заканчивается при температурах, образующих линию AHJECF (линию солидус).
При кристаллизации сплавов по линии АВ из жидкого раствора выделяются кристаллы твердого раствора углерода в α-железе (δ-раствор). Процесс кристаллизации сплавов с содержанием углерода до 0,1 % заканчивается по линии АН с образованием α (δ)-твердого раствора. На линии HJB протекает перитектическое превращение, в результате которого образуется твердый раствор углерода в γ-железе, т. е. аустенит.
4. Вычертите диаграмму изотермического превращения аустенита для стали У8. Нанесите на нее кривую режима изотермической обработки, обеспечивающей получение твердости 150 НВ. Укажите, как этот режим называется, и какая структура получается в данном случае.
Изотермической обработкой, достаточной для получения твердости НВ = 150 для стали У8, является изотермический отжиг (рисунок 5). Структура после отжига – крупнопластинчатый перлит. При изотермическом отжиге сталь У8 нагревают до температуры на 30-50°С выше точки Ас1 (Ас1 = 730°С) и после выдержки охлаждают до температуры 650-680°С. Структура после отжига – крупнопластинчатый перлит.
5. С помощью диаграммы состояния железо — цементит обоснуйте выбор режима термической обработки, применяемой для устранения цементитной сетки в заэвтектодной стали. Дайте определение выбранного режима обработки и опишите превращения, которые происходят при нагреве и охлаждении.
Для устранения грубой сетки вторичного цементита заэвтектоидные стали подвергают нормализации.
Нормализацией называется нагрев доэвтектоидной стали до температуры выше Ас3, а заэвтектоидной – выше Аcm на 40-50°С с последующим охлаждением на воздухе.
6. Назначьте температуру закалки, охлаждающую среду и температуру отпуска деталей машин из стали 40Х, которые должны иметь твердость 28…35 HRС. Опишите сущность происходящих превращений при термической обработке, микроструктуру и свойства.
Сталь 40Х — конструкционная легированная сталь. Ее химический состав указан в таблице 2.
Температура точки Ас3 для стали 40Х составляет 815°С, а Ас1 равна 743°С. Структура доэвтектоидной стали при нагреве её до критической точки Ас1 состоит из зерен перлита и феррита. В точке Ас1 происходит превращение перлита в мелкозернистый аустенит.
7. Для изготовления разверток выбрана сталь ХВСГ. Укажите состав и определите группу стали по назначению. Назначьте и обоснуйте режим термической обработки. Опишите микроструктуру и свойства разверток после термической обработки.
Сталь ХВСГ – инструментальная легированная сталь повышенной прокаливаемости. Ее химический состав и термическая обработка указаны в таблице 4.
8. В котлостроении используется сталь 12Х1МФ. Укажите состав и группу стали по назначению. Назначьте режим термической обработки, приведите его обоснование и опишите структуру стали после термической обработки. Как влияет температура эксплуатации на механические свойства данной стали?
Сталь 12Х1МФ -Конструкционная жаропрочная сталь. Ее химический состав и механические свойства указаны в таблице 4.
student-help.net
МАТЕРИАЛОВЕДИНИЕ!!!!!!!!!!!!!!!!!!!!!!!!!!!
Вопрос первый:
Для кристаллической решетки платины определите координатное число и рассчитайте коэффициент укладки.
гранецентрированная кубическая (ГЦК)
a=b=c ===900
У ГЦК-решетки элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум.
Под координационным числом понимается количество ближайших соседей данного атома.
На рисунке в ГЦК решетке атом А (на грани куба) находится на наиболее близком равном расстоянии от четырех атомов 1, 2, 3, 4, расположенных в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, и, кроме того, от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, координатное число для кристаллической решетки платины равно 12 (К12), а коэффициент укладки – 0,74 , рассчитанный по формуле =
Используя решетку платины как модель, объясните физическую природу анизотропии.
Под анизотропией понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
На плоскостях, проходящих через грани ГЦК-решетки, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Вопрос второй:
Определите модуль вектор Бюргерса винтовой дислокации, образованной сдвигом в направлении пространственной диагонали примитивной кубической решетки с параметром «а».
Винтовую дислокацию можно определить как сдвиг одной части кристалла относительно другой.
Вектор Бюргерса – это число параметров решетки по разные стороны дислокации (вектор – в). У винтовой дислокации вектор Бюргерса равен межатомному расстоянию и параллелен дислокационной линии.
Вектор Бюргерса винтовой дислокации, образованной сдвигом в направлении пространственной диагонали примитивной кубической решетки с параметром «а» будет равен, а, по формуле │ │=
Для ряда таких дислокаций, расположенных с шагом 8а и образующих малоугловую границу кручения вычислите угол разориентировки соседних решеток, объясните, может ли данная граница быть границей субзерен.
Дислокационное строение малоугловой границы.
По формуле D = , рассчитаем - угол разориентировки соседних решеток, 12,404948градусов.
Исследования строение металлов показали, что зерна в поликристаллах не являются монолитными, совершенными монокрискалами, а состоят из отдельных, так называемых субзерен (блоков), повернутых одно относительно другого на малый угол. Границы субзерен и зерен в металлах принято разделять на малоугловые ( угол разориентировки менее 50) и большеугловые (более 50). Малоугловые границы наблюдаются, как правило, между субзернами и имеют дислокационное строение.
3
studfiles.net
Координационное число н структура кристаллическая
Координационное число металла при образовании ОЦК решетки равно восьми. Такая решетка, как уже говорилось, свойственна, например, металлическому натрию, железу при температуре до 911 °С. Атом натрия имеет один электрон на внешней электронной оболочке, с помощью которого он образует металлическую связь с другими атомами. В то же время остальные его валентные орбитали являются вакантными. Избыток числа орбиталей над числом электронов приводит к образованию такой структуры, когда каждый атом натрия создает у себя устойчивую восьми-электронную оболочку благородных газов, отстоящих как слева (N6), так и справа (Аг) от натрия в периодической системе. Это достигается при количестве ближайших атомов в кристаллической решетке (координационном числе) равном восьми. Аналогично, атом хрома в основном [c.320] В кристаллическом же состоянии электрические моменты диполей отдельных связей (даже если они и существуют) взаимно скомпенсированы и суммарный собственный электрический момент диполя в кристалле равен нулю. Поэтому исследования поляризационных явлений в кристаллах дают мало информации о направленности связей и структуре. Однако и в кристаллическом состоянии эта направленность существует, что особенно ярко проявляется в кристаллах с преимущественно ковалентной связью (кремний, германий, 1пР, 2п5 и т. п.). Связи в таких кристаллах направлены к вершинам тетраэдра (см. рис. 3 и 4), поэтому подобные вещества часто называют тетраэдрическими фазами. Жесткая пространственная направленность ковалентных связей предопределяет образование рыхлых кристаллических структур с низкими координационными числами (как правило, не выше четырех). Для солеобразных и металлических кристаллов, в которых доминирует, соответственно, ионная и металлическая составляющая связи, характерны плотные и плотнейшие упаковки с координационными числами 6—8 для ионных и 8—12 для металлических решеток. Здесь значительную роль играют размеры взаимодействующих атомов, которые и определяют координационное число в кристаллических решетках. Однако при этом сохраняется определенная направленность химической связи, что проявляется в пространственной периодичности строения кристаллов. На существование электронных мостиков между взаимодействующими атомами указывают [c.82]Для большинства неорганических кристаллических веществ характерно полимерное строение Молекулярные решетки встречаются чрезвычайно редко, что было установлено уже в первых рентгеноструктурных исследованиях. Тогда же было показано, что координационное число элементов кристаллической решетки, как правило, больше числа его обычной валентности (степени окисления), что позволяет рассматривать неорганические полимерные соединения как комплексные. Комплексные составляющие таких неорганических полимеров можно условно выделить на основании анализа кристаллической структуры. [c.671]
На рис. 14-10 показаны кристаллические структуры нескольких типов ионных кристаллов. Хлорид цезия кристаллизуется в структуру, в которой и катион, и анион имеют координационное число 8. Сульфид цинка образует кристаллы в одной из двух структур-так называемой структуре цинковой обманки и структуре вюртцита, в которых у катиона и аниона координационное число 4. Фторид кальция кристаллизуется в так называемой структуре флюорита, где катион имеет координационное число 8 (каждый ион кальция окружен восемью фторид-ионами), а анион-4. Одной из кристаллических форм диоксида титана является структура рутила, в которой координационные числа для катиона и аниона разны соответственно 6 и 3. [c.609]
На этом основании было сформулировано кристаллохимическое правило Юм-Розери, согласно которому координационное число в кристаллических структурах простых веществ, расположенных справа от границы Цинтля, равно % — М, где Л —номер группы Периодической системы. Для элементов У1А-группы (8, 8е, Те), у которых до октета недостает двух электронов, структурными элементами в кристаллах простых веществ являются линейные зигзагообразные цепочки (или замкнутые кольца) с к.ч. 2, которые между собой связаны слабыми силами Ван-дер-Ваальса. При этом расстояния между ближайшими соседями в пределах одной цепочки также значительно меньше, чем между цепочками [c.242]
Величины эффективных радиусов зависят от типа связи и довольно резко меняются при его изменении. В пределах одного типа связи на величину эффективного радиуса частицы влияют координационное число, структура решетки и химическая природа частиц. Исходя из максимально плотной упаковки, отрицательные ионы, имеющие большие размеры, чем положительные, должны возможно теснее группироваться вокруг последних. Число, показывающее, сколько атомов или ионов окружают каждый данный атом или ион в кристалле, называется координационным числом. Координационные числа разных веществ могут быть равны 2, 3, 4, 5, 6, 8 и 12. Встречаются кристаллические решетки (у некоторых металлов) с координационным числом 14. [c.146]
На примере а-Мп можно убедиться в том, что равноценность всех атомов в кристаллической структуре простого вещества не обязательна. В самом деле, 58 атомов Мп, приходящихся на одну ячейку, распадаются на четыре группы, или четыре сорта по 2, 8, 24 и 24 атома. Никакими симметрическими преобразованиями нельзя совместить атомы одного сорта с атомами других сортов. Это обстоятельство позволяет предполагать, что электронное состояние у этих атомов тоже различное. Как ни своеобразен структурный тип а-Мп, все же видно большое сходство его с нормальным и структурами металлов та же высокая симметрия (кубическая), те же большие координационные числа. Структура а-Мп имеет усложненный структурный тип объемноцентрированной кубической решетки. [c.255]
Как видно, вычисление ионности связи в кристаллах по формулам (2.78) и (2.80) не составляет большого труда, однако требует известных навыков и знания кристаллической структуры рассматриваемого соединения. Поэтому для удобства читателя мы произвели соответствующие расчеты пол и крист для наиболее распространенных и часто используемых в физико-химической практике кристаллических веществ, результаты которых приведены соответственно в табл. П и П1 приложения. Во всех случаях вычисления производились до третьего десятичного знака и округлялись до второго. Координационные числа всех кристаллических соединений брались [c.111]
Так как координационные числа атомов в кристаллических решетках металлов высоки, а внешних валентных электронов мало, орбитали атомов щелочных элементов представлены всего одним электроном (Li — ls 2s Na — ls 2s 2p 3s и т. д.), и применение метода ВС при рассмотрении структуры металлов встречает огромные трудности. [c.121]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Для некоторых металлов характерна иная кристаллическая решетка, а именно кубическая объемноцентрированная. Такую структуру, в частности, имеют щелочные металлы (см. рис. 1.73). Координационное число в этом случае равно 8. [c.157]
Крупные многозарядные ионы редкоземельных элементов в кристаллах сложных оксидов приводят к высоким (8 и более) координационным числам лантаноидов. Это в свою очередь обусловливает уникальные возможности стабилизации сложных кристаллических структур и аномально высоких степеней окисления других металлических компонентов, например меди -[- 3. Не случайно, что именно на основе лантаноидов и иттрия создана высокотемпературная сверхпроводящая оксидная керамика. [c.153]
Строение остова отражается структурной формулой соответствующего соединения, которая устанавливается методами химического анализа, синтеза и путем всестороннего исследования свойств вещества. Исходя из структурной формулы, т. е. химического строения, по данным, характеризующим распределение электронной плотности по объему вещества, получаемым методом рентгеноструктурного анализа из интенсивности дифракционных лучей, может быть построена атомная модель любого кристаллического вещества. Как мы отмечали выше, по экспериментальным кривым углового распределения интенсивности можно также определять межатомные расстояния и координационные числа в структуре аморфных веществ. Этим путем, к сожалению, нельзя получать углы между связями, но они могут быть рассчитаны квантовомеханическими методами. Таким образом, оперируя экспериментальными и расчетными данными, можно построить атомарную модель твердого вещества как кристаллического, так и непериодического строения. Особенно интересно создание подобной модели для аморфных веществ, поскольку их структура ре может быть выражена кристаллической решеткой. Построение их модели облегчается наличием остова. [c.163]
Приведены значения металлических радиусов атомов (нм), найденные путем деления пополам кратчайших межатомных расстояний в кристаллических структурах простых веществ с координационным числом 12. При других значениях координационного числа учитывается необходимая поправка. В скобках указаны ковалентные радиусы. [c.209]
Здесь и в последующих таблицах части III книги приведены значения атомных радиусов, полученные путем деления на 2 межатомных расстояний в кристаллических структурах с координационным числом 12. [c.382]
Элементарная ячейка — наименьший объем кристаллической решетки, с помощью которой можно построить (мысленно) всю структуру кристалла путем последовательного приложения таких ячеек друг к другу в трех пространственных направлениях, т. е. путем параллельного переноса (трансляции) ячейки в трех направлениях (рис. 4.2). Для описания кристаллической решетки достаточно знать расположение частиц в элементарной ячейке, которое характеризуется ее параметрами. Параметры элементарной ячейки включают длины ее ребер — периоды идентичности, или периоды решетки, а, Ь, с и углы между ребрами, а, 7. Число частиц, непосредственно окружающих данную частицу в кристаллической решетке и расположенных на ближайших и одинаковых расстояниях от центральной частицы, — это ее координационное число. [c.159]
Иодид серебра. Исследование иодида серебра при температурах от 30 до 210 °С и при давлениях до 700 МПа рентгенографическим способом дало возможность построить фазовую диаграмму этого вещества (рис. 43). Как видно, в этих пределах давлений и температур Agi существует в трех кристаллических модификациях. При комнатных температурах и давлениях менее 300 МПа иодид серебра Agi II имеет структуру типа ZnS С координационным числом 4. При увеличении давления до 355 МПа происходит обратимый переход Agi II в Agi III. [c.155]
Бернал и Фаулер (Англия), впервые проделавшие тщательное рентгеноструктурное исследование воды, установили в 1933 г., что и воде остаются фрагменты структуры льда — кристаллические островки (см. стр. 278) для воды это явление выражено более резко, чем для большинства других жидкостей. Для большей части молекул в жидкой воде сохраняется тетраэдрическое окружение, которое они имели в структуре льда среднее координационное число молекул в жидкой воде близко к четырем — при 2, 30 и 83° С оно равно соответственно 4,4 4,6 и 4,9. Большая часть водородных связей, соединяющих молекулы Н О в решетке льда, сохраняется и в воде доля разорванных водородных связей при О, 25, 60 и 100° С составляет соответственно 9, 11, 16 и 20%. [c.279]
Координационное число Тип кристаллической структуры и ее характерные (аойства [c.607]
Изменения плотности, электропроводности и других физических свойств при плавлении показывают, что расплавы многих из этих элементов обладают более металлическим характером и их структуры имеют более высокие координационные числа, чем кристаллические модификации, устойчивые ниже точки плавления [5]. Изменение удельной электропроводности при плавлении показано на рис. 109. Значения энтропии плавления для них также гораздо выше, чем для истинных металлов, что указывает на отчетливо выраженное изменение структуры при плавлении [11]. Однако изменение структуры не заканчивается при температуре, немного превышающей точку плавления. Температурная зависимость атомного объе ма, электропроводности и магнитных свойств мышьяка показывает, что хотя структурный переход в значительной степени н происходит в интервале между точкой плавления (818°) и 850°, он не завершается даже при 1000°. Более легко этот переход происходит в случае 5Ь и В1. Исследование структуры расплавленных 51 и Ое методом дифракции рентгеновских лучей свидетельствует, что углы между связями не отклоняются от тетраэдрического столь сильно, как в белом олове. Таким образом, на структуру расплава в большей или меньшей степени влияют направленные ковалентные связи, ответственные за сетчатое или высокополимерное строение кристаллических модификаций. [c.262]
В[c.311]
Минералы силлиманитовой группы и муллит. Минералы группы силлиманита имеют общую формулу АЬОз- Si02 и включают кианит (дистен), андалузит и силлиманит. Для структуры этих минералов характерно наличие цепочек (параллельных оси с) из октаэдров [AI06] , однако расположение цепочек в элементарных ячейках может быть различным. Соседние октаэдры соединены через общее ребро, соединяющее два иона 0 -. Цепочки с четырех сторон соединены островными тетраэдрами [8104]чередующимися с полиэдрами [АЮт], равными у всех минералов. Алюминий в кристаллической структуре силлиманита имеет координационное число 4 и 6, в андалузите— 5 и 6, в дистене —только 6, следовательно, структура дистена наиболее плотная. [c.142]
Возможные типы регулярных укладок подробно исследовали в связи с их аналогией упорядоченному расположению атомов или ионов в кристаллической решетке [5]. Так, 71,ля простой кубической укладки координационное число Nk=.Q (4 соседа в горизонтальной плоскости и по одному сверху и снизу) порозность е = 0,476 расстояние между параллельными плоскостями, проходящими через центры шаров, равно d максимальный просвет (живое сечение) в плоскости соприкосновения шаров соседних рядов ()max = 1, а минимальный — в плоскости, проходящей через их центры, — tfmin = 0,214. При максимально плотной гексагональной упаковке Nk = 12 (6 соседей в вершинах правильного шестиугольника в горизонтальной плоскости и по три сверху и снизу в промежутках между шарами этой плоскости) порозность е = 0,2595 расстояние между соседними плоскостями 0,707 просветы ifmax = 0,349 и ifmin = 0,214. Возможны и другие упорядоченные структуры с промежуточными значениями е и четными координационными числами А/к = 8, 10 и 12. Комбинированные расположения соседних плоскостей могут давать упорядоченные упаковки с промежуточными, нечетными значениями iVk = 5, 7, 9 и 11. При более рыхлых расположениях без непосредственного контакта шаров одного горизонтального ряда возможна, например, упаковка типа кристаллической решетки алмаза [6] с Л/ к = 4 и s = 0,66. [c.8]
Ионные кристаллы состоят из бесконечных рядов чередующихся положительных и отрицательных ионов, удерживаемых вместе электростатическими силами. Эти силы ничем не отличаются от тех, которые обеспечивают устойчивость молекулы Na l в паровой фазе. В твердом Na l ионы Na " и l расположены таким образом, чтобы между ними обеспечивалось максимальное электростатическое притяжение, и это обусловливает кристаллическую структуру, показанную на рис. 14-9. В кристалле Na l каждый ион Na имеет координационное число 6 и каждый ион С1 точно так же окружен шестью ионами Na . Ионные связи обладают боль- [c.607]
Кристаллические решетки, которые образуют металлы, называются металлическими. В узлах их находятся положительные попы металлов, а свободные валентные электроны осуществляют иелокализованную химическую связь. Для металлических решеток, как указывалось (см. 5.6), характерны высокие координационные числа большинство металлов кристаллизуется в структурах плотнейших упаковок — гексагональной и гранецентрированной кубической решеток с координационным числом 12, кубической объемно центрированной с координационным числом 8 (рис. 5.14 и 5.18). [c.134]
Координационными или комплексными называют соединения, содержащие центральный атом или ион и группу молекул или ионов, его окружающих и связанных с ним (лигандов). Число лигандов, связанных с центральным атомом (ионом), называют координационным числом иона. Оно зависит как от электронной структуры, так и от соотношения между радиусами центрального атома (иона) и лигандов. Координационное число центрального атома (иона) обычно превышает его валентность, понимаемую как формальный положительный заряд на атоме. Высокая устойчивость многих комплексных соединений указываает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях. В большинстве координационных соединений центром является ион переходного металла (Т , Со , Сг " и др.), а лигандами — ионы или полярные молекулы (обладающие к тому же неподеленной парой электронов.) Именно поэтому электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей также квантовомеханические особенности строения электронной оболочки центрального иона (Бете, Ван Флек). [c.120]
Бернал и Фаулер в результате реитгеноструктурного исследования воды установили, что в ней остаются группировки молекул, сходные со структурой льда. Для большей части молекул в жидкой воде сохраняется тетраэдрическое окружение, которое они имели в структуре льда среднее координационное число молекул в жидкой воде близко к четырем. Наличие элементов кристаллической структуры у воды, а также большого дипольного момента у ее молекул обусловливает высокое значение диэлектрической проницаемости воды при 25° С она равна 79,5. Это означает, что взаимодействие между заряженными частицами в водной среде почти в 80 раз слабее, чем в вакууме. [c.81]
Замечательно, что различные структурообразующие факторы не только сосуществуют, но и дополняют друг друга. При их разных сочетаниях осуществляется либо кристаллизация с различной плотностью укладки структурных единиц, либо более сложный процесс, который можно называть в отличие от кристаллизации структурообразованием, приводящий к образованию невообразимого множества однотипных, но все же различных индивидуальных структур, о которых говорилось выше. Таким примером снижения плотности укладки малых нульмерных структурных единиц в результате вмещательства ковалентной составляющей связи является образование сравнительно неплотных кристаллических структур щелочных металлов и металлов IV В — VI В групп, а также железа, для которых координационное число равно всего восьми. [c.160]
Соединения Э (П1) — чаще всего белые кристаллические вещества. Их структура характеризуется высокими координационными числами Э. Так, координационное число Ьа (ПЛ) в кристаллах ЬаС1з и Ьа(ОН)з равно 9, а в кристаллах ЬзгЗз и ЬаЫ 8. [c.546]
Кристаллические решетки металлов имеют высокие координационные числа атомов (ионов), которые определяются числом ближайших соседей, окружающих данный атом (см. 9.1). Большинство металлов кристаллизуются в структурах плотнейших упаковок — гексагональной (Mg, Ве, d, Zn и др.) или гранецентрированной кубической (Си, Ag, Au, Al, Ni и др.). Такие структуры характерны для кристаллов, образованных сферическими частицами одинакового размера (рис. 5.11), координационное число для них равно 12, степень заполнения пространства составляет74%. Щелочные металлы, а также V, Сг, W и другие имеют кубическую объемно центрированную решетку, координационное число равно 8. Атомам металлов свойственны небольшие энергии ионизации, наименьшие для атомов щелочных металлов, и положительные степени окисления (см. 4.5). [c.121]
Другие важные свойства металлов связаны с особенностями их структуры. В трех главных структурных типах металлов реализуются весьма высокие координационные числа (разд. 1.5). В кристаллических решетках кубической и гексагональной плотнейших упаковок каждый атом металла окружен 12 ближайшими соседями. В то же время в кубической объемно-центриро-ванной решетке число ближайших соседей равно восьми, но можно считать дополнительно координированными еще шесть [c.360]
Структура кристаллических модификаций 2 a0-S102 характеризуется наличием изолированных тетраэдров [SIO4] . Но координационное число ионов кальция по кислороду в различных формах меняется от 6 до 10. [c.107]
По результатам магнитных измерений можно подтвердить или опровергнуть приписываемую веществу структуру. Так, для двухвалентного никеля характерно координационное число четыре, проявляемое в тетраэдрической и плоско-квадратной кристаллической структурах. При координационном числе четыре вокруг комплексообразователя расположены четыре лиганда, которые, будучи донорами, предоставляют четыре пары электронов. При образовании тетраэдрической структуры эти электроны должны находиться в состоянии хр -гибрндизации, а при образовании плоской квадратной — в состоянии с1зр -гиб-ридизации. На рис. 4.21, а представлено распределение электронов по уровням и подуровням в изолированном атоме никеля. При образовании иона N1 + атом теряет два 45-электрона [c.197]
Возможность образования и устойчивость той или иной кристаллической структуры зависят от температурных условий (и давления). Чем ниже температура, тем более вероятны плотная упаковка ионов и высокое координационное число, и. наобо()от, при высокой температуре предпочтительнее им кое координационное число. Это в значительной ме )е влияеп нп направление превращения и его механизм. Рассмотрим слсд ю щий п )имер. [c.228]
Кристаллическая структура ковалентных твердых тел полностью определяется природой связей. Координационное число многих известных ковалентных кристаллов равно четырем. Это значит, что каждый атом в кристалле образует четыре направленные ксваленткые связи. Направленность связи иск. ючает плотнейшую упаковку кристалла. Примером кристаллической решетки с ковалентными связями служит решетка алмаза (рис. 33). [c.77]
Характерной чертой строения силикатов является воможность замещения в кристаллической структуре ионов кремния несколько большими по размеру ионами алюминия. Отношение Гк Г для алюминия, как отмечалось, составляет 0,415, т. е. является пограничным. Поэтому координационное число алюминия может быть как 4, так и 6. Алюминий с координационным числом 4 может входить в кремнекислородный мотив. Алюминий с координационным числом 6 выполняет роль катиона. Эта двойственность алюминия, установленная еще В. И. Вернадским, затрудняет изучение силикатов и алюмосиликатов. [c.29]
chem21.info
Кристаллические координационное число - Справочник химика 21
Соединения бериллия (II). Большинство неорганических соединений бериллия (П) в обычных условиях полимерны и являются кристаллическими веществами белого цвета. Независимо от типа кристаллических решеток соединений координационное число бериллия 4. [c.471]Координационное число металла при образовании ОЦК решетки равно восьми. Такая решетка, как уже говорилось, свойственна, например, металлическому натрию, железу при температуре до 911 °С. Атом натрия имеет один электрон на внешней электронной оболочке, с помощью которого он образует металлическую связь с другими атомами. В то же время остальные его валентные орбитали являются вакантными. Избыток числа орбиталей над числом электронов приводит к образованию такой структуры, когда каждый атом натрия создает у себя устойчивую восьми-электронную оболочку благородных газов, отстоящих как слева (N6), так и справа (Аг) от натрия в периодической системе. Это достигается при количестве ближайших атомов в кристаллической решетке (координационном числе) равном восьми. Аналогично, атом хрома в основном [c.320]
Ионная кристаллическая решетка содержит в своих узлах ионы чередующихся зарядов противоположного знака. Связь между ионами не имеет специфической направленности и обусловлена электростатическими взаимодействиями. Каждый ион контактирует с несколькими ионами противоположного заряда, в связи с чем в ионном кристалле отдельные молекулы не могут быть выделены. Число ионов, скоординированных около данного иона, называется координационным числом оно зависит как от соотношения значений зарядов, так и ог соотношения размеров ионов, составляющих кристаллическую решетку. Так, например, в хорошо известной структуре хлорида натрия (рис. 10) ионы натрия и хлорид-ионы закономерно чередуются вдоль трех взаимно перпендикулярных направлений, так что координационное число каждого нз них равно 6. Ионная кристаллическая решетка присуща различным солям. Ионным кристаллам свойственны значительная твердость, сравнительно небольшая летучесть и довольно высокие температуры плавления. [c.70]Представление о движении узлов кристаллической решетки в жидкостях приводит I выводу о наличии флуктуаций значений координационных чисел, характери-зуюш,их как собственно решетку, так и сольватную оболочку данной молекулы. По данным работ [91 и [10], отклонения в значениях первого координационного числа достигает 25—30%, а второго 45— 50%. Очевидно, что при отклонениях >50% понятие координационного числа теряет смысл. Соответственно теряет смысл и представление о сольватирующем слое выше второго. Функция распределения первых координационных чисел для воды представлена на рис. 2.4, из которого следует, что [c.30]
На рис. 14-10 показаны кристаллические структуры нескольких типов ионных кристаллов. Хлорид цезия кристаллизуется в структуру, в которой и катион, и анион имеют координационное число 8. Сульфид цинка образует кристаллы в одной из двух структур-так называемой структуре цинковой обманки и структуре вюртцита, в которых у катиона и аниона координационное число 4. Фторид кальция кристаллизуется в так называемой структуре флюорита, где катион имеет координационное число 8 (каждый ион кальция окружен восемью фторид-ионами), а анион-4. Одной из кристаллических форм диоксида титана является структура рутила, в которой координационные числа для катиона и аниона разны соответственно 6 и 3. [c.609]
Сущность изоморфизма заключается в том, что ионы, имеющие одинаковое координационное число и близкие радиусы, могут замещать друг друга в кристаллической решетке, не нарушая ее [c.115]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Главное влияние на физические свойства металлов оказывает электронное строение атомов элемента и строение кристаллической решетки металла. Важными характеристиками кристаллической решетки являются ее симметрия и координационное число металла. Кристаллические решетки металлов бывают различной симметрии, но наиболее часто встречаются объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и плотнейшая гексагональная (Г) кристаллическая решетка (рис. 11.1). [c.319]
Крупные многозарядные ионы редкоземельных элементов в кристаллах сложных оксидов приводят к высоким (8 и более) координационным числам лантаноидов. Это в свою очередь обусловливает уникальные возможности стабилизации сложных кристаллических структур и аномально высоких степеней окисления других металлических компонентов, например меди -[- 3. Не случайно, что именно на основе лантаноидов и иттрия создана высокотемпературная сверхпроводящая оксидная керамика. [c.153]
Строение остова отражается структурной формулой соответствующего соединения, которая устанавливается методами химического анализа, синтеза и путем всестороннего исследования свойств вещества. Исходя из структурной формулы, т. е. химического строения, по данным, характеризующим распределение электронной плотности по объему вещества, получаемым методом рентгеноструктурного анализа из интенсивности дифракционных лучей, может быть построена атомная модель любого кристаллического вещества. Как мы отмечали выше, по экспериментальным кривым углового распределения интенсивности можно также определять межатомные расстояния и координационные числа в структуре аморфных веществ. Этим путем, к сожалению, нельзя получать углы между связями, но они могут быть рассчитаны квантовомеханическими методами. Таким образом, оперируя экспериментальными и расчетными данными, можно построить атомарную модель твердого вещества как кристаллического, так и непериодического строения. Особенно интересно создание подобной модели для аморфных веществ, поскольку их структура ре может быть выражена кристаллической решеткой. Построение их модели облегчается наличием остова. [c.163]
Приведены значения металлических радиусов атомов (нм), найденные путем деления пополам кратчайших межатомных расстояний в кристаллических структурах простых веществ с координационным числом 12. При других значениях координационного числа учитывается необходимая поправка. В скобках указаны ковалентные радиусы. [c.209]
Большинство неорганических соединений бериллия (П) в обычных условиях полимерны и являются кристаллическими веществами белого цвета. Независимо от типа кристаллических решеток соединений координационное число бериллия 4. В кислых водных растворах ионы Ве + находятся в виде прочных аквокомплексов [Ве (ОН2)41 в сильно щелочных растворах, по-видимому, в виде ионов [Ве(0Н)4) . [c.565]
Однако применение законов кинетической теории газа к электронному газу приводит к значению а, отличающемуся от эксперимента. Делокализация валентных электронов-в кристаллической решетке металла, а следовательно, отсутствие в ней направленных валентных связей объясняет тот факт, что металлы имеют большое координационное число К, плотнейшую сферическую упаковку, а также чаще всего кубическую объемно-центрированную элементарную ячейку решетки. Некоторые металлы могут кристаллизоваться в различных типах решеток например, при температуре 906 °С устойчивым является немагнитное у-железо с /С=12. Впрочем, для некоторых тяжелых металлов наряду с металлической связью, образованной З -электронами, реализуются слабые ковалентные связи между атомами, в то время как 45-электроны образуют электронный газ. Для такой смешанной металлической и межатомной связи характерно образование пар электронов как с параллельными, так и с антипараллельными спинами (для марганца— антипараллельные, для железа — параллельные). Этим объясняется различие в магнитных свойствах металлов параллельные спины обусловливают ферромагнетизм, т. е. положительная магнитная восприимчивость на два или три порядка [c.138]
Ионы обозначают теми же символами, что и атомы, указывая справа вверху их заряд, например, положительный трехзарядный ион алюминия обозначают А1 +, отрицательный однозарядный ион хлора — С1 . Для ионов, как и для атомов, существует несколько систем радиусов. На их размеры влияют такие факторы, как количество ближайших ионов в узлах кристаллической решетки (называемое координационным числом) и их электронное состояние (заряд, размер и др.). Поэтому наиболее индивидуальным радиусом иона так же, как и для атома, можно считать его орбитальный радиус. Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома [c.82]
Металлические решетки образуют простые вещества большинства элементов периодической системы — металлы. По прочности. металлические решетки находятся между атомными и молекулярными кристаллическими решетками. Это связано с тем, что металлической связи присущи и характерные черты ковалентной связи, и отдельные черты дальнодействующей связи. Металлические решетки бывают и малопрочные, например, ртуть — жидкая. Металлам свойственны непрозрачность, характерный металлический блеск, хорошая тепло- и электропроводность и другие характерные свойства. Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Поэтому координационное число здесь достигает больших значений (8—12). [c.161]
Характер изменения плотности металлов определяется совместным влиянием ряда факторов симметрии кристаллической решетки, координационного числа и размеров атома. Так, в 4-м периоде радиус атомов от -элементов к -элементам, находящимся в центре периода, уменьшается. Поэтому максимум плотности приходится на металлы элементов центра периода. В б-м периоде плотность металлов еще более увеличивается за счет лантаноидного сжатия радиусов атомов элементов. [c.321]
Атомно - металлические кристаллы вследствие не-локализованностн металлической связи хара1 теризуются высокими координационными числами. Для них наиболее характерны три типа кристаллических решеток (рис. 65) кубическая гранецентрирован-ная (к. ч. 12), гексагональная (к. ч. 12) и кубическая объемноцентри-рованная (к. ч. 8). Кубическую гранецентрированную решетку имеет, например, медь, кубическую объемноцентрированную — железо, гексагональную — магний. [c.101]
Ионные фториды — кристаллические вещества с высокой температурой плавления. Координационное число иона фтора 6 (NaF) или 4 ( aFj). Ковалентные фториды — газы или жидкости. [c.282]
Втакже оксиды, в которых координационное число кислорода превышает значение его максимальной валентности, т. е. больше четыр( X. Например, в кристалле MgO координационное число кислорода равно шести, а в кристалле NaoO восьми. Согласно теории молекулярных орбита-лей эта обусловлено тем, что в кристалле М 0 (структурный тип Na l) каждый атом С (за счет 2р -, 2р, - и 2р -орбиталей) объединяется с шестью соседними атомами Vlg посредством трех трехцентровых связей. Аналогично построены кристаллические МпО, FeO, СоО, NiO и другие оксиды со структурой тина Na l. [c.311]
Соединения Ре (III), Ru (III), Os (III). Координационные числа Fe(III) равны 6 н 4, что соответствует октаэдрическому и тетра-э1рнческому расположению связей. Так, в кристаллическом Feds я елезо шестикоординационно. При растворении Fe Ig в воде об- [c.588]
Возможные типы регулярных укладок подробно исследовали в связи с их аналогией упорядоченному расположению атомов или ионов в кристаллической решетке [5]. Так, 71,ля простой кубической укладки координационное число Nk=.Q (4 соседа в горизонтальной плоскости и по одному сверху и снизу) порозность е = 0,476 расстояние между параллельными плоскостями, проходящими через центры шаров, равно d максимальный просвет (живое сечение) в плоскости соприкосновения шаров соседних рядов ()max = 1, а минимальный — в плоскости, проходящей через их центры, — tfmin = 0,214. При максимально плотной гексагональной упаковке Nk = 12 (6 соседей в вершинах правильного шестиугольника в горизонтальной плоскости и по три сверху и снизу в промежутках между шарами этой плоскости) порозность е = 0,2595 расстояние между соседними плоскостями 0,707 просветы ifmax = 0,349 и ifmin = 0,214. Возможны и другие упорядоченные структуры с промежуточными значениями е и четными координационными числами А/к = 8, 10 и 12. Комбинированные расположения соседних плоскостей могут давать упорядоченные упаковки с промежуточными, нечетными значениями iVk = 5, 7, 9 и 11. При более рыхлых расположениях без непосредственного контакта шаров одного горизонтального ряда возможна, например, упаковка типа кристаллической решетки алмаза [6] с Л/ к = 4 и s = 0,66. [c.8]
Координационное число Тип кристаллической структуры и ее характерные (аойства [c.607]
Ионные кристаллы состоят из бесконечных рядов чередующихся положительных и отрицательных ионов, удерживаемых вместе электростатическими силами. Эти силы ничем не отличаются от тех, которые обеспечивают устойчивость молекулы Na l в паровой фазе. В твердом Na l ионы Na " и l расположены таким образом, чтобы между ними обеспечивалось максимальное электростатическое притяжение, и это обусловливает кристаллическую структуру, показанную на рис. 14-9. В кристалле Na l каждый ион Na имеет координационное число 6 и каждый ион С1 точно так же окружен шестью ионами Na . Ионные связи обладают боль- [c.607]
НО установлено, что углерод имеет в кристаллическом состо5шии координационное число 4, и это обусловливает расщепление его щироких зон, показанных на рис. 14-28,а, на заполненную зону, которая отвечает связывающим орбиталям, и свободную зону разрыхляющих орбиталей. Между этими зонами остается запрещенная зона энергий, или межзонная щель (рис. 14-28,6). [c.631]
Первоначальное понятие о комплексных соединениях, образованных центральным атомом или ионом металла и совокупностью ( luster) ионов или молекул, именуемых лигандами (число которых называют координационным числом), в последнее время было расширено, и теперь оно охватывает большую часть неорганических соединений в молекулярном (растворы) или кристаллическом (твердые тела) состоянии. Нихолм [4] указывает, что химию комплексных соединений следует рассматривать как некоторый подход к неорганической химии, а не просто как один из ее разделов и что в связи с этим она должна быть полезной для понимания как гомогенного, так и гетерогенного катализа. Нас интересует динамика обратимых изменений координационного числа и степени окисления центрального атома, и мы [c.15]
Бернал и Фаулер (Англия), впервые тщательйо проанализировавшие результаты рентгеноструктурного исследования воды, в 1933 г. установили, что в воде остаются фрагменты структуры льда. Для большей части молекул в жидкой воде сохраняется тетраэдрическое окружение, которое они имели в структуре льда среднее координационное число молекул в жидкой воде близко к четырем, так, при 2, 30 и 83 °С оно равно соответственно 4,4 4,6 и 4,9. Большая часть водородных связей, соединяющих молекулы Н2О в кристаллической решетке льда, сохраняется и в воде доля разорванных водородных связей при О, 25, 60 и 100°С составляет соответственно около 9, 11, 16 и 20%. [c.156]
Координационными или комплексными называют соединения, содержащие центральный атом или ион и группу молекул или ионов, его окружающих и связанных с ним (лигандов). Число лигандов, связанных с центральным атомом (ионом), называют координационным числом иона. Оно зависит как от электронной структуры, так и от соотношения между радиусами центрального атома (иона) и лигандов. Координационное число центрального атома (иона) обычно превышает его валентность, понимаемую как формальный положительный заряд на атоме. Высокая устойчивость многих комплексных соединений указываает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях. В большинстве координационных соединений центром является ион переходного металла (Т , Со , Сг " и др.), а лигандами — ионы или полярные молекулы (обладающие к тому же неподеленной парой электронов.) Именно поэтому электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей также квантовомеханические особенности строения электронной оболочки центрального иона (Бете, Ван Флек). [c.120]
Более совершенная модель поверхности оксида алюминия была предложена в работе [126]. Модель основана на положении, что на поверхности всех (видов) сортов оксида алюминия представлены три кристаллические плоскости шпинели (111), (ПО) и (100). Относительное наличие этих плоскостей должно. меняться для различных сортов оксида алюминия, вместе с этим изменяется число и вид гидроксиль-,ых нонов на поверхности. Рассчитано, что в слоях ионов, образующих эти плоскости, располагаются пять типов гидроксигрупп, свойства которых определяются их координационным числом и зарядом. Взаимодействие этих гидроксилов друг с другом и с соседними группами атомов приводит к созданию высокозарядных дефектных центров. Возможно образование при этом донорио-акцепторных комплексов, имеющих характер кислотно-основного центра и обладающих повышенной каталитической активностью. [c.72]
Некогорыс исследователи отрицают карбонии-иониый механизм и считают, что носителем каталитической активности является не протон, а атом алюминия катализатора. За счет перехода электронов ia свободные /-подуровни атома алюминия образуются неустойчивые промежуточные соединения углеводородов с атомам алюминия. Чем меньше координационное число алюминия в кристаллической решетке, тем он активнее. [c.136]
Бернал и Фаулер в результате реитгеноструктурного исследования воды установили, что в ней остаются группировки молекул, сходные со структурой льда. Для большей части молекул в жидкой воде сохраняется тетраэдрическое окружение, которое они имели в структуре льда среднее координационное число молекул в жидкой воде близко к четырем. Наличие элементов кристаллической структуры у воды, а также большого дипольного момента у ее молекул обусловливает высокое значение диэлектрической проницаемости воды при 25° С она равна 79,5. Это означает, что взаимодействие между заряженными частицами в водной среде почти в 80 раз слабее, чем в вакууме. [c.81]
Кристаллический хлорид алюминия А1С1з имеет слоистое строение (см. с. 91). Каждый атом А1 окружен шестью атомами С1, а каждый атом С1 окружен двумя атомами А1, т. е. координационное число А1 равно 6, а С1 равно 2. Следовательно, на 2 моль атомов А1 приходится 6 моль атомов С1, поэтому состав соединения А12С1н, или А1С1з. [c.82]
Каков состав кристаллического соединения, образованного агомамн А и В, если координационные числа а) атомов А и В равны б) атома А в два раза болыне атома В в) атома А в три раза болыие атома В [c.83]
Кристаллы аргона и других инертных газов являются молекулярными с высокими координационными числами (плотной упаковкой молекул в кристалле). Так, аргон имеет кубическую гра-иецентрированную кристаллическую реп1етку (см, рис. 50, а). [c.181]
Замечательно, что различные структурообразующие факторы не только сосуществуют, но и дополняют друг друга. При их разных сочетаниях осуществляется либо кристаллизация с различной плотностью укладки структурных единиц, либо более сложный процесс, который можно называть в отличие от кристаллизации структурообразованием, приводящий к образованию невообразимого множества однотипных, но все же различных индивидуальных структур, о которых говорилось выше. Таким примером снижения плотности укладки малых нульмерных структурных единиц в результате вмещательства ковалентной составляющей связи является образование сравнительно неплотных кристаллических структур щелочных металлов и металлов IV В — VI В групп, а также железа, для которых координационное число равно всего восьми. [c.160]
Вследствие нелокализованности металлической связи атомно-металлические кристаллы характеризуются высокими координационными числами. Для них наиболее характерны три типа кристаллических решеток (рис. 86) кубическая гранецентрированная (к. ч. 12), [c.135]
Диоксиды ЭОа имеют координационные кристаллические решетки. В одной из модификаций Т10а — рутиле — координационное число титана равно 6 (см. рис. 91, б) в кристаллах 2г0а и НЮа координационные числа 2г и Н1 достигают 7 и 8 (рис. 218, а). [c.501]
Соединения Э (П1) — чаще всего белые кристаллические вещества. Их структура характеризуется высокими координационными числами Э. Так, координационное число Ьа (ПЛ) в кристаллах ЬаС1з и Ьа(ОН)з равно 9, а в кристаллах ЬзгЗз и ЬаЫ 8. [c.546]
Другие важные свойства металлов связаны с особенностями их структуры. В трех главных структурных типах металлов реализуются весьма высокие координационные числа (разд. 1.5). В кристаллических решетках кубической и гексагональной плотнейших упаковок каждый атом металла окружен 12 ближайшими соседями. В то же время в кубической объемно-центриро-ванной решетке число ближайших соседей равно восьми, но можно считать дополнительно координированными еще шесть [c.360]
Для малорастворимых твердых веществ можно получить отражательный спектр. При интенсивном измельчении твердого вещества уменьшается часть светового потока, отражающаяся от его поверхности, а большая часть падающего света проникает и глубь вещества. Эта доля частично поглощается, а частично, после м-ногократного отражения снова диффузно выделяется через поверхность вещества наружу. При таком внутреннем отражении ослабляются участки спектра, связанные с абсорбцией света молекулами. Для дальнейшего уменьшения поверхностного отражения порошкообразное вещество можно смешать с веществом, индифферентным в используемой спектральной области (белый стандарт), и получить известную аналогию с раствором вещества. Отражательная спектроскопия пригодна также для получения спектров поглощения малорастворимых веществ. Этот метод применяют в основном при исследовании состава красок и строения неорганических твердых соединений. Абсорбция света окрашенными катионами зависит от различных факторов от координационного числа, симметрии молекулы и межатомных расстояний в кристаллической решетке соединения. По изменению абсорбции можно сделать выводы об изменениях, происходящих в решетке соединения при включении посторонних ионов. [c.355]
Структура кристаллических модификаций 2 a0-S102 характеризуется наличием изолированных тетраэдров [SIO4] . Но координационное число ионов кальция по кислороду в различных формах меняется от 6 до 10. [c.107]
Веществ, обладающих атомными решетками, сравнительно мапо. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью (алмаз — самое твердое естественное вещество), они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи. Если атомы в кристаллической решетке связаны только проводит электрического тока и является изолятором (кварц). Если в атомной кристаллической решетке присутствуют делокализованные тг-связи, то вещество может иметь хорошую электропроводность (графит). Попытка сдвига одних участков кристаллической решетки относительно других приводит при достаточном усилии к ее разрушению, что связано с разрывом кова.пентных связей, обладающих направленностью. Количество ближайших частиц в кристаллической решетке, окружающих выбранную, назывгьется координационным числом. Координацрюн-ное число в атомных решетках определяется числом связей центрального с окружающими его атомами и, в силу насыщаемости ковалентной связи, не достигает больших значений. Часто оно равно четырем. [c.160]
chem21.info
2.7. Координационное число и плотность упаковки
Плотность упаковки – это доля объема кристаллической решетки, занятая атомами.
Плотность упаковки можно рассчитать как отношение объема касающихся шароподобных атомов, приходящихся на элементарную ячейку, к объему всей ячейки; обычно плотность упаковки выражают в процентах.
Кратчайшее расстояние между центрами двух шаров в элементарной ячейке равно двум радиусам шара – 2r. Объем шара V = 4/3r3, объем шаров, входящих в элементарную ячейку, Vn = 4/3nr3, где n – кратность элементарной ячейки. Если объем элементарной ячейки V0, то плотность упаковки равна Р = (Vn/V0)·100 %.
Если период решетки равен а, то V0 = а3, решение задачи сводится к выражению атомного радиуса через период решетки, для конкретной структуры следует определить кратчайшее межатомное расстояние, например, в алмазе 2r = a /4 (кратчайшее расстояние, равное двум атомным радиусам, составляет четверть пространственной диагонали куба).
В табл. 2.3 приведены результаты расчета плотности упаковки для различных структур.
Таблица 2.3
Плотность упаковки для различных структур
| Тип решетки | К. ч. | Атомный радиус r | Кратность ячейки n | Р, % |
| Алмаз | 4 | а | 8 | 34 |
| Кубическая примитивная | 6 | а/2 | 1 | 52 |
| ОЦК | 8 | а | 2 | 68 |
| ГЦК | 12 | а | 4 | 74 |
| ГПУ | 12 | 74 |
С повышением координационного числа плотность упаковки растет.
Заполнение междоузлий в ГЦК решетке, что соответствует повышению кратности элементарной ячейки, приводит к менее плотным упаковкам.
2.8. Связь между типом структуры, координационным числом и электрофизическими свойствами
Плотнейшие и плотные упаковки (Р = 68 – 74 %) с к.ч. 8/8 и 12/12 типичны для металлов (структуры ОЦК, ГЦК, ГПУ) .
Наименее плотные упаковки (Р = 34 % и подобными) с к.ч. 4/4 (структуры алмаза, сфалерита, вюрцита), 4/2 (куприт), 2/2 (селен) типичны для полупроводников.
Структуры с промежуточными значениями к.ч. 6/6 и плотности Р 67 %, например, типаNaCl, могут иметь и проводниковые свойства (TiO, TiN, VN, TiC и др.), и полупроводниковые свойства (PbS, PbSe, PbTe), и диэлектрические (NaCl, MgO, CaO, BaO).
Металлические вещества могут кристаллизоваться и в структуры с низкими к.ч., например, в графите к.ч. равно 4, как и в алмазе.
Важнейшие полупроводники образуют следующие структуры:
алмаза: Si,Ge, α-Sn;
сфалерита: ZnS, HgS, CdTe, AlP, AlAs, AlSb, GaP, GaAs, GaSb, InP, InAs, InSb, SiC, ZnSe, HgSe, ZnTe, HgTe;
куприта: Cu2O, Ag2O;
флюорита: Mg2Si, Mg2Ge;
вюрцита: ZnS, ZnO, CdS, CdSe;
хлорида натрия: PbS, PbSe, PbTe;
арсенида никеля: VS, VSe, FeS, FeSe.
2.9. Островные, цепные и слоистые структуры
Кроме координационных структур, в которых межатомные расстояния между всеми структурными единицами одинаковы (один тип связи), в островных, цепных и слоистых структурах (рис.2.15) могут быть выделены группы атомов, которые образуют «острова» (молекулы), непрерывно простирающиеся в одном направлении (цепи), или бесконечные в двух (слои) или трех (каркасы) измерениях. Такие структуры являются молекулярными.
На рис. 2.15 а изображены островные структуры: 1 - линейные, 2 – двумерные (квадрат), 3 – трехмерные (тетраэдр). На рис. 2.15 b показаны цепные структуры: 4 – линейная, 5 – цигзагообразная, 6 и 7 – звенья из октаэдров и тетраэдров.
Рис.2.15. Островные и цепные структуры
Контрольные вопросы
Какая решетка называется простой, сложной?
Чем поликристалл отличается от монокристалла?
Что обозначает запись: (hkl), {hkl}, < hkl>, [hkl]?
Какие значения могут принимать индексы Миллера?
Запишите индексы Миллера плоскостей, перпендикулярных ребрам куба.
Запишите индексы Миллера плоскостей, перпендикулярных диагоналям граней куба.
Запишите индексы Миллера плоскостей, параллельным граням куба.
Запишите индексы Миллера направлений, перпендикулярных граням куба.
В чем отличие (110), {110 }, < 110>, [110]?
Какое явление называется полиморфизмом?
Что такое изоморфизм?
Чем отличается строение стекол от строения кристаллов?
Каковы особенности строения аморфных тел?
Какие структуры относятся к плотным упаковкам? Как расположены в них атомы?
В чем отличие ГПУ от ГЦК?
Чему равны координационные числа в плотных упаковках?
Где расположены тетраэдрические междоузлия в ГЦК решетке?
Где расположены октаэдрические междоузлия в ГЦК решетке?
Что называется политипизмом?
Что называется кратностью элементарной ячейки?
Как рассчитать число атомов, приходящихся на элементарную ячейку?
Чем отличаются различные типы кубических структур?
Изобразите элементарные ячейки меди, кремния, NaCl, CsCl, сфалерита.
Поясните расположение атомов в решетке вюрцита.
На основе какой плотной упаковки строится решетка вюрцита?
На основе какой плотной упаковки строится решетка сфалерита?
Сколько атомов приходится на элементарную ячейку вюрцита?
Как рассчитывается плотность упаковки кристаллических структур?
Какие кристаллические решетки имеют максимальную плотность упаковки?
Какие кристаллические решетки имеют минимальную плотность упаковки?
Как связана плотность упаковки с координационным числом?
Можно ли отнести цепные структуры к координационным? Почему?
В чем разница между дальним и ближним порядком в твердых телах?
studfiles.net
1. Для кристаллической решетки алюминия определите координационное число и рассчитайте коэффициент укладки. Объясните физическую природу высокой пластичности и
Вариант 361. Для кристаллической решетки алюминия определите координационное число и рассчитайте коэффициент укладки. Объясните физическую природу высокой пластичности и электропроводности алюминия.2. Что такое предел выносливости? Каким способом можно повысить предел выносливости пружин? Опишите сущность предлагаемого метода.
3. Вычертите диаграмму состояния железо - карбид железа, укажите структурные составляющие во всех областях диаграммы, опишите процессы кристаллизации и превращений в твердом состоянии для сплава, содержащего 0,1 % С, напишите для этих процессов фазовые реакции с указанием составов реагирующих фаз и температурных интервалов превращений, изобразите схему кривой охлаждения заданного сплава и обоснуйте ее вид с применением правила фаз. Какова структура этого сплава при комнатной температуре и как такой сплав называется?
4. Вычертите диаграмму изотермического превращения аустенита для стали У8, нанесите на нее кривую режима термической обработки, обеспечивающей получение твердости 60...63 HRС. Укажите, как этот режим называется, опишите сущность превращений и какая структура получается при этом.
5. В чем заключается отрицательное влияние цементитной сетки на свойства инструментальной стали У10 и У12? Какой термической обработкой можно ее уничтожить? С помощью диаграммы состояния железо-цементит обоснуйте выбранный режим термической обработки.
6. Назначьте температуру закалки, охлаждающую среду и температуру отпуска деталей из стали 40ХГ, которые должны иметь твердость 230...250 НВ. Опишите микроструктуру и свойства стали после термической обработки.
7. Для изготовления режущего инструмента выбрана сталь Р6М5К5. Укажите состав и определите группу стали по назначению. Назначьте режим термической обработки, приведите его обоснование, объяснив влияние легирования на превращения, происходящее на всех этапах термической обработки данной стали. Опишите микроструктуру и свойства стали после термической обработки.
8. Магнитопровод трансформатора изготовлен из листовой стали Э330.Укажите состав стали, ее структурные особенности, технологию изготовления и термической обработки. Чем достигается анизотропия магнитных свойств и для чего создается текстура в этой стали?
skachate.ru
Кристаллическая решетка. Координационное число
Энергетика  Кристаллическая решетка. Координационное число
Кристаллическая решетка. Координационное число
просмотров - 122
Химическая связь в твердых телах
Строение кристаллов.
ЛЕКЦИЯ 5
Водородная связь
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с большей электроотрицательностью другой молекулы. Положительно поляризованный атом водорода обладает уникальными свойствами: очень малым размером и отсутствием внутренних электронных слоев, в связи с этим он может легко проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. В результате между двумя молекулами возникает взаимодействие, ĸᴏᴛᴏᴩᴏᴇ носит мектростатический и частично донорно-акцепторный характер.
Водородная связь условно записывается в виде трех точек и изображается так:
Х – Н... Y,
где Х, Y – атомы F, О, N, Cl, S.
Энергия и длина водородной связи определяется электрическим моментом диполя связи Х-Н и размерами атома Y. Длина водородной связи уменьшается, а энергия возрастает с увеличением разности электроотрицательностей атомов Х и Y (и соответственно электрического момента диполя связи Х-Н) и с уменьшением размера атома Y.
Важную роль водородная связь играет в процессах кристаллизации и растворения веществ, а также при образовании кристаллогидратов.
Кристаллы - твердые тела, обладающие трехмерной периодической структурой, которая принято называть кристаллической решеткой.
Существование кристаллической решетки объясняется тем, что равновесие между силами притяжения и отталкивания атомов, соответствующее минимальной потенциальной энергии, достигается при условии их трехмерной периодичности.
Размещение частиц в кристаллической решетке осуществляется таким образом, чтобы обеспечить максимально возможную для данного типа кристаллов энергию их связи, а также энергетическую однородность кристалла в целом. Для частиц сферической формы наиболее благоприятным оказывается такое их размещение, при котором каждая сфера находится в соприкосновении с наибольшим числом ближайших соседей. Подобные пространственные образования получили название структур плотнейшей упаковки.
Количество частиц, непосредственно примыкающих к данной частице, определяют как координационное число.
В кристаллах, образованных сферическими частицами одинакового размера, плотнейшая упаковка может осуществляться в виде двух энергетически эквивалентных структур: кубической и гексагональной. Координационное число для каждой из этих структур равно 12, а сами сферы занимают объем порядка 74% полного объема кристалла.
В подобные структуры кристаллизуются большинство металлов и сплавов, благородные газы, а также соединения, молекулы которых обладают сферической симметрией: СО2, СН4.
В случае если частицы, образующие кристалл, не обладают сферической симметрией или имеют разные размеры, то их плотнейшая упаковка искажается, а значит, координационное число будет меньше 12, и доля незанятого объема кристалла будет возрастать.
Наименьшим значением координационного числа обладают кристаллы, между частицами которых осуществляется направленная ковалентная связь. Это кристаллы С (алмаза), В4N3, SiO2, Ge, Si, ZnS. Значение координационного числа для этих кристаллов равно 4, а доля занимаемого частицами объема не превышает 34%.
2. Энергия кристаллической решетки. Типы кристаллов:
oplib.ru