Open Library - открытая библиотека учебной информации. Сульфата хрома гидролиз
_Гидролиз_
Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Силикат калия при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. не гидролизуетсяОтвет: 3Неправильно!Вопрос:Сульфат хрома (III) при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основные соли и кислоту4. не гидролизуетсяОтвет: 1Неправильно!Вопрос:рН среды в растворе сульфата меди 1. =72. > 73. <74. ≥ 7Ответ: 3Правильно!Вопрос:При гидролизе _________ образуется основная соль1. Na2SO42. (Nh5)3PO43. AlCl34. KCNОтвет: 3Правильно!Вопрос:На степень гидролиза соли _______ не влияет разбавление раствора1. Nh5CN2. FeSO43. Nh5Cl4. K2Cr2O7Ответ: 1Правильно!Вопрос:Константа гидролиза цианида аммония равна __, если KNh5OH = 1,8·10-5, KHCN = 5·10-10.1. 3,32. 5,53. 7,74. 1,1Ответ: 4Правильно!Вопрос:Уравнение SO32- + HOH ⇔ HSO3- + OH- относится к гидролизу соли_____1. NaHSO32. CdSO33. K2SO34. KHSO3Ответ: 3Правильно!Вопрос:При гидролизе _____ образуется основная соль1. Na2CO32. Na2SO43. FeCl34. Ch4COONaОтвет: 3Правильно!Вопрос:Добавление _________ к раствору FeCl3 приводит к полному необратимому гидролизу1. KCl2. K2S3. K2SO44. KCNОтвет: 2Правильно!
Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Сульфит натрия при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. не гидролизуетсяОтвет: 2Правильно!Вопрос:Нитрат калия при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основную соль и кислоту4. не гидролизуетсяОтвет: 4Правильно!Вопрос:рН среды в растворе сульфата натрия 1. =72. > 73. <74. ≥ 7Ответ: 1Правильно!Вопрос:При гидролизе _________ образуется основная соль1. KCN2. K2Cr2O73. (Nh5)2S4. FeCl3Ответ: 4Правильно!Вопрос:pH наибольшее в растворе соли _____ при равной концентрации всех солей (KHF = 1·10-4; KHClO = 3·10-8; KHCN = 5·10-10; KCh4COOH = 2·10-5).1. Nh5F2. Nh5ClO3. Ch4COONh5 4. Nh5CNОтвет: 1Неправильно!Вопрос:Константа гидролиза фторида натрия равна __, если KHF = 1·10-4.1. 2·10-122. 3·10-143. 5·10-84. 1·10-10Ответ: 4Правильно!Вопрос:Уравнение S2- + HOH ⇔ HS- + OH- относится к гидролизу соли_____ 1. F2S32. Cr2S33. K2S4. (Nh5)2SОтвет: 3Правильно!Вопрос:При гидролизе _____ образуются слабое основание и слабая кислота1. Na2CO32. Na2SO43. Al2S34. Ch4COONaОтвет: 3Правильно!Вопрос:Полному необратимому гидролизу подвергается1. FeCl32. K2SO43. Ca(CN)24. Al2S3Ответ: 4Правильно!
Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Ацетат аммония при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. не гидролизуетсяОтвет: 1Правильно!Вопрос:Сульфид аммония при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основную соль и кислоту4. не гидролизуетсяОтвет: 2Правильно!Вопрос:рН среды в растворе фосфата натрия 1. =72. > 73. <74. ≥ 7Ответ: 2Правильно!Вопрос:При гидролизе _________ образуется кислая соль1. Na2CO32. ZnCl23. Al2(SO4)34. Ba(NO3)2Ответ: 1Правильно!Вопрос:На степень гидролиза солей ____ и ______ не влияет разбавление раствора1. MgSO42. NaAlO23. Nh5ClO4. Fe(Ch4COO)3Ответ: 2,1Неправильно!Вопрос:Константа гидролиза нитрита калия равна __, если KHNO2 = 5·10-4.1. 1·10-52. 4·10-73. 3·10-94. 2·10-11Ответ: 4Правильно!Вопрос:Уравнение HPO42- + HOH ⇔ h3PO4- + OH- относится к гидролизу соли_____1. (Nh5)2HPO42. K2HPO43. Ca(h3PO4)24. Al2(HPO4)3Ответ: 2Правильно!Вопрос:В растворе соли _____ рН < 71. Na2CO32. Na2SO43. NaCN4. CrCl3Ответ: 4Правильно!Вопрос:Добавление _________ к раствору ZnSO4 приводит к ослаблению гидролиза1. AlCl32. Na2SO43. Na2CO34. Ch4COONaОтвет: 1Правильно!Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Сульфат алюминия при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. гидролизуется по первой и второй ступенямОтвет: 2Неправильно!Вопрос:Сульфат железа (III) при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основные соли и кислоту4. не гидролизуетсяОтвет: 3Правильно!Вопрос:рН среды в растворе карбоната алюминия 1. =72. > 73. <74. ≥ 7Ответ: 2Неправильно!Вопрос:При гидролизе _________ образуется кислая соль1. Al(NO3)32. CuCl23. CoSO44. Na2СO3Ответ: 4Правильно!Вопрос:На степень гидролиза солей ____ и ______ не влияет разбавление раствора1. MgSO42. NaAlO23. Nh5ClO4. Fe(Ch4COO)3Ответ: 2,3Неправильно!Вопрос:Константа гидролиза нитрита калия равна __, если KHNO2 = 5·10-4.1. 1·10-52. 4·10-73. 3·10-94. 2·10-11Ответ: 4Правильно!Вопрос:Уравнение HPO42- + HOH ⇔ h3PO4- + OH- относится к гидролизу соли_____1. (Nh5)2HPO42. K2HPO43. Ca(h3PO4)24. Al2(HPO4)3Ответ: 2Правильно!Вопрос:В растворе соли _____ рН = 71. FeCl32. Ca(CN)23. Na2SO44. Na2CO3Ответ: 3Правильно!Вопрос:Добавление _________ к раствору CrCl3 приводит к полному необратимому гидролизу1. KCl2. K2SO43. K2S4. K3PO4Ответ: 3Правильно!Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Сульфит натрия при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. не гидролизуетсяОтвет: 2Правильно!Вопрос:Сульфид хрома при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основную соль и кислоту4. не гидролизуетсяОтвет: 1Правильно!Вопрос:рН среды в растворе сульфита натрия 1. =72. > 73. <74. ≥ 7Ответ: 2Правильно!Вопрос:При гидролизе _________ образуется основная соль1. Na2SO42. (Nh5)3PO43. AlCl34. KCNОтвет: 3Правильно!Вопрос:На степень гидролиза соли _______ не влияет разбавление раствора1. Nh5Br2. Nh5Cl3. Ch4COONа4. Nh5CNОтвет: 4Правильно!Вопрос:Степень гидролиза хлорида аммония в 0,1М растворе равна __, если KNh5OH = 1,8·10-5.1. 4,2·10-22. 3,5·10-33. 2,3·10-94. 7,4·10-5Ответ: 4Правильно!Вопрос:Уравнение CO32- + HOH ⇔ HCO3- + OH- относится к гидролизу соли_____1. (Nh5)2CO32. Al2(CO3)33. K2CO34. Cr2(CO3)3Ответ: 3Правильно!Вопрос:При гидролизе _____ образуются слабое основание и слабая кислота1. Na2CO32. Na2SO43. Al2S34. Ch4COONaОтвет: 3Правильно!Вопрос:Добавление _________ к раствору CrCl3 приводит к полному необратимому гидролизу1. KCl2. K2SO43. K2S4. K3PO4Ответ: 3Правильно!
Вопрос:Сульфат натрия при растворении в воде1. гидролизуется по катиону2. гидролизуется по аниону3. гидролизуется по катиону и аниону4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Нитрат калия при растворении в воде1. гидролизуется по одной ступени2. гидролизуется по первой ступени3. гидролизуется необратимо4. не гидролизуетсяОтвет: 4Правильно!Вопрос:Сульфат меди при растворении в воде образует1. основание и кислоту2. кислую соль и основание3. основную соль и кислоту4. не гидролизуетсяОтвет: 1Неправильно!Вопрос:рН среды в растворе ацетата аммония 1. =72. > 73. <74. ≥ 7Ответ: 3Неправильно!Вопрос:При гидролизе _________ образуется кислая соль1. Na2HPO42. Nah3PO43. SbCl34. Pb(NO3)2Ответ: 4Неправильно!Вопрос:pH наименьшее в растворе соли _____ при равной концентрации всех солей (KHF = 1·10-4; KHClO = 3·10-8; KHBrO = 2·10-9; KCh4COOH = 2·10-5).1. KF2. KClO3. KBrO4. Ch4COOK Ответ: 1Правильно!Вопрос:Константа гидролиза гипохлорита калия KClO равна __, если KHClO = 3·10-8.1. 3,3·10-72. 1,1·10-93. 4,4·10-54. 2,2·10-11Ответ: 1Правильно!Вопрос:Уравнение CO32- + HOH ⇔ HCO3- + OH- относится к гидролизу соли_____1. Nh5HCO32. Na2CO33. Al2(CO3)34. (Nh5)2CO3Ответ: 2Правильно!Вопрос:В растворе соли _____ рН < 71. AlCl32. Na2SO43. Na2CO34. Ch4COONaОтвет: 1Правильно!Вопрос:Добавление _________ к раствору CrCl3 приводит к полному необратимому гидролизу1. KCl2. K2CO33. K2SO44. K3PO4Ответ: 2Правильно!
studfiles.net
В воде соли хрома гидролизуются. На первой стадии гидролиза солей сильных кислот образуются гидроксопентааквакомплексы.

Обратная связь
ПОЗНАВАТЕЛЬНОЕ
Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса - ваш вокал
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший "Салат из свеклы с чесноком"
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной

Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
 Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
 Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Далее может идти полимеризация полученных соединений, состав продуктов гидролиза определяется температурой, рН и концентрацией, например, для сульфата хрома после первой стадии процесса идет образование более крупных молекул
[Cr(h3O)6]3+ + h3O = [Cr(OH)(h3O)5]2+ + h4O+
Cr3+ + h3O ↔ Cr(OH)2+ + H+
 H
H



 h3O O Oh3
h3O O Oh3






 2[Cr(h3O)5OH]2+ + 3SO42- ↔ 6h3O + h3O Cr O Cr h3O
2[Cr(h3O)5OH]2+ + 3SO42- ↔ 6h3O + h3O Cr O Cr h3O
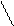
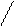 -OSO3O H OSO3-
-OSO3O H OSO3-

 O O
O O

 S
S

 O O
O O
H



 h3O O Oh3
h3O O Oh3
2[Cr(h3O)5OH]2+ + SO42- ↔ 


 4h3O h3O Cr O Cr Oh3
4h3O h3O Cr O Cr Oh3
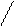
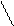
 h3O H Oh3
h3O H Oh3


 O O
O O



 S
S
O O
Раствор из фиолетового становится зеленым.
Сульфид хрома (III) не образуется в растворе из-за необратимого гидролиза, как и карбонат хрома.
Cr2S3 + h3O = Cr(OH)3 + h3S
Однако сульфид хрома (III), полученный сухим путем устойчив по отношению к воде и растворам кислот.
Получают его в виде черных блестящих листочков при нагревании хлорида хрома (III) в атмосфере сероводорода.
CrCl3 + h3S = Cr2S3 + HCl
В щелочных средах производные трехвалентного хрома легко окисляются свободными галогенами, перекисью водорода и т.д., т.е. обладают восстановительными свойствами.
Кроме аквакомплексов известны и аммиакаты хрома (III).
Анионные комплексы хрома (III) весьма разнообразны.
3KOH + Cr(OH)3 = K3[Cr(OH)6]- зеленый
3KCl + CrCl3 = K3[CrCl6] – розово - красный
3h3SO4 + Cr2(SO4)3 = h3[Cr(SO4)3] - желтый
Ионы [Cr(OH)6]3- окрашены в изумрудно-зеленый цвет, устойчивы в твердом состоянии, а в растворе только при избытке щелочи, другие хромат ионы более устойчивы. Например, при действии хлорида бария на раствор h42[(SO4)3] осадок ВаSO4 образуется только при нагревании раствора.
Известны комплексные хлориды хрома состава 3 KСl × CrCl3, это производные двухядерных комплексов [Cr2Cl9]3-, имеющих структуру сдвоенных октаэдров CrCl6 с общей гранью. Ион [Cr2Cl9]3- парамагнитен и имеет три неспаренных электрона, в то время как однотипный ион [W2Cl9]3-диамагнитен, также расстояние между атомами хрома составляет 3,1 А, а между атомами вольфрама 2,4А. Это говорит о том, что комплекс вольфрама является кластером, т. е. между атомами металла осуществляется тройная связь.

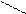

 Cl Cl Cl
Cl Cl Cl


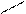



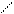
 Cl Cr Cl Cr Cl
Cl Cr Cl Cr Cl
Cl Cl Cl
3d 4s 4p

Cr – Cl

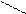

 Cl Cl Cl
Cl Cl Cl


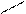

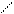
 Cl W ≡ W Cl
Cl W ≡ W Cl
Cl Cl Cl
5d 6s 6p

W≡W W – Cl
Соединения хрома (VI)
Хром в степени окисления +6 образует только оксосоединения, очевидно потому, что связь кислорода с хромом, благодаря его малому радиусу, носит кратный характер. Все они проявляют кислотные свойства и представляют собой сильные окислители.
Оксид хрома (VI), хромовый ангидрид,представляет собой темно-красные игольчатые кристаллы. По строению напоминает кремнезем, вокруг каждого иона хрома координируются ионы кислорода, которые могут быть общими для соседних тетраэдров. Сильный яд.
Триоксид хрома получается при действии избытка серной кислоты на растворы бихроматов.
При нагревании легко разлагается с выделением кислорода. Триоксид хрома сильный окислитель, со многими восстановителями реагирует со взрывом. При взаимодействии его со спиртом идет бурная реакция с выделением тепла и света
CrO3 = Cr2O3 + O2
CrO3 + C2H5OH + h3SO4 = Cr2(SO4)3 + CO2 + h3O
В отличии от оксида хрома(III) легко растворяется в воде с образованием хромовой и двухромовой кислот, между ними в растворе устанавливается равновесие
CrO3 + Н2О = Н2CrО4
2 Н2CrО4 = Н2Cr2О7 + Н2О
Хромовая кислота существует только в растворе, в свободном состоянии не
выделена.
Хромовая кислота относится к кислотам средней силы, константы диссоциации составляют К1 = 0,18 и К2 = 3,2 × 10-7. Для сравнения, фосфорная и сернистая кислоты по первой ступени диссоциируют меньше, чем хромовая.
Хромовый ангидрид является координационно ненасыщенным соединением и в растворе происходит его координационное насыщение за счет взаимодействия с молекулами воды или с атомами кислорода, входящими в состав хромат-ионов.

 O O 2-
O O 2-





 O Cr + Oh3 = O Cr O + 2H+
O Cr + Oh3 = O Cr O + 2H+
 |
O O





 O O 2- O O 2-
O O 2- O O 2-









 O Cr + O Cr O → O Cr O Cr O
O Cr + O Cr O → O Cr O Cr O
 |  | ||||
 | |||||
O O O O
[Cr3O4]2- [Cr4O13]2-
Аналогично могут образовываться три- и тетрахромат-ионы особенно в сильно концентрированных растворах, но это не очень характерно для шестивалентного хрома.
Хроматы.
При взаимодействиихромового ангидрида с основными оксидами образуются желтые соли – хроматы М2CrО4, при подкислении растворов окраска меняется на оранжево-желтую в результате образования бихроматов М2Cr2О7. В водных растворах устанавливается равновесие, которое можно сдвинуть в желаемом направлении изменяя рН среды: в кислых растворах преобладают бихромат-ионы, в щелочных – хромат-ионы:
2 CrО42- + 4 Н+ = 2 Н2CrО4 = Cr2О72- + 2 Н+
megapredmet.ru
Опыт 37 - Опыт 45
Опыт 37Совместный гидролиз сульфата хрома (III)и карбоната натрия.Результат:1) Ионные уравнения реакций:а) 2Cr3+ + 3SO − 24+ 6Na+ + 3CO2−3 = 2Cr+3 + 3CO2−3 + 6Na+ + 3SO − 24б) Cr2(CO3)3 + 3h3O = 2Cr(OH)3↓ + 3CO2↓в) Cr2(SO4)3 + 3Na2CO3 + 3h3O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4.Вывод:Гидроксид хрома (III) проявляет свойства основания. Солихрома (III) сильно гидролизуются, вследствие чего невозмож-но существование Cr2(CO3)3.Для полного протекания гидролиза необходимо кипятитьраствор для удаления CO2.
Опыт 38Перевод хроматов в дихроматыи дихроматов в хроматыРезультат:1) Ионные реакции проведенных реакций:а) 2CrO − 24+ 2H + ⇔ Cr2O 2−7 + h3OРаствор переходит из темной окраски в более темную.б) Cr2O 2−7 + 2OH − ⇔ 2CrO − 24+ H +.Раствор становится темным.Опыт 39Взаимодействие хромата калия с хлоридом барияРезультат:1) Ионные уравнения реакции:K2CrO4 + BaCl2= BaCrO4↓ + 2HCl.В сокращенной форме:CrO − 24+ Ba 2+ = BaCrO4↓2) Образуется хромат бария, имеющий желтый цветОпыт 40Окисление ионов Mn2+ до ионов Mn4+Результаты:1) Ионные уравнения приведенных реакций:Mn2+ + 2OH− = Mn(OH)2↓Образуется гидроксид марганца (II) имеющий розовую ок-раску.Mn(OH)2 + h3O = Mn(OH)4 + h3O92Гидроксид марганца (II) быстро темнеет, окисляясь дажекислородом воздуха до гидроксида марганца (IV).Опыт 41Получение гидроксида железа (III)и изучение его свойствРезультат:1) Ионные уравнения проведенных реакций:а) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.Образуется бурый осадок гидроксида железа (III).б) 2Fe(OH)3 + 3h3SO4 = Fe2(SO4)3 + 6h3OПроисходит растворение гидроксида железа (III) в сернойкислоте с образованием желто-коричневого раствора.Опыт 42Получение гидроксида железа (III)и изучение его свойствРезультат:1) Уравнения проведенных реакций:а) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4бледно-зеленыйб) 4Fe(OH)2 + 2h3O + O2 = 4Fe(OH)3↓красно-коричневыйв) Fe(OH)2 + 2HCl = FeCl2 + h3Oобразуется бледно зеленый раствор.93Опыт 43Качественные реакции на ионы Fe3+ и Fe3+Результат:1) Уравнения проведенных реакций:а) Fe3+ + [Fe(CN)6]4− = [Fe2(CN)6]−синего цветаб) Fe3+ + CNS− = Fe(CNS)3↓темно-красный осадокв) Fe2+ + [Fe(CN)6]3− = [Fe2(CN)6]−.синего цветаОпыт 44Гидролиз солей железа (III)Результат:1) Ионное уравнение гидролиза солей на первой стадии.а) Fe 3+ + CO 2−3 = Fe2(CO3)3б) Fe2(CO3)3 + 3h3O = 2Fe(OH)3↓ + 3CO2↑Образуется осадок красно-коричневого цвета и выделяетсяуглекислый газ.Опыт 45Получение гидроксида никеля (II)и изучение его свойствРезультат:1) Уравнение реакции:а) NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4Образуется осадок зеленого цвета.942) Исследование характера гидроксида никеля.а) Ni(OH)2 + 2HCl = NiCl2 + h3OПроисходит растворение гидроксида с образованием блед-но-зеленого раствора.б) Ni(OH)2 + NaOH ≠ — реакция не происходит.
5terka.com
Гидролиз солей
Гидролиз солей
Основные положения:
1. Соли сильного основания и сильной кислоты (например, бромид калия, нитрат натрия) при растворении в воде не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и слабой кислоты, например, KClO, Na2CO3, Ch4COONa, NaCN, Na2S, K2SiO3, гидролизуются по аниону и имеют щелочную среду.
3. Соли слабого основания и сильной кислоты, например, Al2(SO4)3, FeCl2, CuBr2, Nh5Cl, гидролизуются по катиону и имеют кислую среду.
4. Соли слабого основания и слабой кислоты, например, Al2S3, Cr2S3, Ch4COONh5, (Nh5)2CO3, гидролизуются полностью (по катиону и аниону). Реакция среды в таких растворах зависит от относительной силы кислоты и основания (то есть они могут иметь нейтральную, кислую и щелочную среду, все зависит от конкретного раствора).
1. Название соли Способность к гидролизу
А. Нитрат лития 1. Не гидролизуется
Б. Нитрат цинка 2. Гидролиз по катиону
В. Сульфид калия 3. Гидролиз по катиону
Г. Сульфид алюминия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1234.
2. Название соли Способность к гидролизу
А. Нитрит калия 1. Не гидролизуется
Б. Нитрит бария 2. Гидролиз по катиону
В. Сульфид цезия 3. Гидролиз по катиону
Г. Сульфид хрома 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3334.
3. Название соли Способность к гидролизу
А. Фосфат калия 1. Не гидролизуется
Б. Фосфат кальция 2. Гидролиз по катиону
В. Хлорид цинка 3. Гидролиз по катиону
Г. Хлорид бария 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3121.
4. Название соли Способность к гидролизу
А. Бромид меди 1. Не гидролизуется
Б. Бромид железа (II) 2. Гидролиз по катиону
В. Сульфит натрия 3. Гидролиз по катиону
Г. Ацетат калия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2233.
5. Название соли Способность к гидролизу
А. Сульфат цинка 1. Не гидролизуется
Б. Сульфид натрия 2. Гидролиз по катиону
В. Сульфат калия 3. Гидролиз по катиону
Г. Сульфит алюминия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2314.
6. Название соли Способность к гидролизу
А. Хлорид стронция 1. Не гидролизуется
Б. Сульфид калия 2. Гидролиз по катиону
В. Ацетат калия 3. Гидролиз по катиону
Г. Нитрат железа (II) 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1332.
7. Название соли Способность к гидролизу
А. Бромид никеля 1. Не гидролизуется
Б. Сульфид алюминия 2. Гидролиз по катиону
В. Карбонат натрия 3. Гидролиз по катиону
Г. Ацетат бария 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2433.
8. Название соли Способность к гидролизу
А. Хлорид марганца 1. Не гидролизуется
Б. Сульфид хрома 2. Гидролиз по катиону
В. Сульфит алюминия 3. Гидролиз по катиону
Г. Сульфид калия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2443.
9. Название соли Способность к гидролизу
А. Сульфат бария 1. Не гидролизуется
Б. Нитрат серебра 2. Гидролиз по катиону
В. Хлорид кобальта 3. Гидролиз по катиону
Г. Бромид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1122.
10. Название соли Способность к гидролизу
А. Бромид аммония 1. Не гидролизуется
Б. Бромид калия 2. Гидролиз по катиону
В. Сульфид хрома 3. Гидролиз по катиону
Г. Сульфат хрома 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2142.
11. Название соли Способность к гидролизу
А. Хлорид никеля 1. Не гидролизуется
Б. Йодид кобальта 2. Гидролиз по катиону
В. Сульфат алюминия 3. Гидролиз по катиону
Г. Нитрит калия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2223.
12. Название соли Способность к гидролизу
А. Нитрит натрия 1. Не гидролизуется
Б. Сульфид лития 2. Гидролиз по катиону
В. Сульфит калия 3. Гидролиз по катиону
Г. Нитрат аммония 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3332.
13. Название соли Способность к гидролизу
А. Нитрат бария 1. Не гидролизуется
Б. Нитрат кобальта 2. Гидролиз по катиону
В. Хлорид марганца 3. Гидролиз по катиону
Г. Нитрат свинца 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1222.
14. Название соли Способность к гидролизу
А. Сульфат цезия 1. Не гидролизуется
Б. Нитрат рубидия 2. Гидролиз по катиону
В. Хлорид магния 3. Гидролиз по катиону
Г. Бромид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1122.
15. Название соли Способность к гидролизу
А. Нитрат серебра 1. Не гидролизуется
Б. Хлорид натрия 2. Гидролиз по катиону
В. Ацетат калия 3. Гидролиз по катиону
Г. Хлорид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1132.
16. Название соли Способность к гидролизу
А. Сульфат олова 1. Не гидролизуется
Б. Силикат натрия 2. Гидролиз по катиону
В. Сульфид алюминия 3. Гидролиз по катиону
Г. Йодид стронция 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2341.
17. Название соли Способность к гидролизу
А. Нитрит рубидия 1. Не гидролизуется
Б. Бромид цезия 2. Гидролиз по катиону
В. Карбонат алюминия 3. Гидролиз по катиону
Г. Ацетат калия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3143.
18. Название соли Способность к гидролизу
А. Хлорид цезия 1. Не гидролизуется
Б. Карбонат калия 2. Гидролиз по катиону
В. Ацетат бария 3. Гидролиз по катиону
Г. Нитрат серебра 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1331.
19. Название соли Способность к гидролизу
А. Ацетат рубидия 1. Не гидролизуется
Б. Фосфат калия 2. Гидролиз по катиону
В. Сульфид хрома 3. Гидролиз по катиону
Г. Бромид лития 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3341.
20. Название соли Способность к гидролизу
А. Сульфид алюминия 1. Не гидролизуется
Б. Карбонат алюминия 2. Гидролиз по катиону
В. Хлорид цинка 3. Гидролиз по катиону
Г. Нитрат марганца 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 4422.
21. Название соли Способность к гидролизу
А. Сульфид цезия 1. Не гидролизуется
Б. Йодид лития 2. Гидролиз по катиону
В. Сульфид хрома 3. Гидролиз по катиону
Г. Нитрат аммония 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3142.
22. Название соли Способность к гидролизу
А. Сульфат рубидия 1. Не гидролизуется
Б. Йодид бария 2. Гидролиз по катиону
В. Нитрит натрия 3. Гидролиз по катиону
Г. Карбонат алюминия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1134.
23. Название соли Способность к гидролизу
А. Карбонат железа (III) 1. Не гидролизуется
Б. Нитрит лития 2. Гидролиз по катиону
В. Карбонат хрома 3. Гидролиз по катиону
Г. Сульфат цезия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 4341.
24. Название соли Способность к гидролизу
А. Фосфат натрия 1. Не гидролизуется
Б. Сульфит алюминия 2. Гидролиз по катиону
В. Йодид стронция 3. Гидролиз по катиону
Г. Нитрат хрома 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3412.
25. Название соли Способность к гидролизу
А. Йодид никеля 1. Не гидролизуется
Б. Сульфид алюминия 2. Гидролиз по катиону
В. Нитрат кобальта 3. Гидролиз по катиону
Г. Хлорид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2422.
26. Название соли Способность к гидролизу
А. Бромид марганца 1. Не гидролизуется
Б. Сульфат цинка 2. Гидролиз по катиону
В. Силикат натрия 3. Гидролиз по катиону
Г. Нитрит цезия 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2233.
27. Название соли Способность к гидролизу
А. Сульфат рубидия 1. Не гидролизуется
Б. Йодид лития 2. Гидролиз по катиону
В. Сульфат марганца 3. Гидролиз по катиону
Г. Бромид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 1122.
28. Название соли Способность к гидролизу
А. Нитрат кобальта 1. Не гидролизуется
Б. Нитрит лития 2. Гидролиз по катиону
В. Сульфат никеля 3. Гидролиз по катиону
Г. Бромид хрома 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 2322.
29. Название соли Способность к гидролизу
А. Карбонат алюминия 1. Не гидролизуется
Б. Сульфат никеля 2. Гидролиз по катиону
В. Сульфид хрома 3. Гидролиз по катиону
Г. Йодид цинка 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 4242.
30. Название соли Способность к гидролизу
А. Ацетат цезия 1. Не гидролизуется
Б. Карбонат хрома 2. Гидролиз по катиону
В. Йодид никеля 3. Гидролиз по катиону
Г. Бромид кобальта 4. Полный гидролиз (по катиону и по аниону)
Правильный ответ - 3422.
- Задания по теме (с ответами)
cleverpenguin.ru
Раствор - сульфат - хром
Раствор - сульфат - хром
Cтраница 2
К 0 10 л 20 % - ного раствора хлорида бария ( р 1203 кг / м3) прибавлен раствор сульфата хрома. [16]
Растворы исходных солей в реакции ( 1), вследствие гидролиза последних, имеют различные значения рН: раствор олеиновокислого натрия имеет щелочную реакцию, а раствор сульфата хрома кислотную. [17]
Раствор сульфата хрома дополнительно фильтруют 2 и направляют в сгуститель 6, где добавляют католит и выдерживают до 10 суток при 30 С для превращения хрома снова в фиолетовую модификацию. Около 80 % хрома переходит в аммонийные квасцы; их отфильтровывают 7, растворяют 8, фильтруют 2 и подают в катодные пространства электролизеров. [19]
Какие вещества образуются при гидролизе сульфата и сульфида хрома. Что следует добавить в раствор сульфата хрома ( III), чтобы уменьшить гид ролиз этой соли. [20]
Для производства элементов 373 Марс используют два типа электролитов. Этот же электролит, но с добавками HgCl2, раствора сульфата хрома или бихромата калия и крахмала является самозагустевающим и применяется для покрытия той стороны кабельной бумаги, которая в элементе обращена к цинковому аноду. Самозагустевающий электролит наносят на кабельную бумагу при 14 - 16 С в виде тонкого ( 0 5 - 0 7 мм) слоя пасты; затем бумагу с нанесенной пастой выдерживают при 90 С, при этом происходит ее загустевание. Элементы с таким вязким и нетекучим электролитом часто называют сухими. [21]
Навеску анализируемого вещества 0 05 г растирают. После полного растворения добавляют 2 мл 2 % - ного раствора сульфата хрома ( II), закрывают колбу, в крышку прибора помещают индикаторную бумагу и включают ток. Электролиз продолжают в течение 45 - 50 мин при напряжении на электродах 8 В. [22]
Несмотря на все это, можно довольно точно определить 1 - 2 мг пя-тиокиси ванадия в присутствии 30 мг окиси хрома. Для этого только необходимо ввести простую поправку, величину которой определяют, вливая перманганат в раствор сульфата хрома, занимающий такой же объем, какой имеет анализируемый раствор, и содержащий приблизительно такое же количество хрома. [23]
Какие продукты практически получаются при гидролизе сульфата и сульфида хрома ( III) в разбавленных водных растворах при комнатной температуре. Что следует добавить в раствор сульфата хрома, чтобы ослабить гидролиз этой соли. [24]
Какие продукты практически получаются при гидролизе сульфата и сульфида хрома. Что следует прибавить в раствор сульфата хрома, чтобы уменьшить гидролиз этой соли. [25]
Какие продукты практически получаются при гидролизе сульфата и сульфида хрома. Что следует добавить в раствор сульфата хрома, чтобы уменьшить гидролиз этой соли. [26]
Какие продукты практически получаются при гидролизе сульфата и сульфида хрома. Что следует добавить в раствор сульфата хрома, чтобы ослабить гидролиз этой соли. [27]
Ускорение процесса хромирования, наряду с получением беспористых покрытий хрома, является весьма актуальной задачей. Решение этих задач принципиально возможно двумя путями: применением для электролиза соединений хрома низшей валентности и увеличением выхода по току при электролизе шестивалентных соединений. Следует отметить в связи с первым направлением большое число исследований по электролизу растворов сульфата хрома, в частности работы японского исследователя Иоси-да с сотрудниками [8], который опубликовал большую серию сообщений, касающихся процесса хромирования в крепких растворах, содержащих сульфат аммония, мочевину и сульфат хрома. В результате этих исследований показано, что выход по току достигает 7 - 9 % в расчете на трехвалентный хром. [28]
Захватывают ушком платиновой проволоки кристаллик буры Na2B4O7 и сплавляют его в пламени горелки. Полученной прозрачной массе ( перлу) дают немного охладиться, после чего вносят его в раствор сульфата хрома. Вновь нагревают до сплавления. [29]
Навеску сплава ( 0 5 г) растворяют при нагревании в смеси 5 мл соляной и 5 мл азотной кислот. Аликвотную часть ( 5, 10 или 20 мл, в зависимости от содержания Re) помещают в герметически закрытую ячейку для потенциометрического титрования, через которую пропускают ток азота. Раствор нагревают до 80 С, вводят в ячейку 1 мг иодида калия и титруют раствором сульфата хрома, приливая вначале по 1 мл реактива, а при приближении к точке эквивалентности - по 0 1 мл. В присутствии ионов молибдена титрование продолжают до получения второго скачка потенциала. Объем раствора, израсходованный на титрование Re, соответствует разности объемов CrS04 между вторым и первым скачком потенциалов. [30]
Страницы: 1 2 3
www.ngpedia.ru
Опыт 6. Восстановительные свойства солей хрома (III)
Химия  Опыт 6. Восстановительные свойства солей хрома (III)
Опыт 6. Восстановительные свойства солей хрома (III)
просмотров - 369
Опыт 5. Гидролиз соединений хрома (III)
Опыт 3. Получение и свойства гидроксида хрома (III)
В две пробирки внести по 2 капли раствора соли сульфата хрома (III) и 2 н раствора гидроксида аммония до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида хрома (III) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия.
Раствор тетрагидроксохромата (III) натрия, полученного при добавлении избытка щелочи к Cr(OH)3, сохранить для опыта 6.
- Охарактеризовать внешний вид осадка гидроксида хрома (III)….
- составить уравнение реакции образования гидроксида хрома (III) в молекулярной и ионной форме:
Cr2(SO4)3 + Nh5OH →
- отметить, какие изменения происходят с осадком гидроксида хрома (III) при добавлении избытка соляной кислоты…………….., избытка гидроксида натрия…………..
- составить уравнение реакции взаимодействия гидроксида хрома (III) с соляной кислотой в молекулярной и ионной форме:
Cr(OH)3 + HCl → …
- составить уравнение реакции взаимодействия гидроксида хрома (III) с избытком гидроксида натрия в молекулярной и ионной форме:
Cr(OH)3 + NaOH → …
- ответить, какие кислотно-основные свойства проявляет гидроксид хрома (III).
а) Растворить в пробирке несколько кристаллов хлорида хрома (III) в дистиллированной воде. Измерить рН раствора с помощью универсальной индикаторной бумаги.
- окраска универсального индикатора…………………, рН = ……., среда………
- хлорид хрома (III) – соль, образованная ……………..кислотой и ……………. основанием, подвергается гидролизу по…………………
- составить уравнение гидролиза в молекулярной и ионной форме:
1 стадия: CrCl3 + h3O →
- Объясните, протекает частичный или полный гидролиз хлорида хрома (III)
б) В две пробирки внести по 2 капли раствора соли сульфата или хлорида хрома (III) и 2 н раствора карбоната натрия до образования осадка. В первую пробирку к осадку добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия.
- Отметить, как протекает реакция: активно или нет, выделяется………..
- Охарактеризовать внешний вид осадка ………………………
- Выделяется газ………
Составить уравнение реакции, учитывая, что протекает одновременно гидролиз по катиону и аниону:
CrCl3 + Na2CO3 + h3O →
- Объясните, протекает полный или частичный гидролиз……………
В пробирку с тетрагидроксохроматом (III) натрия, полученным в опыте 4, прибавить 3-5 капель раствора пероксида водорода (Н2О2). Нагреть смесь на водяной бане или очень осторожно подержать над пламенем спиртовки. Нагревание продолжать до изменения зеленой окраски.
- Отметить изменение окраски раствора на ………………..
- Составить уравнение реакции, учитывая, что образуется хромат натрия:
Na[Cr(OH)4] + NaOH + h3O2 → Na2CrO4 + h3O
Зеленый желтый
- Тетрагидроксохромат (III) натрия проявляет ………………………свойства
пероксид водорода (Н2О2) ……………………….свойства
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
Вывод:
Читайте также
Император Михаил, а затем и патриарх Фотий начинают непрерывно направлять Константина, как посланника Византии, к соседним народам для убеждения их в превосходстве византийского христианства над всеми другими религиями. Константин отправляется в Болгарию, обращает в... [читать подробенее]
Архитектура XX в. План 1. Башня III Интернационала В.Е. Татлина, 2. Музей Гуггенхейма Ф.-Л. Райта Памятник III Коммунистического Интернационала, или "Башня Татлина" - самый известный и грандиозный проект российского художника, архитектора и дизайнера В. Е. Татлина -... [читать подробенее]
Общее содержание мероприятий по охране лесов от пожаров Кроме рассмотренных выше мероприятий по защите и воспроизводству лесов при лесоустройстве осуществляется проектирование мероприятий по охране лесов от пожаров. Оно выполняется по трем направлениям: -... [читать подробенее]
I. Генеалогическая классификация индоевропейских языков А. Мейе. В СРАВНИТЕЛЬНО-ИСТОРИЧЕСКОМ ЯЗЫКОЗНАНИИ 1. Генеалогическая классификация индоевропейских языков А. Мейе. 2. Типологические классификации языков. 3. Проблема реконструкции индоевропейского... [читать подробенее]
Император Диоклетиан (284-305 гг.) в течение двадцати лет успешно боролся с нашествиями варваров и с христианами. В 305 году он отказался от власти и поселился в своем дворце в Далмации (Иллирии) на берегу Адриатического моря. В конце III в. н. э., при Диоклетиане, завершилось... [читать подробенее]
В схеме О.Каде выделяются некоторые существенные стороны перевода как коммуникативного акта. Акт перевода распадается на два взаимосвязанных коммуникативных акта – коммуникацию между отправителем и переводчиком и коммуникацию между переводчиком и получателем. При... [читать подробенее]
Поглощение нейтронов в тканях не имеет той специфики, которая была свойственна электронам и протонам, и интенсивность их потока быстро убывает с нарастанием глубины тканей. Суть терапевтического использования нейтронов состоит в том, что ими пытаются насытить те... [читать подробенее]
Тесты Ситуационные задачи. Алгоритмы лучевого исследования при патологии ЗЧС. Лучевые методы исследования эндокринной системы. 2. Рентгеноанатомия эндокринных желёз. 3. Лучевая семиотика заболеваний эндокринных желёз.Глава 1. ЛУЧЕВАЯ ТЕРАПИЯ... [читать подробенее]
На початок XVIII ст. мандрівники та вчені-натура-лісти накопичили великий фактичний матеріал про фізичні риси населення найвіддаленіших куточків земної кулі. Цей доробок вимагав осмислення та систематизації. Одним із перших свою класифікацію запропонував К. Лінней,... [читать подробенее]
Результати Основні сили, що вели боротьбу за владу в Києві в листопаді Проголошення Української Народної Республіки Восени 1917 р. ще більше зросла напруга в політика житті України. Тимчасовий уряд усіма силами перешкоджав Центральній Раді організувати владу в... [читать подробенее]
oplib.ru
Гидролиз солей хрома - Справочник химика 21
Опыт 4. Гидролиз солей хрома (III) [c.231]Гидролиз солей хрома (III) [c.260]
Гидролиз солей хрома [c.279]
ГИДРОЛИЗ СОЛЕЙ ХРОМА (III) [c.333]
Гидролиз солей хрома (П1). I. В пробирку внесите несколько кристаллов соли хрома (П1) и растворите их в воде. Чему равняется pH полученного раствора Напишите уравнения реакций гидролиза в молекулярной и ионной формах. Могут ли при гидролизе солей хрома (П1) образовываться многоядерные гидроксо-аквакомплексы и каково их строение [c.150]
Опыт 4. Гидролиз солей хрома(111) [c.289]Опыт 3. Гидролиз солей хрома (И1) [c.201]
Гидролиз солей хрома в присутствии соды и сульфида аммония [c.263]
Аналогично гидролизуются соли хрома (1П), железа (П1) и некоторых других металлов. [c.53]
Изложенные выше представления о процессе гидрр-лиза являются упрощенными. В настоящее время установлено, что в результате гидролиза солей с многозарядными ионами образуются сложные соединения, состав которых зависит как от природы иона, так и от концентрации растворов. Так, гидролиз солей хрома можно представить следующими уравнениями [c.110]
Гидролиз солей хрома происходит благодаря отщеплению протонов (в результате поляризации кислорода) молекулами воды, тесно связанными с ионами Сг +, поэтому повышение значений pH растворов солей хрома в результате магнитной обработки можно рассматривать как косвенное указание на уменьшение количества молекул воды, тесно связанных с ионами Сг +, т. е. на уменьшение гидратации. [c.24]
По таким схемам происходит гидролиз солей хрома, алюминия и других металлов, дающих слабые основания. Кислая реакция водных растворов солей может быть, таким образом, объяснена отщеплением протона от гидратированного иона металла. [c.390]
При крашении однохромовыми красителями создают специальные условия, чтобы замедлить комплексообразование (слабокислая ванна, применение медленно гидролизующихся солей хрома), однако решающее значение имеет строение самого красителя. [c.362]
Гидролиз солей хрома (III). 5. Восстановительные свойства солей хрома (III), 6. Хроматы и бихроматы. J. Получение малорастворимых рбматов. 8. Окислительные войства хроматов. 9. Получение и разложение пероксйд8 хрома [c.10]
Опыт 4. Гидролиз солей хрома(1М] [c.198]
Опыт 4. Налейте в пробирку полученный в опыте 3 раствор хромита, опустите пробирку в микробаню с кипящей водой (не рекомендуется нагревать раствор щелочи па голом огне). Дайте объяснение происходящему явлению. Гидролиз солей хрома П1, образованных сильными. кислотами, сопровождается увеличением концентрации ионов Н+ в растворе и образованием основных солей это первые стадии процесса гидролиза, который в данном случае не доходит до конца [c.244]
chem21.info