Строение электронных оболочек атомов. Строение электронных оболочек атомов хрома
1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Видеоурок: Строение атома: Строение электронных оболочек
Лекция: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Строение атома XX столетие является временем изобретения "модели строения атома". Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
XX столетие является временем изобретения "модели строения атома". Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
 Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) - 15.
Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) - 15.
Итак, атом состоит из протонов (p+), нейтронов (n0) и электронов (e-). Протоны и нейтроны образуют ядро атома, оно имеет положительный заряд. А электроны, совершающие перемещения вокруг ядра, «конструируют» электронную оболочку атома, имеющую отрицательный заряд.
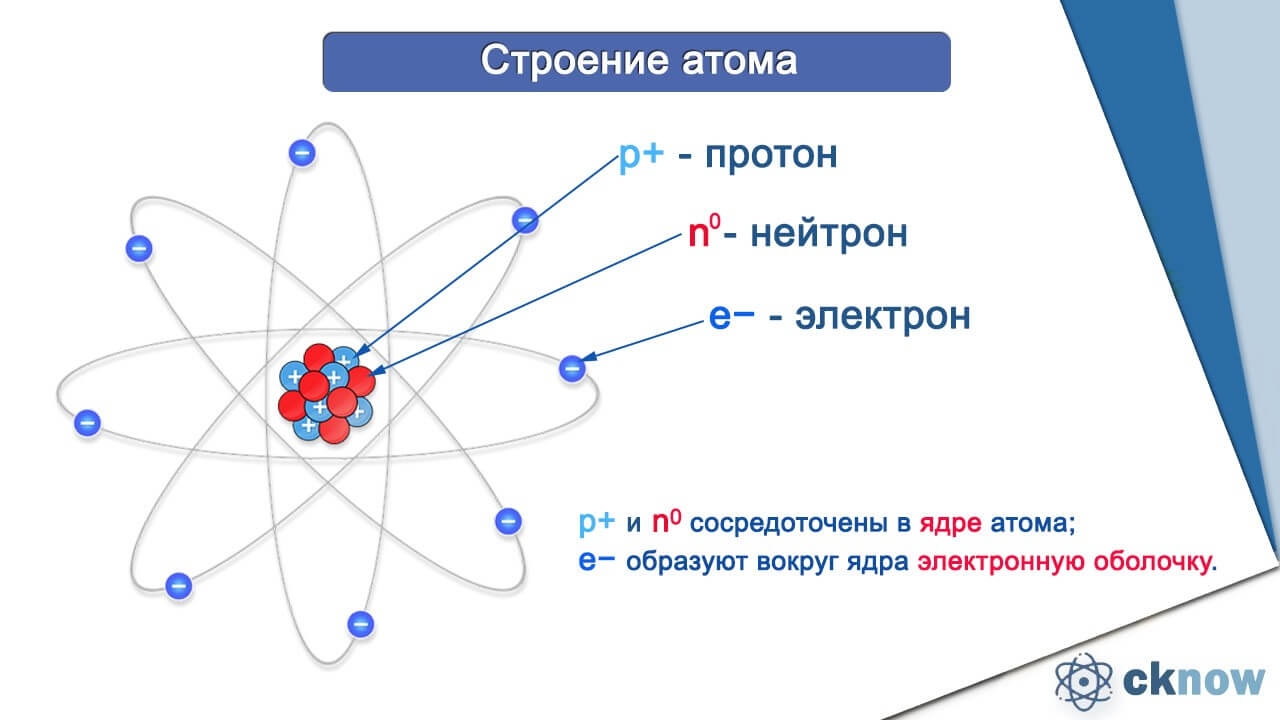
Сколько электронов в атоме? Это легко узнать. Достаточно посмотреть порядковый номер элемента в таблице.
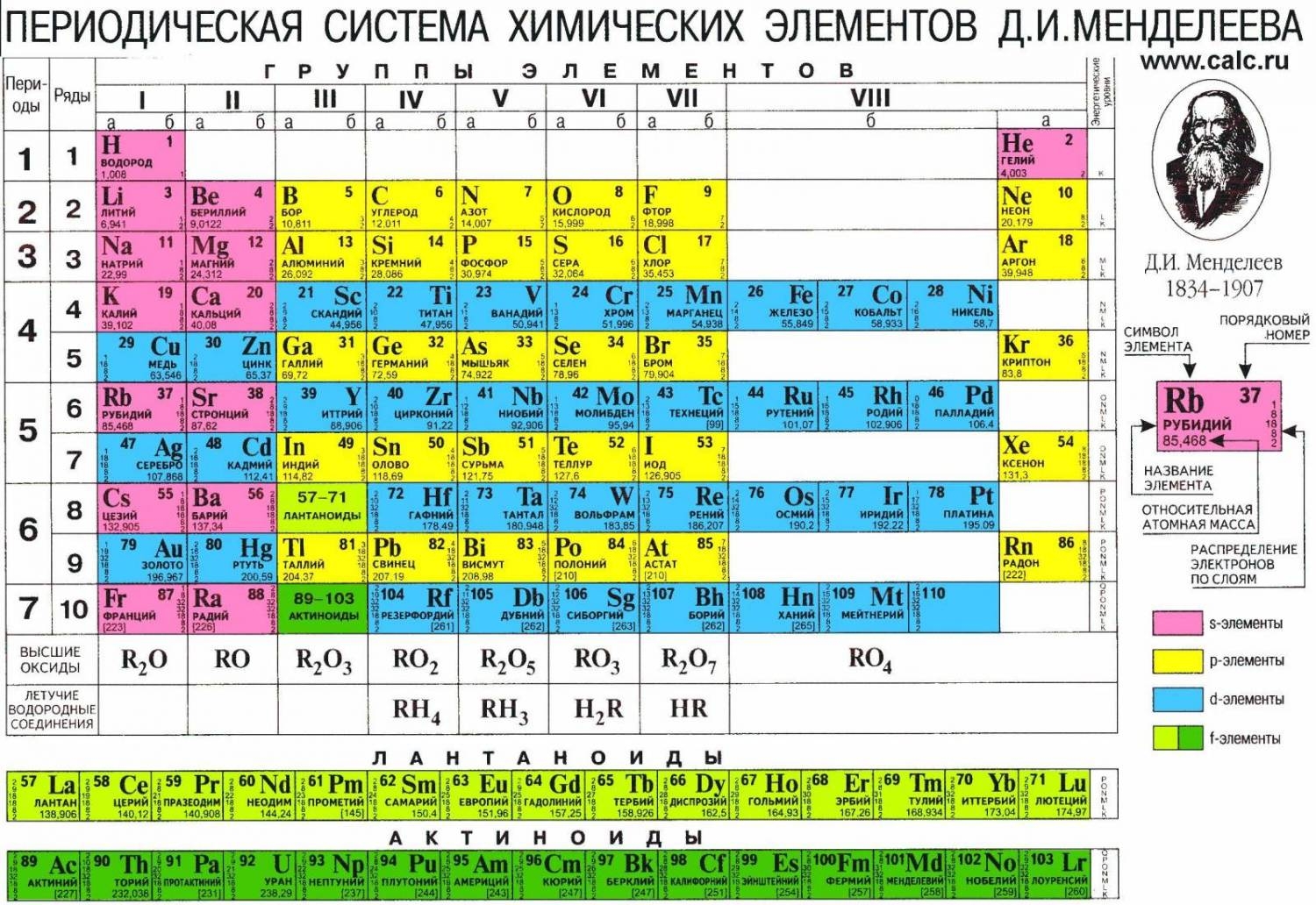
Так, число электронов фосфора равно 15. Количество электронов, содержащихся в оболочке атома, строго равно числу протонов, содержащихся в ядре. Значит и протонов в ядре атома фосфора 15.
Масса протонов и нейтронов, составляющих массу ядра атома, одинакова. А электроны меньше в 2000 раз. Это означает что вся масса атома сосредоточена в ядре, массой электронов пренебрегают. Массу ядра атома мы также можем узнать из таблицы. Посмотрите изображение фосфора в таблице. Внизу мы видим обозначение 30, 974 – это и есть масса ядра фосфора, его атомная масса. При записи мы округляем эту цифру. Исходя из сказанного, запишем строение атома фосфора следующим образом:
(внизу слева написали заряд ядра – 15, вверху слева округленное значение массы атома – 31).
Ядро атома фосфора:
(внизу слева пишем заряд: протоны имеют заряд равный +1, а нейтроны не заряжены, то есть заряд 0; вверху слева масса протона и нейтрона, равная 1 – условная единица массы атома; заряд ядра атома равен числу протонов в ядре, значит р=15, а число нейтронов нужно посчитать: из атомной массы вычесть заряд, т.е. 31 – 15 = 16).
Электронная оболочка атома фосфора включает в себя 15 отрицательно заряженных электронов, уравновешивающих положительно заряженные протоны. Поэтому, атом – электронейтральная частица.
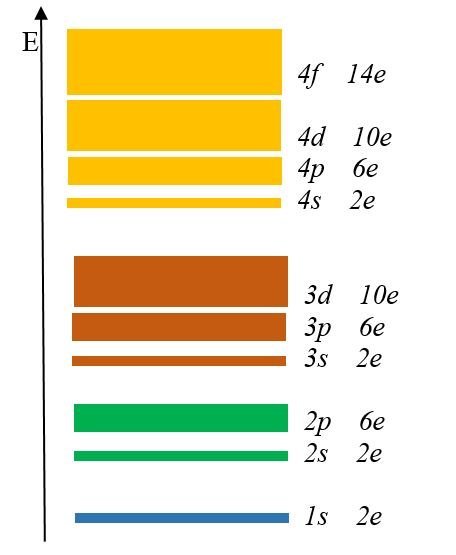
Энергетические уровниРис.1 Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие - то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие - то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.Вы можете заметить, как по мере удаления от ядра увеличивается объем слоя. Следовательно, чем дальше слой от ядра, тем больше в нем электронов.
Рис. 2
 Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня.
Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня. Получим, что первый уровень содержит всего 2 электрона, второй – 8, третий – 18, четвертый – 32.
Каждый энергетический уровень содержит в себе подуровни. Их буквенные обозначения: s-, p-, d- и f-. Посмотрите на рис. 2:Здесь изображены подуровни. Е – это энергия (вспомните, что она возрастает по мере удаления электрона от ядра).
Разным цветом обозначены энергетические уровни, а полосками разной толщины подуровни.
Самый тонкий подуровень обозначается буквой s. 1s – это s-подуровень первого уровня, 2s – это s-подуровень второго уровня и так далее.
На втором энергетическом уровне появился p-подуровень, на третьем – d-подуровень, а на четвертом f-подуровень.
Запомните увиденную закономерность: первый энергетический уровень включает одну s-подуровень, второй два s- и p- подуровня, третий три s-, p- и d-подуровня, а четвертый уровень четыре s-, p-, d- и f-подуровня.
На s-подуровне могут находится только 2 электрона, на p-подуровне- максимум 6 электронов, на d-подуровне - 10 электронов, а на f-подуровне до 14 электронов.
Электронные орбиталиОбласть (место) где может находится электрон называется электронным облаком или орбиталью. Имейте ввиду, что говорится о вероятной области нахождении электрона, поскольку скорость его движения в сотни тысяч раз больше скорости движения иглы швейной машинки. Графически эта область изображается в виде ячейки:
В одной ячейке может находится два электрона. Судя по рисунку 2 можно сделать вывод о том, что s-подуровень, включающий не более двух электронов может содержать только одну s-орбиталь, обозначается одной ячейкой; p-подуровень имеет три р-орбитали (3 ячейки), d-подуровень пять d-орбиталей (5 ячеек), а f-подуровень семь f-орбиталей (7 ячеек).
Форма орбитали зависит от орбитального квантового числа (l - эль) атома. Атомный энергетический уровень, берет начало с s – орбитали, имеющей l = 0. Представленная орбиталь имеет сферическую форму. На уровнях, идущих после s - орбитали, образуются p – орбитали с l = 1. P - орбитали напоминают форму гантели. Орбиталей, имеющих данную форму, всего три. Каждая возможная орбиталь содержит в себе не больше 2 – ух электронов. Далее располагаются более сложного строения d-орбитали (l = 2), а за ними f-орбитали (l = 3).
Рис. 3 Форма орбиталей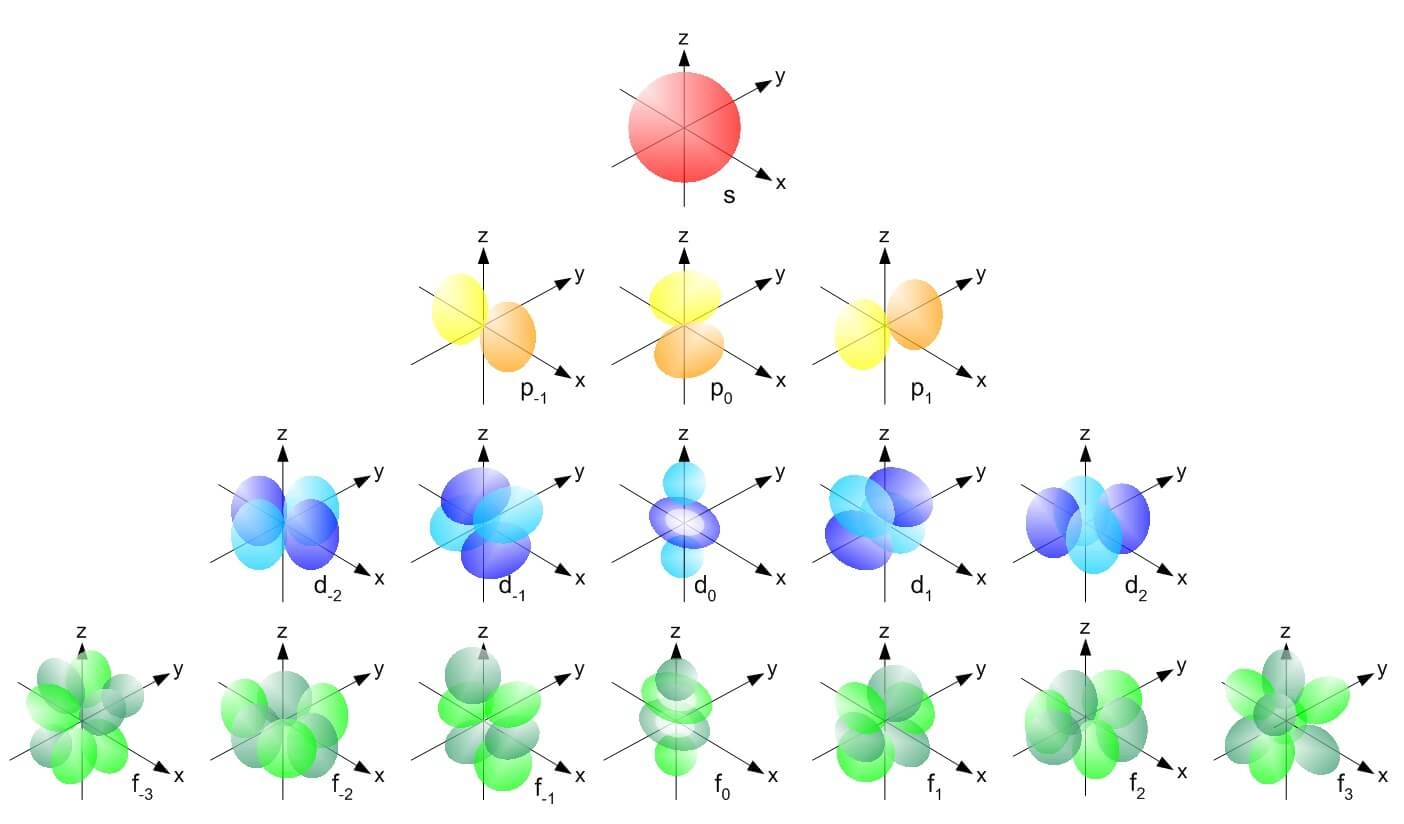 Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:Если же в орбитали два электрона, то они имеют два направления: стрелкой вверх и стрелкой вниз, т.е. электроны разнонаправленны:
Такое строение электронов называется валентным.
Существуют три условия наполнения атомных орбиталей электронами:
1 условие: Принцип минимального количества энергии. Заполнение орбиталей начинается с подуровня, имеющего минимальную энергию. Согласно данному принципу подуровни заполняются в таком порядке: 1s22s22p63s23p6 4s23d104p65s24d105р66s25d14f14... Как мы видим, в некоторых случаях электрону энергетически выгоднее занять место в подуровне вышележащего уровня, хотя подуровень нижележащего уровня не заполнен. Например, валентная конфигурация атома фосфора выглядит так:
Рис. 4

2 условие: Принцип Паули. Одна орбиталь включает 2 электрона (электронную пару) и не больше. Но возможно и содержание всего одного электрона. Его именуют неспаренным.
3 условие: Правило Хунда. Каждую орбиталь одного подуровня сначала заполняют по одному электрону, затем в них добавляются по второму электрону. В жизни мы видели аналогичную ситуацию, когда незнакомые пассажиры автобуса сначала занимают по одному все свободные сидения, а потом рассаживаются по два.
Электронная конфигурация атома в основном и возбужденном состоянии
Энергия атома, находящегося в основном состоянии, наименьшая. Если атомы начинают получать энергию из вне, к примеру, когда вещество нагревается, то они из основного состояния переходят в возбужденное. Этот переход возможен при наличии свободных орбиталей, на которые могут переместиться электроны. Но это временно, отдавая энергию, возбужденный атом возвращается в своё основное состояние.
Закрепим полученные знания на примере. Рассмотрим электронную конфигурацию, т.е. сосредоточение электронов по орбиталям атома фосфора в основном (невозбужденном состоянии). Еще раз обратимся к рис. 4. Итак, вспомним, что атом фосфора имеет три энергетических уровня, которые изображаются полудугами: +15)))
Распределим, имеющиеся 15 электронов на эти три энергетических уровня:Такие формулы называются электронными конфигурациями. Есть еще электронно – графические, они иллюстрируют размещение электронов внутри энергетических уровней. Электронно – графическая конфигурация фосфора выглядит так: 1s2 2s2 2p6 3s2 3p3 (здесь большие цифры – это номера энергетических уровней, буквы – это подуровни, а маленькие цифры – количество электронов подуровня, если их сложить, получится число 15).
В возбужденном состоянии атома фосфора 1 электрон переходит с 3s-орбитали на 3d-орбиталь, а конфигурация выглядит так: 1s2 2s2 2p6 3s1 3p33d1.Строение электронных оболочек атомов
Рассмотрим строение отдельно взятого электронного уровня (слоя). Начиная со значения главного квантового числа n = 2, электронные уровни (L, M, N, O, P, Q - слои) подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи электрона с ядром. Число подуровней равно значению главного квантового числа, но не превышает четырех. Таким образом, 1 уровень имеет один подуровень, 2 – два, третий – 3, четвертый – 4 подуровня. Подуровни, в свою очередь, составлены из орбиталей. Принято подуровни обозначать латинскими буквами: s- первый, ближайший к ядру подуровень каждого энергетического уровня: он состоит из одной s-орбитали; p- второй подуровень, он состоит из трех р-орбиталей, d- третий подуровень, он состоит из пяти d-орбиталей; f- четвертый подуровень, содержит семь f-обиталей. Таким образом, для каждого значения n имеется (2l + 1) орбиталей.
Выше показано, что состояние электронов можно описать набором четырёх квантовых чисел, но для полного объяснения строения электронных оболочек атомов нужно знать еще три основных положения:
1) принцип В. Паули. В 1925 г. швейцарский физик В. Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное принципом Паули (или запретом Паули): в атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируют так: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml, и ms должно обязательно различаться. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2, другой с ms= -1/2. Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l, ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml = 0 и msможет иметь любое из двух значений: +1/2 или –1/2. Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны, прежде всего, отличаются побочным квантовым числом l, принимающим значения от 0 до (n - 1) . При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l, ml соответствует два разных значения проекции спина ms. Если на орбитале находится один электрон, то он называется неспаренным, если два, то это спаренные электроны. Принцип Паули поясняется формулой N = 2n2. А именно: если например, на третьем уровне (n = 3) содержится 32 = 9 орбиталей, а на каждой орбитали по 2 электрона, то максимальное число электронов составит 2∙32 = 18.
Иллюстрация принципа Паули
2) правило Ф. Хунда (Гунда). Заполнение ячеек электронами происходит по правилу Гунда: в пределах подуровня электроны располагаются сначала каждый в отдельной ячейке (в виде так называемых «холостых» - валентных электронов), затем, когда все ячейки данного подуровня окажутся занятыми, начинается уплотнение электронов вновь поступающими, т. е. происходит их «спаривание». Иначе говоря, электроны в пределах данного подуровня (S, P, D, F) Заполняются таким образом, чтобы суммарный спин был максимальным. Например, если в трех р-ячейках необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке: в этом случае суммарный спин равен 3/2.
3) принцип наименьшей энергии (правило В.М. Клечковскогоили правило (n+l)). Последовательность заполнения атомных орбиталей в зависимости от значения главного и орбитального квантовых чисел изучена отечественным ученым Всеволодом Маврикиевичем Клечковским (1900-1972). Он установил, что энергия электрона возрастает по мере увеличения суммы квантовых чисел (n + l).
Первое правило В.М. Клечковского (1952): последовательность заполнения определяется возрастанием суммы n + l: сначала заполняется тот подуровень, где сумма (n + l) меньше.
Второе правило В.М. Клечковского: при равенстве сумм (n + l) заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа, то есть сначала заполняется тот подуровень, для которого n меньше, а l больше, а потом уже подуровень с большим n.
studfiles.net
Строение электронной оболочки атома
Строение электронной оболочки атомаПлан
1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома: принцип Паули, принцип наименьшей энергии, правило Клечковского, правило Гунда.
3. Определения понятий: «электронная оболочка», «электронное облако», «энергетический уровень», «энергетический подуровень», «электронный слой».
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного химического элемента. Согласно квантовой теории каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). С увеличением порядкового номера энергия орбиталей увеличивается.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
| Энергетическийуровень | Значения главногоквантового числа n | Значения побочногоквантового числа l |
| K | 1 | 0 (s) |
| L | 2 | 0, 1 (s, p) |
| M | 3 | 0, 1, 2 (s, p, d) |
| N | 4 | 0, 1, 2, 3 (s, p, d, f) |
Орбитали, для которых l = 1, имеют форму вытянутой восьмерки и называются р-орбиталями. Они содержатся на всех энергетических уровнях, кроме первого (К).
Орбитали, для которых l = 2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l = 3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Espd f, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантовых чисел, но отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число ml характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l = 0, ml= 0 – одна орбиталь;
p-подуровень: l = 1, ml= –1, 0, +1 – три орбитали;
d-подуровень: l = 2, ml= –2, –1, 0, +1, +2 – пять орбиталей.
Таким образом, число орбиталей на подуровне равно 2l + 1. Общее число орбиталей на одном энергетическом уровне – n2. Общее число электронов на одном энергетическом уровне – 2n2. Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуются тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число ms, спин (от англ. spin – кружение, вращение) – характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: .
Заполнение электронной оболочки атома подчиняется следующим законам.
П р и н ц и п П а у л и. В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
П р и н ц и п н а и м е н ь ш е й э н е р г и и. Основное (устойчивое) состояние атома характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
П р а в и л о К л е ч к о в с к о г о. Электроны заполняют энергетические подуровни в порядке увеличения их энергии. Этот порядок определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
П р а в и л о Г у н д а. На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Например, электронные формулы магния, железа и теллура имеют вид:
Mg(+12) 1s22s22p63s2;
Fe(+26) 1s22s22p63s23p64s23d6;
Te(+52) 1s22s22p63s23p64s23d104p65s24d105p4.
Исключения в четвертом периоде составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10. Таким образом, электронные формулы атомов хрома и меди имеют вид:
Cr(+24) 1s22s22p63s23p64s13d5;
Cu(+29) 1s22s22p63s23p64s13d10.
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы, например:
Тест по теме «Строение электронной оболочки атома»
(Возможно несколько правильных ответов)
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, это:
а) магний; б) углерод; в) сера; г) цинк.
2. Электронная конфигурация иона Cl+ в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
а) [Ne] 3s23p5; б) [Ne] 3s13p6;
в) [Ne] 3s23p4; г) [Ne] 3s23p6.
3. Элементу 2-го периода для завершения внешнего уровня не хватает трех электронов. Этот элемент:
а) бор; б) углерод; в) азот; г) фосфор.
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
а) 4d6; б) 2s22p4; в) 3s23p4; г) 3s13d5.
5. Чему равно орбитальное квантовое число 3р-электрона?
а) 1; б) 3; в) 0; г) +1/2.
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
а) 1; б) 4; в) 5; г) 6.
7. Электронную конфигурацию внешнего электронного слоя 3s23p6 имеют соответственно атом и ионы:
а) Ar, Cl–, S2–; б) Kr, K+, Ca2+;
в) Ne, Cl–, Ca2+; г) Ar, Cl–, Ca2+.
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
а) 1; б) 2; в) 4; г) 6.
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
а) 2, 8, 12, 2; б) 2, 8, 8, 6;
в) 2, 8, 13, 1; г) 2, 8, 14, 0.
10. Ионы Ag+ и Cs+ имеют соответственно следующие электронные формулы внешнего и предвнешнего энергетических уровней:
а) ...4d105s0 и ...5p66s1; б) ...4d95s1 и ...5p66s0;
в) ...4d105s0 и ...5p66s0; г) ...4d105s0 и ...5p56s1.
lib2.podelise.ru