Справочник химика 21. Состав хрома
Состав сплавов хрома - Справочник химика 21
Защита металлов от газовой коррозии может быть достигнута различными способами защитные покрытия, уменьщение агрессивности газовой среды и др. Наиболее эффективным способом защиты от окисления при высоких температурах является жаростойкое легирование, т. е. введение в состав сплава компонентов, повышающих его жаростойкость. Основными элементами, способствующими созданию защитного слоя на обычных железоуглеродистых, никелевых и других сплавах, являются хром, алюминий и кремний. Эти элементы окисляются при высоких температурах на воздухе легче, чем легируемый металл, и образуют хорошую защитную окалину. [c.146] Металлический хром находит разнообразное применение. Он входит в качестве основного легирующего компонента в состав многих важнейших видов конструкционных и нержавеющих сталей (хромистые, хромоникелевые стали). Некоторые сплавы хрома с цветными металлами (хромоникель, хромаль, фехраль и др.) являются основным материалом для изготовления нагревательных элементов лабораторных и производственных электропечей некоторых типов, бытовых электронагревательных приборов. Хром широко используется для поверхностного покрытия металлических изделий (хромирование) с целью повышения их стойкости к коррозии или для увеличения их поверхностной твердости и уменьшения поверхностного износа трущихся деталей. Хромирование применяется также для улучшения внешнего вида изделий и в других целях. [c.142]Создание сплавов, стойких к коррозии,— введение в состав стали хрома, марганца, никеля дает возможность получить нержавеющую сталь, находящую широкое применение в промышленности. [c.324]
Используемые в технике сплавы содержат больше двух компонентов. В состав большинства марок стали входят наряду с железом и углеродом так называемые легирующие элементы — Мп, Сг, N1, 5 и др. Несколько элементов обычно входит в состав сплавов на основе меди, олова, алюминия и многих других цветных металлов. Для описания фазовых равновесий в реальных сплавах во многих случаях достаточно знания диаграмм состояния для систем, состоящих из трех основных компонентов, например, для нержавеющих сталей из железа, хрома и никеля. [c.180]
Легирование металлов. Для улучшения свойств металлов, в том числе для обеспечения их коррозионной стойкости, в состав сплавов вводят различные вещества (легирующие добавки). Так, коррозионная стойкость стали может быть повышена введением хрома, никеля, молибдена. Коррозионная стойкость меди возрастает при добавлении к ней бериллия и алюминия. Легирование с целью повышения коррозионной стойкости применяется также для алюминия, к которому добавляют молибден, хром или никель. [c.219]
Подобным же образом можно рассчитать состав смеси окислов д ш получения других сплавов хрома, например Сг—Мо—Мп, Сг—Мп—Со, Сг—Мп, Сг—V—Со, Сг—V—N1 и т, д. [c.39]
При взаимодействии с азотом на поверхности металлов и сплавов протекает активная адсорбция при этом скорость диффузии азота тем выше, чем больше сродство входящих в состав сплава элементов с азотом. Наибольшим сродством к азоту обладают титан и алюминий, значительно меньшим — хром, марганец, молибден, железо и кобальт. [c.84]
На коррозионную стойкость и механическую прочность шва большое влияние оказывает режим сварки. Рекомендуется производи ь сварку короткой дугой длиной 2—3 мм. При сварке длинней дугой и при большой силе тока наблюдается значительное выгорание хрома и титана, входящих в состав сплава, что существенно понижает его коррозионную стойкость. [c.170]
Оптимальный состав сплава № 2 установлен на основе исследования диаграммы фазового равновесия железо—хром—алюминий и диаграмм состав — свойство жаростойкости, удельного электросопротивления, твердости, механических свойств и обрабатываемости сплавов при комнатной и высоких температурах [1,2]. [c.316]
Теория окисления железо-хромо-алюминиевых сплавов разработана И. И. Корниловым [1]. Содержанием теории окисления являются следующие процессы. Тройной твердый раствор аз хрома и алюминия в железе взаимодействует с кислородом воздуха при нагреве при этом на поверхности металла образуется тонкая прочная окисная пленка с желто-зеленоватым оттенком, она состоит из окислов железа, хрома и алюминия. При температурах выше 700° алюминий, входящий в состав сплава, начинает взаимодействовать с окислами железа и хрома в результате этих реакций, протекающих в твердом состоянии, на поверхности металла образуются шпинели слож- [c.318]
Алюминий, входящий в состав сплава, расходуется на непосредственное взаимодействие с кислородом воздуха и на восстановление окислов железа и хрома. В результате этих реакций содержание алюминия в поверхностных слоях уменьшается, пополнение же протекает за счет самодиффузии алюминия из внутренних слоев к внешнему, т. е. к поверхности. Скорость самодиффузии алюминия зависит от содержания его в сплаве и содержания хрома. С увеличением содержания хрома в сплавах до 25—21%пщ постоянном содержании алюминия, равном 5%, и в другом случае при увеличении содержания алюминия до 10% при постоянном содержании хрома, например, 15—17 и 25—27%, расход алюминия на окисление уменьшается и составляет, соответственно содержанию хрома, при содержании в сплавах Ъ% А1с 45 и 28%, а при содержании в тех же сплавах 10% А1—20 и 6%. [c.319]
I. Оптимальный состав железо-хромо-алюминиевого сплава №2, установленный на основе диаграммы фазового равновесия и диаграммы состав [c.332]
Химический состав сплава № 2 установлен на основании данных диаграммы состояния системы железо — хром — алю- миний [1, 2] и диаграмм состав — свойство сплавов этой 1. Микроструктура сплава №32, системы. Сплав № 2 представляет собой тройной твердый раствор хрома и алюминия в а-железе и имеет однородное полиэдрическое строение (рис. 1) по своей природе являет[c.169]
Щуп должен быть изготовлен из железо-хромо-никелевого сплава инконель 600 или другого сплава с эквивалентными физическими и термическими характеристиками. Номинальный состав сплава инконель (масс.%) 72 мин. №+Со 14-17 Сг, 6-10 Ре 0,15 макс. С 1,0 макс. Мп 0,015 макс. 8 0,5 макс. 51 0,5 макс. Си. [c.685]
Для изготовления аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхпости изделия некоторыми металлами, обладающими защитным действием. К, таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образование.м на их поверхносги [c.554]
В Институте физической химии АН СССР проф. А. Т. Ваграмян разработал принципиально новый способ электроосаждения сплава хрома, позволяющий получить на катоде пленку, в состав которой, помимо хромат-ионов, входят продукты неполного восстановления. Осаждение металлического хрома происходит не из ионов раствора, а из продуктов, образующих пленку. В связи с этим осажденный металл вводится в электролит в качестве аниона. Такой способ позволил получать сплавы хрома с марганцем, селеном или рением, отличающиеся жаростойкостью [91]. [c.129]
Сплав хрома (85%) с марганцем (15%). Состав электролита (в г/л) [c.129]
В сплавах титана с -стабилизирующими элементами могут происходить различные превращения -фазы, например при легировании титана молибденом и хромом кроме a-превраще-ния может происходить и эвтектоидный распад и превращение в промежуточную метастабильную со-фазу, которая является первым продуктом распада -фазы в температурном интервале 200—500 °С [523]. Не вызывает сомнений, что фазовый состав сплавов титана даже при неизменном химическом составе должен оказывать существенное влияние на устойчивость к агрессивному воздействию среды. Это влияние могут, прежде всего, вызывать две причины во-первых, различная растворимость легирующих элементов в а- и -фазах, что может приводить к существенной химической неоднородности сплава во-вторых, неодинаковая энергия связи атомов титана в разных кристаллических решетках. [c.203]
Жаростойкое легирование, т. е. введение в состав сплава компонентов, понижающих скорость окисления металла. Такими компонентами для сплавов на железной основе прежде всего являются хром, алюминий и кремний. [c.37]
| Рис. 120. Влияние концентрации селеновой ( ) и селенисто11 (2) кислот на состав сплава хром — селен 1 -.= 500 ма см , 20° С | 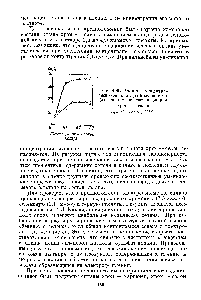 |
Основными способами защиты от газовой коррозии являются легирование металлов, создание защитных покрытий и замена агрессивной газовой среды. Для изготовления аппаратуры, подвергающейся действию коррозионно-активных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования. Для защиты используют и неметаллические покрытия, изготовленные из керамических и керамико-металлических (керметы) материалов. [c.687]
Легирование металлов — эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компош итов применяют хром, никель, вольфрам и др. Широкое применение нашло легирование [c.234]
В последнее время широко используются нихромы — сплавы на основе N1, например Х20Н80, в которых вообще отсутствует железо. Упрочненные нихромы (Мо, Т1, В, 51) представляют собой конструкционные материалы, сохраняющие работоспособность до 1373—1473 К. Хром входит в состав медных сплавов, например, сплав БрХ0,8 — хромистая бронза — представляет собой упрочняемый сплав, сохраняющий электрическую проводимость чистой меди из него изготовляют электроды контактных сварочных машин, трущиеся контакты и другие подобные специальные изделия. Наконец, хром входит в состав сплавов на основе титана, алюминия и специальных сплавов, применяемых в электропромышленности. Широко используются антикоррозионные, декоративные и упрочняющие поверхностный слой покрытия из хрома. [c.342]
Для нол> чения сплава хрома с маргапцем, как показывает расчет по уравнению (5), нужно взять не менее 34% двуокиси марганца (Л = 0,85) и 66% окиси хрома. Эта смесь окис.чов хорошо восстанавливается только при пользовании чистой двуокисью марганца. Ввиду того что состав продажной двуокиси марганца редко в точности отвечает теоретическому, смесь [c.33]
Наибольший интерес представляют углеродистые стали с добавкой хрома, который значительно повышает коррозионную стойкость материала. Хром относится к самопассивирующим материалам. Вследствие пассивации хрома, входящего в состав сплава, на поверхности последнего образуется пассивная пленка (защитный слой оксидой шш адсорбированного кислорода), существенно повышающая коррозионную стойкость сплава. Установлено, что для образования нержавеющей стали минимальное содержание хрома (по весу) Должно быть не ниже 13-15 %. Стали, содержащие 36 % хрома, приобретают коррозионную Стойкость даже в таких агрессивных средах, как царская водка. Однако в неокисляющихся агрессивных средах зацщтная пленка на поверхности Хромистых сталей не образуется, поэтому в растворах серной и соляной кислот такие стали активно корродируют. [c.39]
| Рис. 9. Жаростойкость при 1200°С ( i ), фазовый и химический состав окалины ( 2 ) в зависимости от содержания в сплаве хрома (длительность окисления -8ч) а - NiO 6- NiO + G,0, в - Ni r,0 г - G,0, | 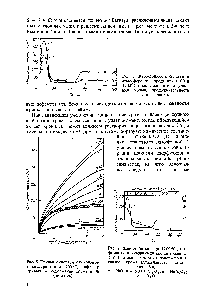 |
С увеличением FeS04-7h3 0 при тех же условиях электролиза содержание железа в сплаве увеличивается от 60 до 90%, г х возрастает до 44%, но качество покрытий ухудшается. При содержании железа в сплаве, равном 85—90%, покрытие темнеет на воздухе и при толщинах 15 — 20 мкм. отслаивается от подложки. Наилучщий состав сплава Fe — Сг обеспечивается при 25 — 35% хрома. [c.105]
Железо-хромо-алюминиевый сплав № 2 (Х25Ю5 по ГОСТу № 5632—51) является тройным ферритовым твердым раствором сплав содержит 23— 26% Сг, 4,5—5,5% А1, 0,5% Т1 и примеси С, 51, Мп, N1, 8, Р, вошедшие в состав сплава с шихтой в процессе его плавки. Основными составляющими сплава являются железо, хром и алюминий. В свободном, т. е. несплавлен-ном состоянии, они представляют собой поликристаллические тела. Основные физические и механические свойства этих металлов и сплава приведены в работах [1—3]. [c.316]
Стойкие против коррозии сплавы. В борьбе с коррозией большую роль играют специальные сплавы металлов, стойкие к коррозии. Введение в состав стали хрома, марганца, никеля дает возможность получать не-ржавеюпдую сталь. Нержавеющая сталь находит большое применение при изготовлении металлических деталей паровозов, турбин, тракторов и т. д. [c.341]
Хром входит в состав многих специальных нержавеющих и кислотоупорных сталей. Для этих целей пользуются феррохромом, т. е. сплавом хрома с железом. Феррохром получают восстановлением хромистого железняка FeO СГ2О3, прокаливая его с углем. [c.301]
КОЙ механической прочностью, жаростойкостью и антикоррозионными свойствами. Хром входит также в состав сплавов — алюминиевых, кобальтовых, титановых и др. Получаемый восстановлением окиси хрома углем в атмосфере водорода карбид хрома СгзСг служит для изготовления химически и термически стойких металлокерамических сплавов (керметов), а также режущих и на,-плавочных твердых сплавов Соединения хрома используются для получения хромомагнезитовых и других огнеупоров, применяемых в металлургических печах. [c.571]
ПозднееТомсоп и сотрудники [71 ], А. А. Трчунян [69] и Н. С. Федорова [70] исследовали зависимость перенапряжения водорода отсос-тава никелевых сплавов хрома вольфрама и железа. Авторы установили качественно не отличающиеся зависимости величины перенапряжения водорода от состава указанных сплавов. На фиг. 44—46 показаны диаграммы состав — перенапряжение водорода, полученные Томсоном, А. А. Трчуняном и Н. С. Федоровой. Аналогичные диаграммы получены Томсоном и Кейем для сплава Ре—N1 [71] и для сплава Ре—Сг Томсоном и Флемингом [72]. [c.71]
Для изготовлния аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий применяются также сплавы на основе никеля пли кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования. [c.537]
Определение в отработанных кремнемедных сплавах углерода и хлора проводят метрдом, описанным на стр. 295. При этом металлы, входящие в состав сплава, переходят в раствор в виде соответствующих ионов. Нерастворимая часть представляет собой свободный кремний, который определяют взвешиванием. Примеси Si , Si02 и других нерастворимых веществ взвешиваются вместе с кремнием, ввиду чего определение содержания кремния этим методом нужно считать ориентировочным. Присутствие хромовой кислоты затрудняет определение металлов, поэтому по окончании сожжения хром в соединениях шестивалентного хрома восстанавливают до трехвалентного состояния добавлением спирта. [c.297]
Чугуном называются сплавы железа с углеродом, содержащие свьш1е 2% последнего. Кроме углерода, в чугуне содержатся обычно кремний, марганец, сера и фосфор. Для придания чугуну специальных свойств — повышенной прочности, жаростойкости и др. в его состав вводят хром, никель и некоторые другие элементы. На чугунные изделия гальванические покрытия наносятся сравнительно редко. Для защиты их от коррозии применяются обычно лакокрасочные покрытия и металлизация напылением. [c.32]
chem21.info
Хрома химический состав - Справочник химика 21
Типичное применение проволочного сетчатого туманоуловителя, выполненного из сплава хастеллой-С (химический состав в % никель —54, хром —15,5, молибден — 16, вольфрам — 4, кобальт — 2,5, железо — 5) — улавливание отходящих газов контактной установки производства серной кислоты. При скорости газов 4,5—5,5 1м/с содержание кислоты снижалось до уровня 0,03— 0,06 г/м при перепаде давления 370—500 Па [556]. [c.376] Состав ванадиевых шлаков зависит от состава чугуна и способов его передела. Ванадий и другие примеси, находящиеся в чугуне,— кремний, марганец, хром, фосфор — в составе окислов переходят в шлак. Поэтому для получения шлаков с высоким содержанием окислов ванадия следует стремиться выплавлять чугуны с низким содержанием кремния и марганца и повышенным содержанием ванадия. Состав ванадиевого шлака зависит от характера руды, из которой выплавлен чугун. Рассмотрим отдельно извлечение ванадия из фосфористых, железных и титаномагнетитовых руд. Химический состав этих руд приведен в табл. 5. [c.21]В качестве исходного сырья были взяты доломитизирован-ный магнезит и хромит, химический состав которых приведен в табл. 1. [c.212]
Диффузионные слои хрома были получены при помощи порошкообразного хрома. Химический состав хрома, а также типичных сталей и чугуна, подвергнутых хромированию, приводится в табл. 1. [c.108]
Химический состав. ..........Окись хрома, окись меди, окись цинка, окись алюминия [c.402]
Химический состав.............Окислы железа, калия, хрома, магния [c.411]
Стандартные образцы — эталоны для различных методов анализа С. о. представляют собой различные материалы, химический состав которых точно известен. Напр., эталоны сталей для спектрального анализа, содержащие небольшие количества примесей легирующих металлов никеля, марганца, хрома идр. С. о. применяют при контроле химического состава сырья (руд, огнеупоров, концентратов и др.), полупродуктов и продукции машиностроительной и металлургической промышленности на содержание тех или иных компонентов. Стандартные (титрованные) растворы — растворы с точно известной концентрацией реактива. С, р, представляют основные рабочие растворы во всех методах титриметрического анализа — количественного определения вещества, основанного на измерении объемов растворов, затраченных на реакцию (титрование). Стандартный электродный потенциал (нормальный электродный потенциал) — потенциал электрода в растворе, в котором ионы, определяющие электродны [c.126]
Химический состав. . ...........Окислы меди и хрома [c.413]
Химический состав.............Хромит меди, промотированный барием [c.414]
Химический состав. . ...........Окислы цинка, хрома, алюминия [c.414]
В состав низколегированных сталей входят малые добавки таких элементов, как медь, хром, никель, молибден, кремний и марганец, за счет чего и достигается повышение прочности по сравнению с углеродистой сталью. Коммерческой характеристикой низколегированных сталей является не строгий химический состав, а их прочностные свойства. Суммарное содержание легирующих добавок обычно составляет около 2—3 %. В отношении атмосферной коррозии большинство низколегированных сталей обладает гораздо более высокой стойкостью, чем нелегированная малоуглеродистая сталь. Это преимущество особенно заметно в промышленных атмосферах, но и в морских условиях применение низколегированных сталей дает значительный выигрыш. [c.42]
По принятой в СССР классификации марка стали дает возможность определить ее химический состав. Две первые цифры слева показывают количество углерода в сотых процента, а следующие за ними буквы обозначают Г — марганец, С — кремний, X — хром, Н — никель, М — молибден, В — вольфрам, Ф — ванадий, Т—титан, Нб — ниобий, Ю — алюминий. После каждой буквы, обозначающей легирующий элемент, ставится одна или две цифры, указывающие среднее процентное содержание этого элемента в целых единицах (цифры один и меньше опускаются). [c.344]
Было установлено, что химический состав обрабатываемых деталей в значительной степени определяет химическую природу ионов, загрязняющих промывные воды. Так, в отработанных промывных растворах, содержащих изначально ионы натрия и цинка, обнаружены после промывки также ионы железа, хрома, кадмия, меди, никеля и др. в соответствии с составом промываемых деталей. Например, в растворе ванны фосфатирования концентрация ионов никеля, кадмия и меди равна соответственно 15, 0,5 и 0,01 мг/дм , те же ионы в растворе ванны оксидирования соответственно составляют 0,1, 0,4 и 1,5 мг/дм . [c.124]
За рубежом в оборудовании вакуумной переработки нефти ряд теплообменных аппаратов и ребойлеров изготовляются из никелевого силава инконель, устойчивого против сероводородной коррозии. Сплав инконель имеет следующий химический состав 72% N1, до 0,7% Си, 6—10% Ре, до 1,0% Мп, остальное — хром. [c.161]
Химический состав, % хром молибден марганец кремний углерод титан. [c.348]
При сварке коррозионного слоя двухслойного проката металл шва аустенитной или аустенитно-ферритной структуры образуется из разнородных сталей (рис. 28. 5 [143]). На структуру металла шва решающее влияние оказывает химический состав, особенно содерн ание хрома и никеля. [c.384]
Химический состав осадков производственных сточных вод существенным образом влияет на выбор метода их обработки. Если осадки содержат соединения железа, алюминия, хрома, меди, то процесс обезвоживания таких осадков интенсифицируется и уменьшается расход реагентов на коагуляцию перед обезвоживанием. Такие вещества, как жиры, масла, нефть, волокна, нарушают процессы уплотнения и коагуляции осадков, уменьшают их водоотдачу. [c.247]
Представляет интерес сравнить приведенные данные с результатами исследований степени окисления хрома с использованием природных хромитовых руд. Были использованы руды, имеющие следующий химический состав (%) [c.103]
Так, во-первых, комбинированным термохимическим и компаративным путем получаются значения для энергий связи водорода, углерода и кислорода с никелем (табл. 1), очень похожие на те, которые получаются для этих же элементов с окисью хрома (табл. 9), найденные при применении первого варианта кинетического метода. В то же время, поскольку химический состав никелевого и окисно-хромового катализаторов разный, эти значения не совпадают, что находится в согласии с теорией. [c.227]
Ранее при расчетах намагниченности феррита делалось два допущения феррит имеет такой же состав, как и аустенит, т, е. средний состав стали, хотя известно, что при высокой температуре растворимость хрома и других элементов в у- и б-фазах различна учитывалось взаимное влияние лишь трех элементов, независимо от присутствия в стали других элементов. Выполненные ЦНИИТМАШ исследования позволили установить истинный химический состав дельта-феррита в нержавеющих сталях типа Х19Н9 и Х22Н13, а также намагниченность насыщения (,. [c.149]
Из табл. 24 видно, что изменение природы катализатора и способа его приготовления сильно влияет на величину энергии связи. Для окиси хрома способ приготовления катализатора сравнительно мало сказывается на прочности связи Н—К и сильно на энергиях связи С—К и О—К. В реакциях, где реагирующими атомами будут кислород и углерод, способ приготовления катализатора сильно скажется на величине энергии активации реакции на окиси хрома. Там же, где скорость реакции зависит от связи Н—К, решающую роль будет играть химическая природа катализатора. Химический состав катализатора играет решающую роль в таких каталитических процессах, когда активна вся поверхность катализатора. [c.216]
Катализатор Дау Б. Основа этого катализатора — двойная фосфорнокислая соль кальция и никеля, стабилизированная окисью хрома. Химический состав фосфата выражается формулой Са8М1(Р04)в. В исходную пасту добавляется 2% графита для улучшения формовки. [c.49]
Процесс сварки труб из центробежнолитых трубных заготовок отличается рядом особенностей вследствие специфических свойств аустенитных хромоникелевых сталей. Аустенитная сталь типа НК-40 характеризуется электрическим сопротивлением, примерно в 5 раз большим, чем обычных углеродистых сталей, и низкой теплопроводностью металла, что определяет выбор методов и режимов сварки. Химический состав хромоиикелевых сталей также оказывает влияние на происходящие металлургические процессы сварки. Высокое содержание хрома в сплаве делает его взаимодействие с кислородом и рядом оксидов (МпО п 5102) достаточно активным, что вызывает интенсивные марган-цево-кремневосстановительные процессы, сопровождающиеся окислением значительных количеств хрома. Другие элементы, входящие в жаропрочный сплав (Ре, N1, Мп, 51, 5, Р, N и др.), при сварке могут образовывать различные эвтектики, карбиды, нитриды, интерметаллиды. Образование в металле новых фаз вызывает появление структурных напряжений, особенно металлов центробежнолитых трубных заготовок с характерной анизотропной дендритной структурой. Наконец, при сварке в результате воздействия высоких температур происходит укрупнение зерен в структуре металла и его разупрочнение при комнатной температуре, что ухудшает эксплуатационные свойства труб. [c.33]
В процессе дегидрирования бутана катализатор покрывается углистыми отложениями и изменяет свой химический состав. Активность катализатора при этом резко снижается. С целью реактивации катализатора его продувают кислородсодержащим газом. Углистые соединения при этом вцгорают, а низшие окислы хрома окисляются вплоть до lgOg. [c.218]
Для выявления и сравнения особенностей ТКП ВМНС были использованы яелезоокисный, железо-хром-калиевый, фосфор-магний-кремневый, ГТ-85 алюмосиликатный катализаторы, а также кварцевая насадка. Химический состав используемых катализаторов в % приведен ниже [c.125]
По соображениям о межкристаллитной коррозии и о склонности к образованию горячих трещин необходимое количество а-фазы следует обеспечивать минимальным легированием фер-ритизаторами хром вследствие более низкой растворимости в присутствии марганца интенсифицирует охрупчивание стали. Учитывая сказанное о металле шва аппаратуры, предназначенной для работы нри высоких температурах, рекомендуется ограничивать его химический состав С 0,1% Сг = 18 19% Ni = = 8 9% и Si [c.365]
Зависимость скорости коррозии от потенциала для системы Ре— Н2804 (в пассивной области по рис. 2.2) показана на рис. 2.12. При /активной коррозии, при и>и = 1,6 В наблюдается транспассивная коррозия [28]. Легирующие элементы в стали и химический состав сред могут в ряде случаев существенно повлиять на эти предельные потенциалы [2], причем скорость коррозии металла в пассивной области уменьшается главным образом под влиянием хрома. На рис. 2.13 показан пример зависимости тока поляризации и скорости коррозии для хромоникелемолибденовой стали в серной кислоте от потенциала в области потенциалов активной коррозии и при переходе к пассивному состоянию. При =—0,15 В в принципе еще возможно применение катодной защиты. Однако ввиду очень высокой плотности защитного токэ —около 300 А-М —этот [c.66]
Хромомарганцевые стали, разработанные Институтом металлургии АН ГССР, по сравнению с хромоникелевым сплавом (Х18Н9Т) содержат хрома на 3—5% меньше. Для стабилизации аустенитной структуры в сплавах этого типа вводится азот в количестве до 0,4%. Хромомарганцевые сплавы по своим физико-химическим свойствам приближаются к хромоникелевым, а по некоторым другим даже превосходят их. Химический состав и механические свойства хромомарганцевых сплавов приведены в табл. IV. 1, IV. 2. [c.61]
В Англии изучается не содержащий хрома сплав с добавками серебра и циркония [162]. Химический состав этих сплавов близок составу сплава МА-15 (фирма Al oa ), сплаву 2 (фирма Reynolds ) и сплаву 21 (фирма Boeing ), (табл. 14). За исключением высокого содержания меди в сплаве МА-15 и добавок серебра в английском сплаве, химический состав этих сплавов является очень схожим. [c.275]
Химическая экология природных вод. Химический состав и классификация природных вод. Макрокомпоненты хлорид-, сульфат-, карбо-нат- и гидрокарбонат-ионы, катионы натрия, калия, магния, кальция. Ионы кремния, железа, алюминия, фосфора, азота в разных степенях окисления, органические вещества в природных водах. Микрокомноненты ионы лития, стронция, меди, серебра, хрома, марганца, бромид-, иодид-ионы и их способность к комилексообразовапию. Эколого-химические особенности загрязнения гидросферы. Металлы как загрязняющие вещества источники ностунления в воду, токсические эффекты, химическое состояние. Органические соединения - загрязнители вод разных типов хлорорганические, фосфорорганические соединения. Особенности нефтяного загрязнения. Детергенты в природных водах. Коллоидные ПАВ и их влияние на загрязнение природной воды. [c.4]
При дегидрировании бутана в промышленности применяют хромовый катализатор (СггОз на алюмооксидном носителе). В процессе работы катализатор покрывается углистыми отложениями и изменяет свой химический состав. Для восстановления активности катализатора необходима его регенерация, которая проводится в регенераторе. При продувке катализатора кислородсодержащим газом углистые соединения выгорают, а низшие оксиды хрома окисля- ОТСЯ [1]. [c.293]
| Рис. 9. Жаростойкость при 1200°С ( i ), фазовый и химический состав окалины ( 2 ) в зависимости от содержания в сплаве хрома (длительность окисления -8ч) а - NiO 6- NiO + G,0, в - Ni r,0 г - G,0, |  |
Электронные микрозондовые методы используют для анализов стекол, микробрекчий и минеральных зерен лунного вещества. Например, анализ шлифов проб лунного реголита проводится на микроанализаторе ТХА-5 с углом выхода рентгеновских лучей 40°. Ускоряющее напряжение 15 кв. Ток поглощенных электронов 1,5 10 а. Размер зонда 1—5 мкм. В качестве эталона на хром применяют хромит. Относительная погрешность анализа 5% [442]. Химический состав отдельных частичек определяют на микроанализаторе ХМА-4Б фирмы Хитачи с углом выхода рентгеновских лучей 19,5°,(ускоряющее напряжение 18,5 кв, ток зонда 3—5-10 а [164]. Фон при определении хрома измеряют на форстерите (Mg2Si04), эталоном служит металлический хром. В связи с уникальной ценностью космических объектов и их малым размером (несколько сотен микрон) разработана специальная методика подготовки проб. [c.119]
Химический состав (не более) углерода 0,157о, марганца 0,3%. кремния 0,4—0,6%, хрома 4—6%, вольфрама 0,4—0,7%, ванадия 0,5—0,8%, серы и фосфора 0,3%, меди 0,25%. [c.520]
В этом способе обращает внимание совершенно неэффективное использование портландцемента, гидравлически твердеющего вяжущего, для упрочнения окатышей сушкой. Однако и в данном случае получены удовлетворительные результаты плавки, в частности в дуговой печи емкостью 12,5 т на заводе фирмы Аослин стэйнлиз стил . Окатыши (диам. 12,5-25 мм) изготовляли из шихты, содержащей, % 40 отходов шлифования, 17 окалины, 17 пыли электропечей, 12 пыли установок АОД, 10 коксовой мелочи и 4 цемента. Химический состав окатышей, % 41,8 Fe 9,5 Сг 3,96 Ni 2 Мп 1 Мо. В шихту вводили небольшое количество лома нержавеющей стали, а во время плавки добавляли ферросилиций. Полученный металл разливали на слитки. Ехо состав,% 76,7 Fe 11,8 Сг 6,5 Ni 0,9 Мп 4,3 Si 3,2 С. Извлечение железа составляло 86,1%, хрома 68,7 и никеля 92%. В дальнейшем в печи емкостью 17,5 т были проведены плавки с получением нержавеющей стали из шихты, содержащей 2,7 т окатышей, а также из шихты, в состав которой входило 3,6 т слитков, выплавленных из этих окатышей. Показатели плавок не отличались от обычных. Разработанный метод позволяет полностью использовать металлсодержащие отходы, образующиеся при производстве нержавеющей стали. [c.79]
Отличительной особенностью этой грушты материалов является то, что в основе их монолитизации лежат процессы синтеза фосфатных соединений [16]. Для фосфатных цементов отвердевание обусловлено хими-чес1сим взаимодействием исходного твердого порошкообразного компонента с жидкостью затворения, содержащей фосфатные анионы. В качестве таких жидкостей могут использоваться как водные растворы фосфорных кислот (главным образом ортофосфорной), так и растворы кислых фосфатов (фосфатные связки), например аммония, алюминия, магния, хрома и т. д. В качестве порошкообразного компонента фосфатных композиций используются оксиды и гидроксиды различных металлов, стекла различного состава, соли, бескислородные соединения, порошки металлов и т. д. Основным химическим процессом, инициирующим твердение фосфатных композиций, является кислотно-основное взаимодействие жидкости затворения и твердого вещества. Условия проявления вяжущих свойств зависят как от свойств фосфатного затворителя (степень нейтрализации, химический состав), так и химических особенностей порошковой части. Повышение основности по- [c.293]
Отин и Савенку [36] исследовали действие различных катализаторов при крекинге керосина уд. веса 0,801 при 20° С и вьщипающего от 139 до 295° С при перегонке по Энглеру. Температура опытов изменялась от 100 до 254° С, давление — от 1 до 20 ат, продолжительность реакции во всех опытах была 2 часа. После каждого опыта производили разгонку по Энглеру и определяли химический состав керосина. Различные металлы (калий, натрий, магний, цинк, никель, олово, железо и алюминий), окислы (кальция, магния, цинка, железа и алюминия), хлориды (калия, натрия, кальция, магния, цинка, железа, хрома и алюминия) и сульфаты применялись как катализаторы в количестве 5% вес. на керосин. Со всеми этими катализаторами, за исключением хлористого алюминия, выход продуктов разложения был очень небольшой. При самых жестких условиях (200—230° С) и продолжительности, равной двум часам, выход фракции до 150° С, которой в исходном продукте содержалось 3%, или оставался неизменным (3%) или же увеличивался до 4—6% и до 8% при применении хлорного железа. Только в присутствии хлористого алюминия количество этой фракции возрастало до 34%. [c.149]
Оптимальный химический состав осажденного катализатора соответствует формуле 2,5ZnO-Zn r204 [40]. Взаимодействие оксидов в твердой фазе в потоке воздуха протекает при высоких температурах при 400°С образуются лишь фазы оксидов цинка и хрома, а при 800°С образуется хромит цинка. Ранее отмечалось, что при высоких температурах получаются образцы с малой удельной поверхностью и соответственно низкой производительностью. Поэтому стадию прокаливания проводят в токе восстановительного газа — водорода, при этом хромит цинка получается уже при 400°С. [c.55]
Структура стали конкретного химического состава в закаленном состоянии может быть определена по диаграмме Потака — Сагалевич (рис. 1.34). Химический состав типичных мартенситно-стареющих и аустенито-мартенситных сталей представлен в табл. 1.7. Важнейшая особенность аустенито-мартенситных сталей по сравнению с мартенситностареющими — возможность большего легирования хромом, что обеспечивает их повышенную коррозионную стойкость. [c.41]
Исследованиями Поля, Бюиссона и Жозефа [1] было установлено, что катализатор, приготовленный добавлением борогидрида натрия N36 к раствору хлористого (или уксуснокислого) никеля, обладает значительной активностью и стабильностью в реакциях жидкофазного низкотемпературного гидрирования сафрола, фурфурола и бензонитрила, причем активность такого катализатора возрастает при промотировании его некоторыми металлами. Катализатор, промотированный хромом (2% Сг), обладает активностью, превышающей активность скелетного никеля. Полученный катализатор, в противоположность скелетному, не обладает ферромагнетизмом и пирофорностью. Его химический состав приблизительно отвечает формуле N1 6. Последнее обстоятельство послужило основанием для предположения, что никель связан в катализаторе в виде химического соединения борида никеля. До сих пор, однако, отсутствуют прямые структурные исследования, устанавливающие правильность этой точки зрения. [c.84]
chem21.info
Хром • ru.knowledgr.com
Хром - химический элемент с символом Cr и атомное число 24. Это - первый элемент в Группе 6. Это - стальной серый, блестящий, твердый и хрупкий металл, который берет зеркальную полировку, сопротивляется бросанию тени и имеет высокую точку плавления. Название элемента получено из греческого слова , chrōma, означая цвет, потому что многие его составы сильно окрашены.
Окись хрома использовалась китайцами в династии Циня более чем 2 000 лет назад, чтобы покрыть металлическое оружие, найденное Терракотовой армией. Хром был обнаружен как элемент после того, как он привлек внимание Западного мира в красном прозрачном минерале crocoite (лидерство (II) хромат), обнаруженный в 1761 и первоначально использовал в качестве пигмента. Луи Николас Воклин сначала изолировал металл хрома от этого минерала в 1797. Начиная с первого производства Воклином металлического хрома небольшие количества родного (бесплатного) металла хрома были обнаружены в редких полезных ископаемых, но они не используются коммерчески. Вместо этого почти весь хром коммерчески извлечен из единственного коммерчески жизнеспособного хромита руды, который является железной окисью хрома (FeCrO). Хромит - также теперь главный источник хрома для пигментов хрома.
Металл хрома и сплав железнохрома коммерчески произведены из хромита silicothermic или aluminothermic реакциями, или жарясь и выщелачивая процессы. Металл хрома доказал высокой стоимости из-за ее высокой устойчивости к коррозии и твердости. Основное развитие было открытием, что сталь могла быть сделана очень стойкой к коррозии и обесцвечиванию, добавив металлический хром, чтобы сформировать нержавеющую сталь. Это применение, наряду с хромовой металлизацией (наносящий слой металла гальваническим способом с хромом) в настоящее время включает 85% коммерческого использования для элемента с заявлениями на составы хрома, формирующие остаток.
Трехвалентный хром (Cr(III)), ион возможно требуется в незначительных количествах для сахара и метаболизма липида, хотя проблема остается в дебатах. В больших суммах и в различных формах, хром может быть токсичным и канцерогенным. Самый видный пример токсичного хрома - hexavalent хром (Cr(VI)). Заброшенные места производства хрома часто требуют экологической очистки.
Особенности
Физический
Хром замечателен для своих магнитных свойств: это - единственное элементное тело, которое показывает антиферромагнитный заказ при комнатной температуре (и ниже). Выше 38 °C это преобразовывает в парамагнитное государство.
Пассивирование
Металл хрома уехал, положение в воздухе пассивируется кислородом, формируя тонкий защитный окисный поверхностный слой. Этот слой - структура шпинели только несколько толстых атомов. Это очень плотно, и предотвращает распространение кислорода в основной материал. Этот барьер в отличие от железа или простых углеродистых сталей, где кислород мигрирует в основной материал и ржавление причин. Пассивирование может быть увеличено коротким контактом с окисляющимися кислотами как азотная кислота. Пассивировавший хром стабилен против кислот. Противоположный эффект может быть достигнут лечением с сильным уменьшающим агентом, который разрушает защитный окисный слой на металле. Металл хрома рассматривал, таким образом с готовностью распадается в слабых кислотах.
Хром, в отличие от металлов, таких как железо и никель, не страдает от водорода embrittlement. Однако это действительно страдает от азота embrittlement, реагирование с азотом от воздуха и формирование хрупкого азотируют при высоких температурах, необходимых, чтобы работать металлические детали.
Возникновение
Хром - 22-й самый в изобилии элемент в земной коре со средней концентрацией 100 частей на миллион. Составы хрома найдены в окружающей среде, из-за эрозии содержащих хром скал и могут быть распределены извержениями вулканов. Диапазон концентраций в почве между 1 и 300 мг/кг в морской воде 5 - 800 мкг/литр, и в реках и озерах 26 мкг/литр к 5,2 мг/литр.
Хром добыт как хромит (FeCrO) руда. Приблизительно две пятых руд хромита и концентратов в мире произведены в Южной Африке, в то время как Казахстан, Индия, Россия и Турция - также существенные производители. Неиспользованные залежи хромита многочисленны, но географически сконцентрированные в Казахстане и южной Африке.
Хотя редкий, залежи родного хрома существуют. Удачная Труба в России производит образцы родного металла. Эта шахта - труба кимберлита, богатая алмазами, и уменьшающая окружающая среда помогла произвести и элементный хром и алмаз.
Отношение между Cr(III) и Cr(VI) сильно зависит от pH фактора и окислительных свойств местоположения, но в большинстве случаев, Cr(III) - разновидности доминирования, хотя в некоторых областях грунтовые воды могут содержать до 39 мкг/литр всего хрома, которого 30 мкг/литр присутствует как Cr(VI).
Изотопы
Естественный хром составлен из трех стабильных изотопов; Cr, Cr и Cr с Cr, являющимся самым богатым (естественное изобилие на 83,789%). 19 радиоизотопов были характеризованы с самым стабильным, являющимся Cr с полужизнью (больше, чем) 1,8 года и Cr с полужизнью 27,7 дней. У всех остающихся радиоактивных изотопов есть полужизни, которые составляют меньше чем 24 часа, и большинство их имеют полужизни, которые составляют меньше чем 1 минуту. У этого элемента также есть 2 государства meta.
Cr - радиогенный продукт распада Mn. Хром изотопическое содержание, как правило, объединяется с марганцем изотопическое содержание и нашло применение в геологии изотопа. Отношения изотопа Mn-Cr укрепляют доказательства от Эла и Фунта для ранней истории солнечной системы. Изменения в Cr/Cr и отношениях Mn/Cr от нескольких метеоритов указывают на начальное отношение Mn/Mn, которое предлагает Mn-Cr, изотопический состав должен следовать из распада на месте Mn в дифференцированных планетарных телах. Следовательно Cr представляет дополнительные свидетельства для процессов nucleosynthetic немедленно перед соединением солнечной системы.
Изотопы хрома располагаются в атомной массе от 43 u (Cr) к 67 u (Cr). Основной способ распада перед самым богатым стабильным изотопом, Cr, является электронным захватом и основным способом после того, как будет бета распад. Cr был установлен как полномочие для атмосферной концентрации кислорода.
Составы
Хром - член металлов перехода в группе 6. У хрома (0) есть электронная конфигурация 4s3d вследствие более низкой энергии высокой конфигурации вращения. Хром показывает широкий диапазон возможных степеней окисления, где эти +3 государства являются самыми стабильными энергично; +3 и +6 государств обычно наблюдаются в составах хрома, тогда как +1, +4 и +5 государств редки.
Следующее - диаграмма Pourbaix для хрома в чистой воде, perchloric гидроокись натрия или кислота:
Хром (III)
Большое количество хрома (III) составы известно. Хром (III) может быть получен, растворив элементный хром в кислотах как соляная кислота или серной кислоте. У иона есть подобный радиус (63 пополудни) к иону (радиус 50 пополудни), таким образом, они могут заменить друг друга в некоторых составах, такой как в хромовых квасцах и квасцах. Когда незначительное количество заменяет в корунде (алюминиевая окись, AlO), красный рубин сформирован.
Хром (III) ионы имеет тенденцию формировать восьмигранные комплексы. Цвета этих комплексов определены лигандами, приложенными к центру Cr. Коммерчески доступный хром (III) гидрат хлорида является темно-зеленым комплексом [CrCl (HO)] Статья. У тесно связанных составов есть различные цвета: бледно-зеленый [CrCl (HO)] Статья и фиалка [Cr (HO)] Статья. Если зеленый хром без воды (III) хлорид расторгнут в воде тогда, зеленое решение становится фиолетовым через какое-то время, из-за замены воды хлоридом во внутренней сфере координации. Этот вид реакции также наблюдается с решениями хромовых квасцов и другого растворимого в воде хрома (III) соли.
Хром (III) гидроокись (Cr (О)) амфотерный, распадаясь в кислых решениях создать [Cr (HO)], и в основных решениях сформироваться. Это обезвожено, нагревшись, чтобы сформировать зеленый хром (III) окись (CrO), который является стабильной окисью с кристаллической структурой, идентичной тому из корунда.
Хром (VI)
Хром (VI) составы является сильными окислителями в низком или нейтральном pH факторе. Самый важный хроматный анион и дихромат (CrO) анионы, которые существуют в равновесии:
:2 [CrO] + 2 H [CrO] + HO
Хром (VI) галиды известны также и включают гексафторид CrF и chromyl хлорид .
Хромат натрия произведен промышленно окислительной жаркой руды хромита с карбонатом кальция или натрия. Доминирующая разновидность поэтому, согласно закону массовой акции, определенной pH фактором решения. Изменение в равновесии видимо изменением от желтого (хромат) к оранжевому (дихромат), такой как тогда, когда кислота добавлена к нейтральному решению хромата калия. В еще более низких значениях pH дальнейшее уплотнение к более сложному oxyanions хрома возможно.
И хромат и анионы дихромата - сильные реактивы окисления в низком pH факторе:
: + 14 + 6 e → 2 + 21 (ε = 1,33 В)
Они, однако, только умеренно окисляются в высоком pH факторе:
: + 4 + 3 e → + 5 (ε = −0.13 V)
Хром (VI) составы в решении может быть обнаружен, добавив кислый раствор перекиси водорода. Нестабильный темно-синий хром (VI) пероксид (CrO) сформирован, который может быть стабилизирован как аддукт эфира.
Ухромовой кислоты есть гипотетическая формула. Это - неопределенно описанный химикат, несмотря на многие четко определенные хроматы и известные дихроматы. Темно-красный хром (VI) окись, кислотный ангидрид хромовой кислоты, продан промышленно в качестве «хромовой кислоты». Это может быть произведено, смешав серную кислоту с дихроматом и является прочным окислителем.
Хром (V) и хром (IV)
Степень окисления +5 только осознана в немногих составах, но является промежуточными звеньями во многих реакциях, включающих окисления хроматом. Единственный двойной состав - изменчивый хром (V) фторид (CrF). У этого красного тела есть точка плавления 30 °C и точка кипения 117 °C. Это может быть синтезировано, рассматривая металл хрома с фтором в 400 °C и 200 барных давлениях. peroxochromate (V) является другим примером +5 степеней окисления. Калий peroxochromate (K [Cr (O)]) сделан реагирующим хроматом калия с перекисью водорода при низких температурах. Этот красный коричневый состав стабилен при комнатной температуре, но разлагается спонтанно в 150–170 °C.
Составы хрома (IV) (в +4 степенях окисления) немного более распространены, чем те из хрома (V). tetrahalides, CrF, CrCl, и CrBr, может быть произведен, рассматривая trihalides с соответствующим галогеном при повышенных температурах. Такие составы восприимчивы к disproportionation реакциям и не стабильны в воде.
Хром (II)
Многие хром (II) составы известны, включая стабильный водой хром (II) хлорид, который может быть сделан сокращением хрома (III) хлорид с цинком. Получающееся ярко-синее решение только стабильно в нейтральном pH факторе. Многие хромистые карбоксилируют, также известны, наиболее классно, красный хромистый ацетат (Cr (OCCH)), который показывает учетверенную связь.
Хром (I)
Большинство Cr (I) составы получено окислением богатого электроном, восьмигранного Cr (0) комплексы. Другие Cr (I) комплексы содержат cyclopentadienyl лиганды. Как проверено дифракцией рентгена, пятикратная связь Cr-Cr (длина 183.51 (4) пополудни) была также описана. Чрезвычайно большие монозубчатые лиганды стабилизируют этот состав, ограждая пятикратную связь от дальнейших реакций.
Хром (0)
Многие хром (0) составы известны. Большинство - производные хрома hexacarbonyl или еще раз (бензола) хром.
История
Оружие нашло в ямах похорон, датирующихся с конца 3-го века до н.э. Династия Циня Терракотовой армии под Сианем, Китай был проанализирован археологами. Хотя похоронено больше чем 2 000 лет назад, древние бронзовые подсказки болтов арбалета и мечей, найденных на месте, показали неожиданно маленькую коррозию, возможно потому что бронза была сознательно покрыта тонким слоем окиси хрома. Однако этот окисный слой не был металлом хрома или хромом, обшивающим металлическим листом, поскольку мы знаем это.
Полезные ископаемые хрома как пигменты привлекли внимание запада в 18-м веке. 26 июля 1761 Йохан Готтлоб Леманн нашел оранжево-красный минерал в шахтах Beryozovskoye в Уральских горах, которые он назвал сибирским красным лидерством. Хотя не распознано как свинцовый состав с компонентами селена и железа, минерал был фактически crocoite (свинцовый хромат) с формулой PbCrO.
В 1770 Питер Саймон Паллас посетил то же самое место как Леманн и нашел красный свинцовый минерал, у которого были полезные свойства как пигмент в красках. Использование сибирского красного лидерства как пигмент краски тогда развилось быстро. Ярко-желтый пигмент, сделанный из crocoite также, стал модным.
В 1797 Луи Николас Воклин получил образцы crocoite руды. Он произвел трехокись хрома (CrO), смешавшись crocoite с соляной кислотой. В 1798 Воклин обнаружил, что мог изолировать металлический хром, нагрев окись в темно-серой духовке, делая его исследователем элемента. Воклин также смог обнаружить следы хрома в драгоценных драгоценных камнях, таких как рубин или изумруд.
В течение 1800-х хром прежде всего использовался в качестве компонента красок и в загорающих солях. Сначала, crocoite из России был главный источник, но в 1827, более крупная залежь хромита была обнаружена под Балтимором, Соединенные Штаты. Это сделало Соединенные Штаты крупнейшим производителем продуктов хрома до 1848, когда большие залежи хромита были найдены под Бурсой, Турция.
Хром также известен его блеском, когда полируется. Это используется в качестве защитного и декоративного покрытия на автозапчастях, устанавливая вертикально приспособления, части мебели и много других пунктов, обычно применяемых, нанося слой металла гальваническим способом. Хром использовался для гальванопокрытия уже в 1848, но это использование только стало широко распространенным с развитием улучшенного процесса в 1924.
Металлические сплавы теперь составляют 85% использования хрома. Остаток используется в химической промышленности и невосприимчивый и отрасли промышленности литейного завода.
Производство
Приблизительно 23,3 миллиона метрических тонн (Мт) товарной руды хромита были произведены в 2011 и преобразованы в 9,5 Мт железнохрома. Согласно Джону Ф. Пэппу, пишущему для USGS, «Железнохром - ведущее использование конца руды хромита, [и] нержавеющая сталь - ведущее использование конца железнохрома».
Крупнейшими производителями руды хрома была Южная Африка (44%) Индия (18%), Казахстан (16%) Зимбабве (5%), Финляндия (4%) Иран (4%) и Бразилия (2%) с несколькими другими странами, производящими остальную часть меньше чем 10% мирового производства.
Двумя главными продуктами руды хрома, очищающейся, является железнохром и металлический хром. Для тех продуктов процесс завода руды отличается значительно. Для производства железнохрома руда хромита (FeCrO) уменьшена в крупном масштабе в печи электрической дуги или в меньших заводах или с алюминием или с кремнием в aluminothermic реакции.
Для производства чистого хрома железо должно быть отделено от хрома в двух жарке шага и выщелачивании процесса. Руда хромита нагрета со смесью карбоната кальция и карбоната натрия в присутствии воздуха. Хром окислен к форме hexavalent, в то время как железо создает стабильный FeO. Последующее выщелачивание при более высоких повышенных температурах расторгает хроматы и оставляет нерастворимую окись железа. Хромат преобразован серной кислотой в дихромат.
:4 FeCrO + 8 NaCO + 7 O → 8 NaCrO + 2 FeO + 8 CO
:2 NaCrO + HSO → NaCrO + NaSO + HO
Дихромат преобразован в хром (III) окись сокращением с углеродом и затем уменьшен в aluminothermic реакции на хром.
:NaCrO + 2 C → CrO + NaCO + CO
:CrO + 2 Эла AlO + 2 Cr
Заявления
Металлургия
Усиливающийся эффект формирования стабильных металлических карбидов в границах зерна и сильном увеличении устойчивости к коррозии сделал хром важным материалом получения сплава для стали. Быстродействующие стали инструмента содержат между 3 и 5%-й хром. Нержавеющая сталь, главный коррозионностойкий металлический сплав, сформирована, когда хром добавлен к железу в достаточных концентрациях, обычно выше 11%. Для его формирования железнохром добавлен к литому железу. Также основанные на никеле сплавы увеличиваются в силе из-за формирования дискретных, стабильных металлических частиц карбида в границах зерна. Например, Inconel 718 содержит хром на 18,6%. Из-за превосходных высокотемпературных свойств этих суперсплавов никеля они используются в реактивных двигателях и газовых турбинах вместо общих структурных материалов.
Относительная высокая твердость и устойчивость к коррозии чистого хрома делают его хорошим поверхностным покрытием, будучи все еще самым «популярным» металлическим покрытием с беспрецедентной объединенной длительностью. Тонкий слой хрома депонирован на предварительно рассматриваемых металлических поверхностях, нанеся слой металла гальваническим способом на методы. Есть два метода смещения: Тонкий, ниже толщины на 1 мкм, слои депонированы хромовой металлизацией и используются для декоративных поверхностей. Если износостойкие поверхности необходимы тогда депонированы, более толстые слои хрома. Оба метода обычно используют кислый хромат или решения для дихромата. Чтобы предотвратить потребляющее энергию изменение в степени окисления, использовании хрома (III), сульфат разрабатывается, но для большинства заявлений, используется установленный процесс.
В хроматном конверсионном процессе покрытия сильные окислительные свойства хроматов используются, чтобы внести защитный окисный слой на металлах как алюминий, цинк и кадмий. Это пассивирование и свойства самозаживления хроматом сохранили в хроматном конверсионном покрытии, которое в состоянии мигрировать к местным дефектам, выгода этого метода покрытия. Из-за экологического и санитарных норм на хроматах, разрабатываются альтернативные методы покрытия.
Хромовое анодирование кислоты (или Тип я анодирование) алюминия является другим электрохимическим процессом, который не приводит к смещению хрома, но использует хромовую кислоту в качестве электролита в решении. Во время анодирования окисный слой сформирован об алюминии. Использование хромовой кислоты, вместо обычно используемой серной кислоты, приводит к незначительным различиям этих окисных слоев.
Высокая токсичность составов Cr(VI), используемых в установленном процессе гальванопокрытия хрома и укреплении безопасности и экологических инструкций, требует поиск замен для хрома или по крайней мере изменения менее токсичного хрома (III) составы.
Краска и пигмент
Минерал crocoite (свинцовый хромат PbCrO) использовался в качестве желтого пигмента вскоре после его открытия. После того, как метод синтеза стал доступным стартом с более богатого хромита, желтый хром был, вместе с желтым кадмием, один из наиболее используемых желтых пигментов. Пигмент не фотоухудшается, но он имеет тенденцию темнеть из-за формирования хрома (III) окись. Это имеет сильный цвет и использовалось для школьных автобусов в США и для Почтовой службы (например, немецкая Почта) в Европе. Использование желтого хрома уменьшилось из-за экологического и проблем безопасности и было заменено органическими пигментами или альтернативами, лишенными свинца и хрома. Другие пигменты, основанные на хроме, являются, например, ярко-красным красным хромом пигмента, который является основным свинцовым хроматом (PbCrO · Свинец (О)). Очень важный хроматный пигмент, который использовался широко в металлических формулировках учебника для начинающих, был цинковым хроматом, теперь замененным цинковым фосфатом. Заливочный насос был сформулирован, чтобы заменить опасную практику предварительного рассмотрения алюминиевых корпусов самолета с фосфорическим кислотным решением. Этот используемый цинк tetroxychromate рассеялся в растворе поливинила butyral. 8%-й раствор фосфорической кислоты в растворителе был добавлен как раз перед применением. Было найдено, что легко окисленный алкоголь был существенным компонентом. Тонкий слой приблизительно 10-15 мкм был применен, который повернулся от желтого до темно-зеленого, когда он был вылечен. Есть все еще вопрос относительно правильного механизма. Зеленый хром является смесью прусского синего цвета и желтым хромом, в то время как хромовая зеленая окись является хромом (III) окись.
Окиси хрома также используются в качестве зеленого цвета в производстве стекла и в качестве глазури в керамике. Зеленая окись хрома чрезвычайно светостойкая, и как таковой используется в покрытиях оболочки. Это - также главный компонент в IR размышляющие краски, используемые вооруженными силами, чтобы нарисовать транспортные средства, дать им тот же самый коэффициент отражения IR как зеленые листья.
Синтетический рубин и первый лазер
Естественные рубины - корунд (алюминиевая окись) кристаллы, которые окрашены в красный (самый редкий тип) из-за хрома (III) ионы (другие цвета драгоценных камней корунда называют сапфирами). Красный искусственный рубин может также быть достигнут, лакируя хром (III) в искусственные кристаллы корунда, таким образом делая хром требованием для того, чтобы сделать синтетические рубины. Такой синтетический рубиновый кристалл был основанием для первого лазера, произведенного в 1960, который полагался на стимулируемую эмиссию света от атомов хрома в таком кристалле.
Антисептик
Из-за их токсичности хром (VI) соли используются для сохранения древесины. Например, медный арсенат chromated (CCA) используется в обработке древесины, чтобы защитить древесину от грибов распада, нападающих на лес насекомых, включая термитов и морские бурильные молотки. Формулировки содержат хром, основанный на окисном CrO между 35,3% и 65,5%. В Соединенных Штатах 65 300 метрических тонн решения CCA использовались в 1996.
Дубление
Хром (III) соли, особенно хромовые квасцы и хром (III) сульфат, используется в дублении кожи. Хром (III) стабилизирует кожу крестом, связывающим волокна коллагена. Хром загорел, кожа может содержать между 4 и 5% хрома, который плотно связан с белками. Хотя форма хрома, используемого для дубления, не является ядом hexavalent разнообразие, там остается интересом к управлению хромом в кожевенной промышленности, такой как восстановление и повторное использование, прямая/косвенная переработка, использование меньшего количества дубления хрома или «хрома меньше» осуществлены, чтобы лучше управлять хромом в дублении.
Огнеупорный материал
Удельное сопротивление высокой температуры и высокая точка плавления делают хромит и хром (III) окись материал для высокой температуры, которую невосприимчивые заявления, как доменные печи, цементные печи, формируют для увольнения кирпичей и как пески литейного завода для кастинга металлов. В этих заявлениях огнеупорные материалы сделаны из смесей хромита и магнезита. Использование уменьшается из-за экологических инструкций из-за возможности формирования хрома (VI).
Катализаторы
Несколько составов хрома используются в качестве катализаторов для обработки углеводородов. Например, катализатор Филлипса, подготовленный из окисей хрома, используется для производства приблизительно половины полиэтилена в мире. Fe-Cr смешался, окиси используются как высокотемпературные катализаторы для водной газовой реакции изменения. Медный хромит - полезный гидрогенизационный катализатор.
Другое использование
- Хром (IV) окись (CrO) является магнитным составом. Его идеальная анизотропия формы, которая передает высокую коэрцитивность и намагничивание остатка, сделала его составным начальником к γ-FeO. Хром (IV) окись используется, чтобы произвести магнитную ленту, используемую в высокоэффективной аудиокассете и стандартных аудио кассетах. Хроматы могут предотвратить коррозию стали при влажных условиях, и поэтому хроматы добавлены к бурению грязей.
- Хром (III) окись является металлическим блеском, известным как зеленая помада.
- Хромовая кислота - сильный окислитель и является полезным составом для очистки лабораторной стеклянной посуды любого следа органических соединений. Это подготовлено на месте, расторгнув дихромат калия в сконцентрированной серной кислоте, которая тогда используется, чтобы вымыть аппарат. Дихромат натрия иногда используется из-за его более высокой растворимости (50 g/L против 200 g/L соответственно). Использование моющих растворов дихромата теперь постепенно сокращено из-за высокой токсичности и экологических проблем. Современные моющие растворы очень эффективные и бесплатный хром. Дихромат калия - химический реактив, используемый в качестве титрующего агента. Это также используется в качестве протравы (т.е., агент фиксации) для красок в ткани.
Биологическая роль
Недавно, изменение парадигмы произошло с точки зрения статуса трехвалентного хрома (Cr(III) или Cr). Это было сначала предложено, чтобы быть существенным элементом в конце 1950-х и принято как микроэлемент в 1980-х. Однако научные исследования продолжили быть не в состоянии произвести убедительное доказательство для этого статуса. Трехвалентный хром происходит в незначительных количествах в продуктах и водах, и, кажется, мягок. Напротив, hexavalent хром (Cr(VI) или Cr) очень токсичное и мутагенным, когда вдохнули. Cr(VI) не был установлен как канцерогенное вещество, когда в решении, хотя это может вызвать аллергический дерматит контакта (ACD).
Дефицит хрома, включая отсутствие Cr(III) в теле, или возможно некоторый комплекс его, такой как фактор терпимости глюкозы спорен, или по крайней мере чрезвычайно редок. Хром не имеет никакой проверенной биологической роли и был классифицирован некоторыми как не важный для млекопитающих. Однако другие обзоры расценили его как существенный микроэлемент в людях. Исследования предполагают, что биологически активная форма хрома (III) является oligopeptide под названием вещество закрепления хрома Низкой молекулярной массы (LMWCr), который мог бы играть роль в инсулине сигнальный путь.
Дефицит хрома был приписан только трем людям на долгосрочной парентеральной пище, которая является, когда пациент питается жидкая диета через внутривенные капли в течение долгих промежутков времени.
Хотя никакая биологическая роль для хрома никогда не демонстрировалась, пищевые добавки для хрома включают хром (III) picolinate, хром (III) polynicotinate и связанные материалы. Выгода тех дополнений подвергнута сомнению некоторыми исследованиями. Использование содержащих хром пищевых добавок спорно, вследствие отсутствия любой проверенной биологической роли, расхода этих дополнений и сложных эффектов их использования. Популярный хром пищевой добавки picolinate комплекс производит повреждение хромосомы в клетках хомяка (из-за picolinate лиганда). В Соединенных Штатах диетические рекомендации для ежедневного поглощения хрома были понижены в 2001 от 50-200 мкг для взрослого к 35 мкг (взрослый мужчина) и к 25 мкг (взрослая женщина). В 2014 Европейское ведомство по безопасности пищевых продуктов опубликовало отчет, заявив, что потребление хрома (III) не имеет никакого благоприятного эффекта на здоровых людей, таким образом Группа удалила хром из списка питательных веществ и существенных элементов.
Никакая всесторонняя, надежная база данных содержания хрома еды в настоящее время не существует. Данные, о которых сообщают до 1980, ненадежны из-за аналитической ошибки. Содержание хрома еды значительно различается из-за различий в содержании минеральных веществ почвы, сельскохозяйственный сезон, культурный сорт растения завода и загрязнение во время обработки. Кроме того, большие количества хрома (и никель) пиявка в еду приготовили в нержавеющей стали.
Меры предосторожности
Водный нерастворимый хром (III) составы и металл хрома не считают опасностью для здоровья, в то время как токсичность и канцерогенные свойства хрома (VI) были известны в течение долгого времени. Из-за определенных транспортных механизмов только ограниченные количества хрома (III) входят в клетки. Несколько в пробирке учатся обозначенный, что высокие концентрации хрома (III) в клетке могут привести к повреждению ДНК. Острая устная токсичность располагается между 1.5 и 3,3 мг/кг. Предложенные благоприятные воздействия хрома (III) и использования в качестве пищевых добавок привели к некоторым спорным результатам, но недавние обзоры предполагают, что умеренное поглощение хрома (III) через пищевые добавки не представляет угрозы.
Cr(VI)
Острая устная токсичность для хрома (VI) диапазоны между 50 и 150 мкг/кг. В теле хром (VI) уже уменьшен несколькими механизмами до хрома (III) в крови, прежде чем это войдет в клетки. Хром (III) выделен от тела, тогда как хроматный ион передан в клетку транспортным механизмом, через который также сульфат и ионы фосфата входят в клетку. Острая токсичность хрома (VI) происходит из-за его сильных oxidational свойств. После того, как это достигнет кровотока, это повреждает почки, печень и клетки крови посредством реакций окисления. Гемолиз, почечный и печеночная недостаточность, является результатами этих убытков. Агрессивный диализ может улучшить ситуацию.
carcinogenity хроматной пыли известен в течение долгого времени, и в 1890 первая публикация описала поднятый риск рака рабочих в хроматной компании краски. Три механизма были предложены, чтобы описать genotoxicity хрома (VI). Первый механизм включает очень реактивных гидроксильных радикалов и других реактивных радикалов, которые являются продуктами сокращения хрома (VI) к хрому (III). Второй процесс включает прямое закрепление хрома (V), произведенный сокращением клетки и хромом (IV) составы к ДНК. Последний механизм приписал genotoxicity закреплению с ДНК конечного продукта хрома (III) сокращение.
(Хроматы) солей хрома - также причина аллергических реакций у некоторых людей. Хроматы часто используются, чтобы произвести, среди других вещей, кожаных продуктов, красок, цемента, миномета и антиразъедающих веществ. Контакт с продуктами, содержащими хроматы, может привести к аллергическому дерматиту контакта и раздражающему дерматиту, приводящему к изъязвлению кожи, иногда называемой «хромовыми язвами». Это условие часто находится в рабочих, которые были подвергнуты сильным хроматным решениям в гальванопокрытии, загорев и производящих хром изготовителях.
Проблемы охраны окружающей среды
Поскольку составы хрома использовались в красках и красках и дублении кожи, эти составы часто находятся в почве и грунтовой воде в заброшенных промплощадках, теперь нуждаясь в экологической очистке и исправлении за обработку земли существующих производств. Краска учебника для начинающих, содержащая hexavalent хром, все еще широко используется для космоса и автомобильных приложений повторной полировки.
В 2010 Экологическая Рабочая группа изучила питьевую воду в 35 американских городах. Исследование было первым общенациональным анализом, измеряющим присутствие химиката в американских водных системах. Исследование сочло измеримый hexavalent хром в водопроводной воде 31 из городов выбранным, с нормандцем, Оклахома, наверху списка; у 25 городов были уровни, которые превысили предложенный предел Калифорнии.
Примечание: Концентрации Cr(VI) в американских муниципальных поставках питьевой воды, о которых сообщает EWG, в пределах вероятных, естественных второстепенных уровней для проверенных областей и не обязательно показательны из промышленного загрязнения (Фактические данные CalEPA), как утверждается EWG. Этот фактор не был учтен в их отчете.
Примечания
Внешние ссылки
- Хром «Монографии IARC и Хром приходят к соглашению»
- Это элементное – хром элемента
- Руководство Мерка – минеральный дефицит и токсичность
- Национальный институт охраны труда и здоровья – страница хрома
ru.knowledgr.com