Способ получения окиси хрома. Окись хрома применение
Окись - хром - Большая Энциклопедия Нефти и Газа, статья, страница 2
Окись - хром
Cтраница 2
Окись хрома содержит 68 42 % хрома и 31 58 % кислорода. [16]
Окись хрома - вещество зеленого цвета, тугоплавкое, нерастворимое в воде и кислотах. Для перевода в растворимое соединение ее сплавляют с пиросернокислым калием. Выделяющийся из последнего серный ангидрид соединяется с окисью хрома с образованием сернокислой соли. В лаборатории Сг2Оз получают разложением двухромовокислого аммония. [17]
Окись хрома - твердое вещество темно-зеленого цвета - может быть получена либо в виде аморфного порошка, либо в виде кристаллов, обладающих металлическим блеском. [18]
Окись хрома обладает высокой химической стойкостью, применяется при окраске светоустойчивых прорезиненных тканей. Часто для окраски резины в зеленый цвет комбинируют желтые и синие пигменты. [19]
Окись хрома даже в небольшом количестве отрицательно влияет на активность цемента. [20]
Окись хрома Сг2О3 - темно-зеленый порошок; нерастворима в воде, плохо растворима в кислотах и щелочах. [21]
Окись хрома Сг2О3 - темно-зеленый порошок; нерастворима в воде, плохо растворима в кислотах и щелочах. [22]
Окись хрома ( III) Сг2О3 - темно-зеленый порошок, она нерастворима в воде, плохо растворима в кислотах и щелочах, обладает магнитными свойствами. [23]
Окись хрома получают восстановлением калиевого хромп ка с помощью древесного угля при нагревании. Обычно бер; на 6 кг хромпика 1 кг молотого угля. Смесь тонко измел чают, прокаливают в печи, а затем тщательно промывав водой. [24]
Окись хрома служит сырьем для получения металлического хрома ( обычно алюмотермическим путем), карбида хрома, шлифовальных паст и красок, стойких к свету, огню и кислороду воздуха. Ее применяют также для окрашивания стекла и керамики. Окись хрома является компонентом весьма часто применяемых в неорганическом и особенно органическом синтезе хромовых катализаторов ( для дегидрогенизации алифатических углеводородов, ароматизации парафиновых углеводородов, гидрирования и крекинга, конверсии нефтяных газов и проч. [25]
Окись хрома Сг2О3 применяют для окраски эмалей в зеленый цвет. В покрытиях для защиты металлов при их горячей обработке порошок окиси хрома применяют в качестве тугоплавкого наполнителя. Частички окиси хрома хорошо смачиваются эмалевыми расплавами, что благоприятно влияет на смачиваемость и кроющую способность покрытий. [27]
Окись хрома представляет собой оливково-зеленый пигмент с оттенками от желтоватого до синеватого. [28]
Окись хрома используют для всех видов малярных работ, особенно в тех5 случаях, когда окраска должна быть очень устойчивой. Обычно окись хрома применяют в смеси с наполнителями, содержание которых; благодаря ее высокой укрывистости, может доходить до 70 - 75 % от веса смеси. Следует, однако, отметить, что из-за серого оттенка пигмента и сравнительно высокой стоимости применение его несколько ограничено. [29]
Окись хрома имеет большое значение для производства художественных красок, для печати денежных знаков, а также для живописи по фарфору. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Хрома окись, гель - Справочник химика 21
Хром (окись — гель) [c.7]При использовании в качестве катализатора геля окиси хрома окись пропилена изомеризуется в аллиловый спирт по уравнению (1) [540]. [c.174]
Обычно процесс циклизации и ароматизации нормальных парафинов требует присутствия соответствующего катализатора. Чаще всего пользуются окисью хрома, однако окислы и сульфиды других металлов также катализируют эту реакцию. Окись хрома применяют непосредственно или наносят ее на активную окись алюминия. Процесс обычно проводят при 450—550°. Хуг с сотрудниками [17] подвергли тщательному изучению )еакции циклизации парафинов и олефинов в ароматические углеводороды. Результаты опытов, проводившихся при 465° и атмосферном давлении в п )исутствии геля окиси хрома, помещены в табл. 54. [c.251]
Система из двух параллельных колонок различной длины с одним и тем же сорбентом позволяет количественно определять окись этилена, двуокись углерода и этилен в воздухе Авторы рекомендуют использовать медные колонки длиной 1 и 11 ж с внутренним диаметром 6,35 мм. Наполнителем является хромо-сорб (246—360 мк), на который нанесен ацетонилацетон (25% от количества хромосорба). Газ-носитель — гелий. Скорость пропускания газа 23 мл мин—через колонку длиной 11 м я мл мин—через колонку длиной 1 м. Температура колонок 26 °С. [c.138]Силикагель, окись алюминия или гель окиси хрома в концентрации приблизительно 20% Силикагель [c.509]
Гель кремневой кислоты, содержащий серебро с окисью меди Окислы на угле (температура 63°) двуокись циркония (двуокись тория) окись хрома (двуокись тория) двуокись циркония (двуокись тория) с медью [c.28]
Окись алюминия на геле окиси хрома [c.29]
Окись алюминия, двуокись тория, борный ангидрид, вольфрамовый ангидрид и двуокись титана, осажденные на гель (силикагель, гель окисн алюминия, гель окиси хрома) в количестве около 20% [c.71]
ОКИСИ хрома [8]. Чтобы предотвратить ионный обмен, хром вводили, обрабатывая цеолит гексакарбонилом хрома в токе гелия. При последующем прогревании на воздухе Сг(СО)е превращался в окись хрома. Однако для выяснения механизма ингибирующего действия окиси хрома, а также нахождения его оптимальной концентрации и дисперсности необходимы дополнительные исследования. [c.306]
Промотированные хромовые катализаторы. В табл. 9 представлены результаты исследований серии хромовых катали.чато-ров в реакциях превращения к-гептана и циклогексаиа. Чистая окись хрома, приготовленная в виде геля обработкой хромовой кислоты изопропиловым спиртом, обладает кислотными свойствами, что подтверждается ее способностью катализировать при температуре 482° реакцию изомеризации к-гептана с образованием гептанов изостроения в количестве 11% мол. [c.493]
С годами число патентов в области ароматизации не только не уменьшалось, но, наоборот, возрастало. При этом постепенно становилось все более и более ясным, что самым важным но-сителем в катализаторе циклизации является окись алюминия, без которой катализатор недостаточно устойчив. Особое значение имеет физическое состояние окиси алюминия, а следо вательно, методы ее полз чения. Главными окислами, вызывающими ароматизацию, как видно из патентов, являются окиси хрома, молибдена и ванадия, причем окись хрома сначала занимала первое место, а затем широкое применение получила окись молибдена, особенно при работах под небольшим давлением. Появляются патенты с применением промоторов, в качестве которых предлагаются щелочные, а иногда и благородные металлы. Иногда подробно описывается метод получения активных гелей.Часто в патентах встречаются специфические методы получения отдельных компонентов катализаторов так, в описании одного метода получения активного катализатора, состоящего из окиси хрома на силикагеле, последний получают из этилового эфира кремневой кислоты. [c.72]
Окислы металлов, особенно окись хрома в виде геля, полученного путем двухступенчатого процесса [c.25]
Этот эффект станет ясным из сравнения магнитных свойств геля окиси хрома и массивной кристаллической окиси хрома. Гель окиси хрома может быть приготовлен осаждением гидроокиси из раствора нитрата соли с последующим медленным обезвоживанием. Имеется несколько других методов, одним из которых является медленное восстановление из щелочного раствора хромата. При прокаливании эти гели обычно обнаруживают явление раскаливания , во время которого они превращаются в кристаллическую окись хрома. [c.444]
Выполнялись эксперименты с имитаторами твэлов реакторов БН с таблетками из легкоплавкой керамики (окись хрома), диоксида урана при прекращении расхода газа (аргона, гелия). [c.56]
Первые исследователи, работавшие в области каталитического дегидрирования парафиновых углеводородов, применяли в качестве катализатора гель окиси хрома при температуре 350—500° [15]. В этих условиях газообразные парафиновые углеводороды превращаются (практически без побочных реакций) в олефины с тем же числом углеродных атомов. Из к-бутана образуются смеси к-бутенов и водорода с к-бутаном, в которых бутенов содержится около 15%. В свою очередь к-бутены состоят из бутена-1 (примерно 25%) и бутена-2 (75%). В технике чистая окись хрома непригодна в качестве катализатора, так как вследствие наступающей кристаллизации она очень быстро теряет свою активность. При добавлении малоактивной окиси алюминия 16], препятствующей кристаллизации окиси хрома, хотя и уменьшается активность катализатора, однако очень увеличивается срок его службы. [c.57]
Окись хрома и гель окиси хрома (в процессе реакции наблюдается отравленйе катализатора) катализатор может быть регенерирован обработкой кислородсодержащими газами при температуре реаедии гелеобразные катализаторы не следует перегревать вода, сильно адсорбируемая катализатором, повидимому, является ядом для реакции Двуокись тория Гель окиси алюминия Активированная окись алюминия [c.513]
Удельная поверхность окиси хрома снижается с увеличением температуры термообработки. Начальная удельная поверхность дегидратированной, например при 370 К, окиси сильно зависит от условий приготовления и обычно колеблется в интервале 80—300 м /г. Данные Дерена и др. [61] и Каррозерса и др. [58] показывают, что удельная поверхность гелей, дегидратированных нагреванием на воздухе, относительно слабо зависит от температуры, если она превышает приблизительно 770 К, и составляет 10—30 м2/г. Однако, если дегидратация ведется в инертном газе, заметная зависимость удельной поверхности от температуры наблюдается вплоть до примерно 970 К. Окись хрома с высокой удельной поверхностью, более 200 м2/г, конечно, имеет микропористую структуру с порами эквивалентным диаметром менее 2 нм после рекристаллизации до а-СггОз микропоры исчезают. По данным [62], гель окиси хрома, полученный с использованием гидролиза мочевины и обезгаженный при температуре ниже 470 К, характеризуется однородными порами весьма малого диаметра и проявляет мо-лекулярно-ситовые свойства. [c.65]
Гексен-1 (I), Циклогексен (11), D, 796 Дейтерогексан Дейтероциклогек- сан Окись хрома (гель), предварительно активированный обработкой водородом при 300° С и азотом при 470° С 43° С (для I), 80° С (для II). Конверсия 90— 100% [171]. См. также [176, 177, 237, 238] [c.796]
Фрей и Хаппке [306] установили, что гель окиси хрома является активным катализатором реакции дегидрирования газообразных парафиновых углеводородов, таких, как этан, пропан, н-бутан и изобутан. Однако в интервале температур 450—600°, в котором этот катализатор особенно пригоден, он быстро теряет свою активность. В более поздних работах Гроссе и Ипатьев [307], а также Берджин, Гролл и Робертс [308] установили, что активированная окись алюминия является хорошим носителем для окиси хрома. Концентрацию окиси хрома в катализаторе варьируют в среднем она составляет обычно 8—12 вес. %. Удобный метод приготовления катализаторов с окисью хрома состоит в пропитке носителя водными растворами трехокиси хрома, нитрата хрома или же хромата или бихромата аммония. Количество раствора должно отвечать требованию полного насыщения носителя при пропитке. Пропитанный носитель сушат при перемешивании на водяной бане и прокаливают для разложения соответствующих соединений хрома предпочтительно в атмосфере водорода. [c.145]
В качестве носителя для большей части окисных катализаторов применяется предпочтительно -модификация окиси алюминия однако этот носитель сам не обладает каталитической активностью. Из рассмотрения способов приготовления катализаторов видно, что они должны быть в аморфном или но меиьшей мере микрокристаллическом состоянии. Типичным примером могут служить катализаторы иа основе геля окиси хрома. Показано, что кристаллическая полуторная окись хрома СггОз лишена актив-поспг [5]. Активные катализаторы могут быть приготовлены как осаждением, так и пропиткой носителей типа активированной окиси алюминия. Окислы в виде геля или микрокристаллов обычно имеют большую уде.льную поверхность. Это относится и к таким носителям, как активированная окись алюминия. [c.292]
Катализатор в — окись молибдена, нанесенная на гель окиси алюминия (10 % вес. МоОз) О — со-осааденные окись молибдена и окись алюмиппя (10% вес. МоОз) х— смешанные гелп окиси хрома и окиси алюминия (32% вес. СгоОз). [c.473]
Выхояы продуктов в реакциях риформинга смеси н-гептана и циклогексаиа (50 ДО % мол.). Катализаторы ф — окись мо-либдепа, нанесенная на гель окиси алюминия (10 % вео. МоОз) О — соосажденные окись молибдена и окись алюминия (10% вес. МоОз) х — смешанные гели окиси хрома и окиси алюминпн (32 % вес. СгзОз)- Условия процесса 7 ат, Нз углеводороды равно 6 (моли) объемная скорость подачи сырья [c.474]
Выходы продуктов в реакциях риформинга смеси и-гептана и циклогексаиа (50 50% мол.). Катализаторы ф — ок.юь молие5дена. нанесенная на гель окиси алюминия (10% вес. МоОг) О — соосажден.чые ini b молибдена и окись алюминия (10% вес. МоОз) X — смешанные гели окиси хрома [c.474]
Ряд работ по исследованию хромовых катализаторов принадлежит Тэйлору и его сотрудникам. Хоуард и Тэйлор еще в 1934 г. определили энергии активации адсорбции водорода на различных окислах. В частности, для окиси хрома была найдена очень большая величина, 19 ООО кал, в результате чего авторы пришли к заключению, что именно скорость активированной адсорбции является стадией, определяющей скорость гидрогенизации этилена в присутствии различных окислов. Как известно, в дальнейшем Тэйлор распространил эти представления и на реакции дегидрогенизации и циклизации, Тур-кевич, Ферер и Тэйлор изучили различные методы получения окиси хрома, активной для реакции дегидроциклизации, а Салли, Ферер и Тэйлор исследовали температурные пределы стойкости некоторых из этих катализаторов, отравляющее действие на них паров воды и связь между цветом катализатора и степенью его окисления. В частности, было показано, что цвет катализатора не связан непосредственно с его активностью, как это считали и продолжают считать некоторые исследователи, Ферер и Тэ14лор исследовали двухкомпонентные гели, причем одним из компонентов была окись хрома, в качестве катализаторов для ароматизации н.-гептана. Оказалось, что введение в состав катализатора таких окислов, как окислы цинка, марганца и молибдена, которые способны осуществлять гидрогенизацию, благоприятствует низкому содержанию олефинов в катализатах при том же содержании ароматики (табл. 9). [c.51]
При действии аммиака на водный раствор нитратов хрома и алюминия образуется гель. После его промывания и дегидратации получают Сг Оз—А12О3 (окись хрома на окиси алюминия) [22]. [c.166]
Сравнение значений й для наблюденных линий с соответствующими значениями для гидроокиси хрома со структурой байерита, алюминиевого байерита и бемита показало, что байе-ритная фаза в геле, содержащем 28,4 мол. % СтоОг, является почти чистым гидратом окиси алюминия, тогда как бемитная фаза в образце с 18,4 мол. % СггОз содержит окись хрома в виде твердого раствора. [c.185]
Результаты рентгенографического исследования показали, что окисные алюмохромовые катализаторы большей частью неоднородны, даже если они приготовлены медленным совместным осаждением. Представляется вероятным, что наблюдаемая неоднородность возникает в процессе осаждения и сохраняется при термической обработке при 500°. У образцов с О—14% СггОз не обнаружено признаков неоднородности, но при содержании СггОз 14—45% имеется богатая окисью алюминия фаза, образующаяся в результате кристаллизации байерита во время осаждения. Байерит превращается в т)-окись при нагревании на воздухе или в атмосфере водорода. Богатая окисью хрома фаза в высушенном геле аморфна она образует т)-окись при нагревании в атмосфере водорода и а-окись при нагревании на воздухе. При высоком содержании СггОз соответствующая богатая окисью алюминия фаза наблюдается только при 70—90% СгоОз в образцах, нагретых в атмосфере водорода, и, следовательно, в других образцах должна быть относительно плохо окристал-лизованной. [c.188]
Чистый гель окиси хрома всегда превращается в а-окись, низкая каталитическая активность которой обусловлена малой величиной ее удельной поверхности. Добавление окиси алюминия стабилизирует большую поверхность твердых растворов т1-фазы в свежевосстановленных соосажденных катализаторах, но при регенерации нагреванием на воздухе фазы с высоким содержанием СггОз у таких катализаторов превращаются в а-фазу и величина поверхности, а также каталитическая активность несколько уменьшаются. [c.188]
Ядерные изомеры o-Hg и /z-Hj хорошо разделяются [9] проявительным методом на колонке с активной окисью алюминия при 77°К при использовании гелия в качестве газа-носителя (рис. 70). При этом наблюдается неполное разделение o-D и n-D . Для количественного анализа смеси Hg, HD и Dg в качестве адсорбента чаще всего используется активная окись алюминия с примесью окиси железа [10, И] или окиси хрома [12, 13] нри 77°К с использованием Не и Ne в качестве газа-носителя (рис. 71). Окись железа предотвращает раздельный выход из колонки ядерных изомеров На и Dg. Взаимный переход орто- и иара-модификацип происходит значительно быстрее передвижения газа вдоль колонки. Это приводит к тому,что о/ то-ипа/ а-изомеры выходят одним ником с временем удерживания средним между временами удерживания этих двух изомеров. Точность определения 0,2%. Предел детектирования HD и Dg меньше 0,01%, следовательно дейтерий можно определять даже в природном водороде. В указанных выше случаях было замечено сильное влияние степени активации адсорбента на симметрию пиков. При сильной активации пик Dg получается несимметричным. При сильной деактивации адсорбентов водяным паром получаются симметричные пики, но они не разделяются полностью. При частичной деактивации получается полное разделение На, HD и Dg. [c.143]
Почти четверть века отделяет нас от работ советских исследова-гелей, впервые установивших возможность получения ароматических углеводородов из парафиновых путем каталитической дегидроциклизации. Сведения об этой реакции были опубликованы в 1936 г. тремя группами исследователей Каржев, Северьянова и Сиова [1] показали, что в присутствии хромо-медного катализатора парафиновые углеводороды при 500—550°С превращаются в ароматические Молдавский и Камушер 12] нашли, что аморфная окись хрома способна при 450—470° С катализировать эту же реакцию Казанский и Платэ [3] обнаружили, что в присутствии платинированного угля при 305 310° С происходит дегидроциклизация парафиновых углеводородов с образованием ароматических углеводородов. В первых двух случаях ароматизация проходила с довольно значительным выходом ароматических углеводородов, хотя и сопровождалась частичным крекингом исходных парафинов и их дегидрогенизацией в олефины. В присутствии платинированного угля выходы ароматических углеводородов были незначительными и изменялись в зависимости от строения исходного парафина. Однако реакция шла очень гладко, без крекинга, с образованием лишь небольшого количества олефинов, а также, как это было показано значительно позднее (в 1954 г.) Казанским, Либерманом и их сотрудниками [4], с образованием углеводородов ряда циклопентана. [c.83]
При необходимости анализ можно осуществить на колонке, позволяющей разделить смесь на три пика — протия, дейтерида протия и дейтерия (см. раздел В,IV,а,2). В качестве газа-носителя используют гелий или тон ц все три компонента регистрируют на хроматограмме. Неподвижной фазой служит активированная окись алюминия, покрытая окисью трех-валентного железа [55] или окисью хрома [69], при температуре колонки 77° К. Неподвижные фазы готовят, обрабатывая частицы окиси алюминия размером 150/200 жш последовательно 1,8 М раствором хлорида железа и 3 /и раствором гидроокиси аммония. Затем продукт нагревают в течение [c.180]
Появление бидисперсной структуры можно понять, -если. принять -во внимание условия приготовления таблето-к катализатора. Таблетки получаются прессованием порошкообразной массы, содержащей закись никеля и окись хрома. Таблетированную массу -образуют скопления первичных частиц, которые уже сами но -себе имеют пористую структуру, возникающую при разложении геля основного карбоната никеля и гидроокиси хрома. -Окончательно микропористая структура формируется при восстановлении водородом. Большие поры -в прессованной таблетке представляют собой пространства между -отдельными частицами. Величина -этих пор зависит как от величины первичных частиц, так и от давления прессования таблето.к. [c.231]
chem21.info
Окись хрома и окись железа
Окись хрома, широко применяемая на практике под различными названиями, по своей кристаллической структуре относится к тригональному подклассу гексагональной системы. Элементарная ячейка решетки этого окисла содержит две молекулы и имеет размер 5,36 А. Цвет Сr2O3 меняется от зеленоватого (в тонком порошке) до почти черного (в больших кристаллах).
Его плотность — 5,22 г/см3, температура плавления 2435° С. Сr2O3 является полупроводником и обладает парамагнитными свойствами.
По данным некоторых исследователей, окись хрома может существовать в двух модификациях γ- и α-Сr2O3, из которых первая, низкотемпературная форма при нагревании выше 800° С монотропно переходит во вторую. Однако величина объемного эффекта и ряд других характеристик этого перехода точно неизвестны.
Сr2O3 образует хромиты со многими окислами других металлов, некоторые из этих хромитов имеют большое значение для технологии огнеупорных материалов.
Более подробные сведения о физических и химических свойствах окиси хрома читатель найдет в монографии Эди [713].
Окись железа известна в виде трех модификаций α-, γ- и σ-Fe2O3; существенное практическое значение имеют первые две. Гексагональная форма σ-Fe2O3 образуется при окислении щелочных растворов ферросолей и при температуре 110° С монотропно переходит в α-Fe2O3.
Метастабильная γ-модификация может быть получена низкотемпературным окислением железа. Так же как и Fe304, γ-Fe2O3 кристаллизуется в кубической решетке типа шпинелей (а — 8,32 А) и обладает ферромагнитными свойствами. Различие между решетками Fe304 и γ-Fe2O3 сводится к тому, что в первой из них все узлы замещены, а во второй — некоторые узлы, принадлежащие железу, вакантны. Между γ-Fe2O3 и Fe304 существует вообще непрерывная серия веществ промежуточных составов, которые можно рассматривать как твердые растворы γ-Fe2O3 — Fe364. Однако в системе Fe — О из этого непрерывного ряда в качестве устойчивой фазы реализуется ограниченная область твердых растворов, получающая заметное развитие лишь при высоких температурах.
Согласно имеющимся данным, α-Fe2O3 обладает некоторой растворимостью в Fe304 (ее границы могут быть указаны лишь ориентировочно).
При температуре 817° С γ-Fe2O3 монотропно переходит в α-форму с уменьшением объема вещества на 8,5%.
α-Fe2O3 обладает ромбоэдрической структурой корунда и является стабильной формой окиси железа. Определение температуры плавления этого окисла связано с затруднениями, обусловленными его высокой упругостью диссоциации, приводящей к образованию расплава состава, промежуточного между Fe2O3 и Fe304 (более близкого к последнему). Поэтому к приводимым в литературе данным о температуре плавления Fe2O3 приходится относиться с большой осторожностью; по-видимому, для чистого окисла эта температура значительно выше 1600° С.
По наиболее полным и, по-видимому, наиболее точным данным Грейга [710], упругость диссоциации Fe2O3 при температурах 1100, 1300, 1400, 1500 и 1600° С составляет соответственно 2,6*10-5; 19,7* 10-3; 0,28; 3 и 25 атм.
По Кочневу, Гельду, Есину и др. [714], на кривой упругости диссоциации Fe2O3 имеются скачки при температурах 830 и 900° С, связанные с фазовыми превращениями этого окисла. Имеются указания о превращениях окиси железа также при температурах ниже 0° С, однако они изучены еще очень мало.
Содержание
www.himikatus.ru
Способ получения окиси хрома
Изобретение относится к способам получения окиси хрома, которая может быть использована для производства магнитных носителей, а также для производства грунтовок, эмалей, красок, полировальных паст, производства абразивного материала и металлического хрома. Способ включает разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании с получением бихромата аммония и сульфата натрия. Сульфат натрия отделяют от раствора. Раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома. Техническим результатом изобретения является упрощение способа получения окиси хрома, повышение качества окиси хрома за счет уменьшения примесей и повышения содержания Cr2О3 в готовом продукте, а также возможность получения окиси хрома различного назначения.
Изобретение относится к способам получения окиси хрома, которая может быть использована для производства магнитных носителей, а также для производства грунтовок, эмалей, красок, полировальных паст, производства абразивного материала и металлического хрома.
Известные способы получения окиси хрома основаны, как правило, на термическом разложении CrO3 или восстановлении Na2CrO4 элементарной серой (хроматно-серный метод) - см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.216.
Известно получение пигментной окиси хрома термическим разложением CrO3 при температуре 900-1150°С (см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.217).
Недостатком данного способа получения пигментной окиси хрома является низкое качество готового продукта, обусловленное высокой температурой прокалки и получением частиц окиси хрома большого размера: средний размер частиц составляет около 5 мкм, при этом пигмент имеет темный цвет, причем содержание Cr2О3 в готовом продукте не превышает 99%.
Известно получение абразивной окиси хрома термическим разложением CrO3 (см. авторское свидетельство СССР №1701635, МПК C 01 G 37/02, приоритет от 15.11.89, опубликованное 30.12.1991 г. "Способ получения оксида хрома для полирования").
Недостатком данного способа получения абразивной окиси хрома является низкое качество готового продукта, обусловленное низким содержанием Cr2O3, не превышающим 98%, и наличием примесей, которые не позволяют получить однородные по размеру частицы окиси хрома и обеспечить высокие потребительские свойства окиси хрома для полирования.
Известно получение окиси хрома для магнитных носителей термическим разложением CrO3 (см. авторское свидетельство СССР №1570996, МПК C 01 G 37/027, приоритет от 20.07.87., опубликованное 15.06.1990 г. "Способ получения порошка двуокиси хрома для носителей магнитной записи").
Получаемая известным способом окись хрома содержит большое количество примесей серы, углерода, кремния SiO2, железа FeO, что не позволяет получить высокоплотную, высокочастотную запись из-за неоднородности зернового состава и величины среднего удельного объема частиц, лежащего в разнодоменной области.
Известен способ получения пигментной окиси хрома восстановлением хромата натрия серой (см. авторское свидетельство СССР №226573, МПК C 01 G 37/02, приоритет от 28.04.1966 г., опубликованное 03.06.1970 г. "Способ получения окиси хрома").
Известен способ получения абразивной окиси хрома восстановлением хромата натрия серой (см. авторское свидетельство СССР №236447, МПК C 01 G 37/02, приоритет от 20.07.1964 г., опубликованное 05.08.1969 г. "Способ получения окиси хрома для полирования").
Известен способ получения пигментной и металлургической окиси хрома путем восстановления соединений шестивалентного хрома Na2CrO4 в щелочном растворе серой (см. авторское свидетельство СССР №343567, МПК C 01 G 37/02, приоритет от 06.04.1970 г., опубликованное 03.11.1972 г. "Способ получения окиси хрома").
Известно также получение металлургической окиси хрома хроматно-серным методом (см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.216-217).
Вышеперечисленные способы получения окиси хрома хроматно-серным методом достаточно сложны, а конечный продукт содержит большое количество примесей, что ухудшает потребительские свойства окиси хрома, например, пигментная окись хрома имеет неудовлетворительные цветовые качества и физико-малярные свойства, а абразивная окись хрома имеет неудовлетворительные полирующие свойства.
Наиболее близким по совокупности существенных признаков к заявляемому изобретению является способ получения окиси хрома путем восстановления бихромата натрия сульфатом аммония, заключающийся в том, что смесь бихромата натрия и сульфата аммония подвергают термическому разложению в течение 6 часов при температуре 700-800°С с дальнейшим вымыванием сульфатов до получения готового продукта - окиси хрома, причем в качестве соли аммония используют сульфат аммония (см. патент Германии №728233, НПК 22 f 7, приоритет от 03.04.1940 г., опубликованный 23.11.1942 г. "Способ получения пигментной окиси хрома").
Известный способ получения окиси хрома является трудоемким, так как требует нескольких стадий выщелачивания (отмывки) готового продукта от сульфата натрия Na2SO4, которого в готовом продукте содержится до 50%.
Кроме того, с помощью известного способа невозможно получить окись хрома иного назначения, кроме пигментной, так как повышение температуры термического разложения свыше заявленной (700-800°С) ведет к плавлению сульфата натрия и образованию намотов в барабанных печах, в которых осуществляют термическое разложение, а также образованию агломератов готового продукта, затрудняющих его термическое разложение и снижающих качество получаемой окиси хрома, содержание которой в готовом продукте не превышает 98%.
Техническим результатом заявляемого изобретения является упрощение способа получения окиси хрома, повышение качества окиси хрома за счет уменьшения примесей и повышения содержания Cr2О3 в готовом продукте, а также возможность получения окиси хрома различного назначения.
Заявляемый технический результат достигается тем, что в способе получения окиси хрома, включающем разложение бихромата натрия и сульфата аммония с последующим вымыванием полученной окиси хрома, согласно изобретению первоначально осуществляют обменное разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании с получением бихромата аммония и сульфата натрия, причем последний затем отделяют от раствора, а раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома.
Обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании позволяет весь бихромат натрия перевести в бихромат аммония за счет прохождения следующей химической реакции:
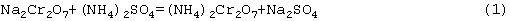
Образующийся при этом сульфат натрия Na2SO4 кристаллизуется и выпадает в осадок.
При концентрации раствора бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 менее 400 г/л по CrO3 кристаллизация сульфата натрия Na2SO4 не происходит; при концентрации раствора бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 более 450 г/л по CrO3 обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 затрудняется в связи с преждевременной кристаллизацией сульфата натрия Na2SO4, в результате чего реакция (1) протекает не в полном объеме.
Химическое разделение продуктов реакции и отделение сульфата натрия Na2SO4 от раствора бихромата аммония исключает необходимость многостадийного вымывания сульфатов и упрощает способ получения окиси хрома.
Охлаждение очищенного от кристаллов сульфата натрия раствора бихромата аммония (Nh5)2Cr2O7 до температуры его кристаллизации позволяет перевести бихромат аммония (Nh5)2Cr2O7 в кристаллическое состояние.
Термическое разложение кристаллического бихромата аммония (Nh5)2Cr2O7 при температуре 440-1400°С до образования окиси хрома обеспечивает возможность получения окиси хрома различного назначения в зависимости от конкретной температуры, лежащей в защищаемых пределах, а именно:
- при термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 440-450°С образуется окись хрома, которая используется для магнитных носителей;
- при термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 800-900°С образуется мелкокристаллическая пигментная и абразивная окись хрома;
- при термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 1200-1400°С образуется крупнокристаллическая металлургическая окись хрома.
Вымывание полученной окиси хрома Cr2O3 позволяет окончательно отмыть окись хрома Cr2O3 от водорастворимых солей, что способствует уменьшению примесей до минимальных величин.
В результате заявляемый способ позволяет упростить процесс получения окиси хрома за счет исключения многостадийной отмывки готового продукта от сульфата натрия Na2SO4, повысить качество окиси хрома за счет исключения примеси сульфата натрия и повышения содержание окиси хрома Cr2O3 в готовом продукте, составляющем более 99%, а также обеспечить возможность получения окиси хрома различного назначения.
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как "новизна".
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как "изобретательский уровень".
Условие патентоспособности "промышленная применимость" подтверждается примерами конкретного выполнения, изложенными в разделе "Сведения, подтверждающие возможность осуществления изобретения".
Для получения окиси хрома используют следующее сырье:
1. Раствор бихромата натрия Na2Cr2O7, концентрации 800-1000±100 г/л по CrO3;
2. Сульфат аммония кристаллический (Nh5)2SO4 с содержанием азота не менее 21%.
Исходный раствор готовят следующим образом.
В раствор бихромата натрия Na2Cr2O7 концентрации 800-1000 г/л по CrO3 добавляют упаренный до концентрации 300-350 г/л по CrO3 маточный раствор бихромата аммония (Nh5)2Cr2O7, возвращаемый в процесс после стадии отделения кристаллов бихромата аммония (Nh5)2Cr2O7. Компоненты смешивают в баке до получения раствора с концентрацией 400-450 г/л по CrO3, после чего в приготовленный раствор добавляют сульфат аммония (Nh5)2SO4, который задают по расчету в стехиометрических количествах к заданному количеству бихромата натрия Na2Cr2O7.
Концентрация раствора бихромата натрия Na2Cr2O7 и сульфат аммония (Nh5)2SO4, в котором происходит обменное разложение, составляет 400-450 г/л по CrO3.
Затем осуществляют обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 при температуре 100-105 в течение 45-60 минут при постоянном перемешивании с образованием бихромата аммония (Nh5)2Cr2O7 и сульфата натрия Na2SO4, происходящим по химической реакции (1), при этом весь бихромат натрия Na2Cr2O7 переводится в бихромат аммония (Nh5)2Cr2O7.
Сульфат натрия Na2SO4 в растворах бихроматов обладает ограниченной растворимостью, поэтому значительная его часть сразу же выпадает в осадок.
Далее отделяют сульфата натрия Na2SO4 от раствора, для чего пульпу сульфата натрия Na2SO4 в растворе бихромата аммония (Nh5)2Cr2O7 направляют в отстойник, где происходит осаждение основного количества кристаллов сульфата натрия Na2SO4.
Осветленный раствор бихромата аммония (Nh5)2Cr2O7 после отстойника направляют на контрольную фильтрацию на патронном фильтре, где от него отделяют оставшуюся часть сульфата натрия Na2SO4. Осадок сульфата натрия Na2SO4 из отстойника и патронного фильтра подают на центрифугу, где происходит его обезвоживание.
Кристаллы сульфата натрия Na2SO4 после центрифуги направляют в производство белого сульфата натрия Na2SO4. Маточные растворы после центрифуги возвращают в отстойник. Весь процесс отделения сульфата натрия Na2SO4 осуществляют при температуре раствора не ниже 90°С.
Затем раствор, содержащий бихромат аммония (Nh5)2Cr2O7 с концентрацией по CrO3 400-450 г/л и температурой 90°С, охлаждают до температуры 35-40°С, являющейся температурой кристаллизации бихромата аммония (Nh5)2Cr2O7.
При этом в осадок выпадают кристаллы бихромата аммония (Nh5)2Cr2O7, которые затем отделяют от маточного раствора на барабанном вакуум-фильтре.
Влажность осадка составляет 10-15%, содержание сульфатов до 1,5%.
Маточный раствор отправляют в голову процесса на упаривание, что способствует более полному вовлечению бихромата аммония (Nh5)2Cr2O7 в процесс получения окиси хрома Cr2О3, что, в свою очередь, способствует увеличению содержания окиси хрома Cr2O3 в готовом продукте до 99,5%.
Далее кристаллы бихромата аммония (Nh5)2Cr2O7 подвергают термическому разложению в барабанной вращающейся печи при температуре 440-1400°С. При этом происходит следующая химическая реакция с образованием окиси хрома Cr2О3:
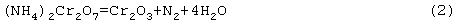
При термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 440-450°С образуется окись хрома Cr2O3, которая используется для магнитных носителей;
При термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 800-900°С образуется мелкокристаллическая пигментная и абразивная окись хрома Cr2О3;
При термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 1200-1400°С образуется крупнокристаллическая металлургическая окись хрома Cr2О3.
После получения окиси хрома Cr2О3 осуществляют ее вымывание водой при отношении Т:Ж=1:4-1:6.
Полученную при этом пульпу фильтруют на барабанном вакуум-фильтре, в результате чего осуществляется окончательная отмывка окиси хрома Cr2О3 от водорастворимых солей, что способствует уменьшению примесей и повышению содержания Cr2О3 в готовом продукте до 99,5% и выше.
Осадок окиси хрома Cr2O3 с фильтра подают в барабанную вращающуюся сушилку, где он подвергается сушке при температуре 100-150°С.
Пример.
Бихромат натрия Na2Cr2O7 с концентрацией 1000 г/л по CrO3 в количестве 1,8 м3 раствора смешивают с 10 м3 упаренного маточного раствора бихромата аммония (Nh5)2Cr2O7 с концентрацией 350 г/л по CrO3 и получают раствор с концентрацией 450 г/л по CrO3 в количестве 11,8 м3.
В 1,8 м3 раствора бихромата натрия Na2Cr2O7 с концентрацией 1000 г/л по CrO3, содержится 1,8×1000×1,31=2358 кг сухого бихромата натрия Na2Cr2O7, где 1,31 - пересчетный коэффициент из CrO3 в Na2Cr2O7. По химической реакции (1) устанавливают, что на 2358 кг бихромата натрия Na2Cr2O7 необходимо задать 1188 кг сульфата аммония (Nh5)2SO4. Это количество отвешивают на весах и задают в раствор.
Затем согласно химической реакции (1) осуществляют обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4.
По окончании обменного разложения от раствора отделяют кристаллы сульфата натрия Na2SO4 в количестве 1278 кг, которые направляют на производство белого сульфата натрия Na2SO4.
После отделения сульфата натрия Na2SO4 получают 11 м3 очищенного раствора бихромата аммония (Nh5)2Cr2O7, который затем охлаждают до температуры его кристаллизации - 35°С.
Полученные таким образом кристаллы бихромата аммония (Nh5)2Cr2O7 отделяют на вакуум-фильтре, при этом концентрация маточного раствора по CrO3 составляет 250 г/л, что обеспечивает получение кристаллов бихромата аммония (Nh5)2Cr2O7 в количестве (450-250)×11,8×1,26=2973 кг.
Маточный раствор и промывные воды с вакуум-фильтра направляют в голову процесса на упаривание.
Далее кристаллы бихромата аммония (Nh5)2Cr2O7 загружают в барабанную вращающуюся печь для термического разложения. После термического разложения по химической реакции (2) образуется 1794 кг окиси хрома Cr2O3.
Для получения окиси хрома Cr2O3, используемой для магнитных носителей, задают температуру термического разложения 440-450°С.
Для получения мелкокристаллической пигментной и абразивной окиси хрома Cr2О3 задают температуру термического разложения 800-900°С.
Для получения крупнокристаллической металлургической окиси хрома Cr2O3 задают температуру термического разложения 1200-1400°С.
Окись хрома Cr2O3, полученная заявляемым способом, содержит Cr2О3 в количестве 99,5% при минимальном количестве примесей: содержание серы S - 0,005%, содержание углерода С - 0,005%, содержание кремния SO2 - 0,07%, содержание железа FeO - 0,1%.
Таким образом, заявляемое изобретение позволяет упростить способ получения окиси хрома Cr2О3, повысить качество окиси хрома Cr2О3 за счет уменьшения примесей и повышения содержания Cr2О3 в готовом продукте, а также получать окись хрома Cr2O3 различного назначения.
Способ получения окиси хрома, включающий разложение бихромата натрия и сульфата аммония с последующим вымыванием полученной окиси хрома, отличающийся тем, что первоначально осуществляют обменное разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 мин при постоянном перемешивании с получением бихромата аммония и сульфата натрия, причем последний отделяют от раствора, а раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома.
www.findpatent.ru










