Большая Энциклопедия Нефти и Газа. Ионы хрома
Реакции обнаружения катиона хрома
Количество просмотров публикации Реакции обнаружения катиона хрома - 662
1. Пероксид водорода Н2O2 в присутствии щелочи окисляет ионы хрома Сr3+ сине-зеленого цвета в хромат-ионы СrО2-4 желтого цвета˸
2СrСl3 + 3Н2О2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8Н2О;
2Cr3+ + 3Н2О2 + 10 ОН- = 2 СгО4~ + 8Н2О.
При добавлении серной кислоты желтые хромат-ионы СrО2-4 переходят в оранжевые дихромат-ионы Сr2О2-7. Пероксид водорода в кислой среде превращает ионы Сr2О2-7 в пероксид хрома СrО5 (или надхромовую кислоту Н2СrO6), который имеет синий цвет. Если к реакционной смеси добавить диэтиловый эфир и встряхнуть, то эфирный верхний слой окрашивается в синий цвет вследствие перехода в него пероксида хрома. Реакция образования СгО5 очень чувствительна и специфична.
2. Сульфид аммония (Nh5)2S (или натрия Na2S) осаждает из растворов солей Сr3+ гидроксид хрома Сr(ОН)3 серо-зеленого цвета˸
2СrСl3 + 3(Nh5)2S + 6Н2О = 2Cr(OH)3↓ + 3h3S↑ + 6Nh5Cl;
2Cr3++ 3S2- + 6Н2О = 2Cr(OH)3↓ + 3h3S↑.
Реакции обнаружения катиона алюминия Аl3+
1. Кристаллический хлорид аммония Nh5Cl или насыщенный раствор этой соли, взятый в избытке, осаждает Аl(ОН)3 из щелочного раствора, содержащего гидроксокомплекс (гидроксокомплекс получается при прибавлении раствора щелочи к раствору соли Аl3+ до полного растворения выпадающего осадка)˸
АlСl3 + 6NaOH → Na3[Al(OH)6] + 3NaCl;
Na3[Al(OH)6] + 3Nh5Cl = Al(OH)3↓ + 3NaCl + 3Nh4↑ + 3h3O.
При этом Аl(OН)3 в присутствии Nh5Cl не растворяется, так как К0s(Аl(ОН)3) - очень малая величина.
После добавления к раствору гидроксокомплекса хлорида аммония смесь нагревают на водяной бане до полного удаления аммиака.
2. Гидроксид аммония Nh5OHосаждает из растворов солей алюминия гидроксид алюминия, который не растворим в избытке реактива.
3. Сульфид аммония (Nh5)2S из водных растворов осаждает катион алюминия Аl3+ в виде гидроксида Аl(ОН)3 за счёт гидролиза˸
2АlСl3 + 3(Nh5)2S + 6Н2О = 2Al(OH)3↓ + 6Nh5Cl + 3h3S↑;
белый
2Аl3+ + 3S2- + 6Н2О = 2Аl(ОН)3↓+ 3h3S↑.
4. Ализарин (1,2 диоксиантрахинон) образует с гидроксидом алюминия внутрикомплексное соединение — ализаринат алюминия ярко-красного цвета (алюминиевый лак)˸

Ионы Сr3+ и Zn2+ мешают проведению этой реакции, так как тоже образуют окрашенные соединения. Реакцию с ализарином целесообразно проводить капельным методом в присутствии K4[Fe(CN)6]. Мешающие определению катионы связываются гексацианоферратом (II) калия. Образующиеся соединения малорастворимы и остаются в центре пятна, а ионы Аl3+ перемещаются к ᴇᴦο периферии. При дальнейшей обработке фильтровальной бумаги парами аммиака и раствором ализарина на периферии пятна появляется розовое (ярко-красное) окрашивание ализарината алюминия на фоне фиолетовой окраски ализарина. Фиолетовая окраска фона исчезает при высушивании бумаги, а розовая окраска остается.
referatwork.ru
Бромат-ионы хрома III - Справочник химика 21
Мешающие ионы. Мешают все ионы, окисляющие бромиды ванадий (V), хром (VI), марганец (VII), церий (IV), нитрат-, иодат-и бромат-ионы. [c.981]Потенциометрическое титрование растворами солей урана (IV) применяют для определения всех упомянутых выше веществ [2, 3], а также бромат- и гексацианоферрат (П1)-ионов [2, 3), теллура (IV) [2, 3], ванадия (V) [1], хрома (VI) [1], марганца (VII) [1] и церия (IV) [1]. [c.218]
На окислительно-восстановительных реакциях основаны многочисленные методы химического анализа. В этой главе описываются свойства и применение некоторых наиболее распространенных окислительно-восстановительных титрантов. Сначала рассмотрены три самых сильных окислителя, используемые в редокс титриметрии — перманганат калия, бихромат калия и церий(IV), затем система трииодид — иодид, в которой трииодид-ион выступает в качестве окислителя в соответствующих реакциях, а иодид-ион — в качестве восстановителя со многими окислителями. Далее, обсуждено аналитическое применение иодата, перйодата и бромата — особенно для определения органических веществ. И наконец, вкратце охарактеризованы такие ценные восстановительные титранты, как железо(II), титан(III) и хром(II). [c.315]
К основным классам соединений, титруемых окислителями в неводных растворах, относятся фенолы, щавелевая, олеиновая, аскорбиновая кислоты, ненасыщенные масла, лекарственные препараты и др. К числу основных соединений, титруемых восстановителями, относятся ионы меди(II), железа (III), марганца(VII), хрома(VI), бромат, иодат и т. д. [c.232]
Вместе с ванадием (V) определяется хром (VI). Мешают бромат-, иодат- и нитрат-ионы, а также таллий (III). Фосфорная, плавиковая и мышьяковая кислоты не мешают определению. [c.726]
Раствор, содержащий алюминий и хром, обрабатывают 2 н. раствором уксусной кислоты до кислой реакции и добавляют 2 капли 2 н. раствора гидрофосфата аммония. Образуется осадок фосфата алюминия, в котором подтверждают присутствие алюминия. К раствору, содержащему ионы бария, стронция, / кальция, магния и марганца, прибавляют 2 н. раствор хромата калия. Выпавший осадок хромата бария (и свинца) обрабатывают 2—3 каплями б.н. раствора едкого натра, и в осадке производят обнаружение барня. К раствору прибавляют 2—4 капли концентрированной азотной кислоты, несколько кристаллов бромата калия и нагревают. В результате марганец выделяется в виде черного осадка марганцовистой кислоты, который после центрифугирования промывают водой, растворяют при кипячении в смеси 2 мл 6 Н. раствора азотной кислоты и 0,5 мл 3%-ного раствора перекиси водорода и обнаруживают марганец. [c.197]
Для потенциометрического определения золота применяют хлорид титана(П1). Недостаток этого реагента по сравнению с солями железа(П) —в его неустойчивости на воздухе. Цинтль и Раух [564] применяли для окисления золота(I) бромат калия. Цинтль [565] предложил потенциометрическое титрование хлоридом хрома(И). Этим реагентом можно успешно оттитровать золото(1П), медь(П) и ртуть(1). Золото растворяют в 2—5%-ной соляной кислоте с хлоридом висмута в качестве катализатора. В чистых растворах золота результаты определения завышаются вследствие каталитического разложения хлорида хрома (II) металлическим золотом. В присутствии ионов меди этого не происходит. [c.130]
Метод оксидиметрии. Под этим названием объединен ряд методов, основанных на реакциях окисления и восстановления. Титрование здесь ведется растворами окислителей или восстановителей. В зависимости от применяемого реактива различают следующие методы перманганатометрию, где используется реакция окисления перманганатом калия иодометрию — используются реакции окисления элементным иодом или восстановление иодид-ионами хрома-тометрию — используется реакция окисления бихроматом калия броматометрию — используется реакция окисления броматом калия цериметрию — используется реакция окисления солями четырехвалентного церия ванадометршо — используется реакция окисления ванадат-ионами титанометрию — используется реакция восстановления солями трехвалентного титана. [c.114]
Сопоставление энергий активации и зависимости скорости реакции от ионной силы растворов можно использовать для обсуждения механизма реакции. Например, реакция окисления метурина броматом, катализируемая хромом(VI), и реакция прямого окисления метурина хромом (VI) характеризуются близкими значе- [c.18]
РИС. 8. Зависимость скорости окисления метурина броматом и хромом (VI) от ионной силы (а) и температуры растворов (б) [27] / и 2 — катализируемая хромом (VI) и некаталитическая реакция окисления броматом 3 — окисление хромом (VI). [c.19]
М мешают, определению хрома. Однако определению хрома при его концентрации 0,1 мкг/мл в присутствии 1-10" М комплексона III пе мешают 200-кратные количества А1, Со, r(VI), Ge, Mn(II), Ni, Pt(IV), W(VI), Zn 20-кратные количества Ag, a, Fe(III), Mo(VI), Pd(ll), Se(Vl), V(V), a также 2-10" M растворы хлоридов, фторидов, нитратов, фосфатов, сульфатов, тартра-тов, иодидов, броматов и других ионов. Предел обнаружения 0,004 мкг/мл. Метод испо.тьзуют для анализа сверхчистых соляной кислоты, Ge l [448], воды [47]. [c.51]
Определение кобальта в виде комплекса с пиридин-2,6-дикарбоновой кислотой С5Нз (СООН)2 [813]. Ионы двухвалентного кобальта легко окисляются броматом калия в азотнокислой или сернокислой среде в присутствии пиридиндикарбоновой кислоты, образуя окрашенный в красный цвет анионный комплекс трехвалентного кобальта, в котором на один ион кобальта приходится две молекулы реагента. Комплекс имеет максимум поглощения при 514 ммк и молярный коэффициент погашения при этой длине волны, равный 672. Можно определять 2—100 мг мл Со. Комплекс устойчив по отношению к ионам двухвалентного олова и тиогликолевой кислоте это позволяет определять кобальт в присутствии трехвалентного марганца, который также образует окрашенный комплекс, но легко восстанавливается при действии указанных восстановителей. Не мешают катионы меди, железа и никеля, а также щелочноземельных металлов, алюминия, кадмия, ртути, галлия, индия, свинца, сурьмы, мышьяка, висмута, титана, циркония, цинка, ванадия, церия, тория, хрома, серебра, анионы перманганата, молибдата, вольфрамата, хромата. [c.145]
Медь (I). О применении одновалентной меди в кулонометриче-ской бромометрии говорилось выше [388, 398, 400, 402, 410, 4501. Этот титрант генерируют в солянокислых растворах с концентрацией путем восстановления ионов на платиновом катоде. Конечную точку в титрованиях с участием одновалентной меди определяют в большинстве случаев биамперометрически с двумя платиновыми электродами, а иногда потенциометрически [475, 4761. Описаны методы определения меди, железа [477— 479], хрома и ванадия [4801, золота [481], брома [482] и газообразного кислорода [483], основанные на реакции восстановления электрогенерированной медью указанных окислителей или промежуточных компонентов, образующихся в системе в результате взаимодействия определяемого соединения с вводимым в реакционную среду дополнительным реагентом (например, Вг при определении броматов). [c.58]
Другой механизм реакций окисления—восстановления включает перенос атома или группы атомов между окислителем и восстановителем. Наглядным примером может служить перенос атома кислорода между оксианионами. При использовании кислорода О было показано [1], что перенос атома кислорода имеет место между сульфит-ионами и ионами гипохлорита, хлорита, хлората или бромата. Таубе [5] в своих опытах продемонстрировал перенос атомов хлора от различных комплексов-окислителей типа РеСР+-Сг + при окислении солей двухвалентного хрома такой перенос возможен, так как комплекс, содержащий трехвалентный хром, после переноса обнаруживает присутствие хлора или других ионов [6]. Перенос атома водорода между двумя акво-ионами можно рассматривать как перенос электрона Хадис и Додсон [7] показали, что скорость переноса электрона между изотопсодержащими ионами в различных состояниях окисления часто больше в воде, чем в окиси дейтерия они предложили следующий механизм [c.87]
В зажиме правого манипулятора вновь крепят поршневое приспособление с пипеткой. Возвращают конус на держатель в камеру и добавляют в него, помешивая, пипеткой 10—15 тк серной кислоты. Через некоторое время растворение на холоду прекращается. Теперь в зажиме левого манипулятора крепят микронагреватель, обращают к нему камеру открытой стороной и подогревают раствор в конусе. Когда почти весь сплав растворится, добавляют в конус 5—10 тк азотной кислоты и нагревают до удаления окислов азота. Разбавляют водой до 50—70 тк. Нерастворившийся остаток отделяют центрифугированием. Раствор переносят в другой конус, после чего держатель с посудой помещают в обычную камеру, предварительно удалив из него использованный для растворения конус и сосуд с азотной кислотой и поместив в держатель новый сосуд для раствора ферроцианида калия. Вместо поршневого приспособления крепят в правом манипуляторе держатель со стеклянной иглой. На крышке камеры располагают покровное стеклышко с растертым в тонкий порошок броматом калия. Добавляют в раствор в конусе стеклянной иглой твердый бромат калия. Зеленая окраска раствора переходит в желтую хром-ион окислился до хромат-иона. [c.95]
Леонард, Шахин и Вильсон [14] нашли, что микроколичества бромата (и иодата) можно определять прямым титрованием хромом (И), используя Б качестве редокс-индикатора фенантролинат ванадия(II). Восстановленная форма комплекса окрашена в интенсивный сине-фиолетовый цвет, а окисленная — бесцветна. Для определения бромата применяют ЭДТА. Бромат-бромидную смесь можно проанализировать следующим образом бромид осаждают в виде бромида серебра, который взаимодействует с K2Ni( N)4, а освобождающиеся ионы никеля титруют стандартным раствором ЭДТА. Вторую аликвотную часть обрабатывают мышьяком (III), восстанавливая бромат до бромида, и определяют последний, повторяя все операции, описанные выше [15]. Хлориды, иодиды и тяжелые металлы мешают определению. [c.259]
Бромидно-броматная смесь. При введении бромида и бромата в кислый раствор происходит аналогичная реакция ионы водорода поглощаются, и выделяется свободный бром. В результате этого в растворе устанавливается pH 5. При кипячении анализируемого раствора выделяется висмут в виде В10Вг и отделяется таким путем от свинца, меди, хрома (III) и цинка. [c.356]
Гидразид изоникотиновой кислоты в хлористоводородной среде в присутствии иодат-ионов взаимодействует с хлоридом 2,3,5-три-фенилтетразола с образованием соединения розового цвета [57]. Для фотометрического титрования иодата, перйодата, бромата и других окислителей применен комплекс этилендиаминтетраацетата с хромом (II) [58]. [c.343]
Ионы молибдена, а также хрома и вольфрама (VI) катализируют окисление иодида броматом. Увеличение скорости реакции в присутствии катализатора объясняется образованием промежуточного комплекса Мо с броматом, который быстрее реагиует с иодид-ионом, чем броматом, который быстрее реагирует с иодид-ионом, чем НгВгО . [c.147]
Для более мягкого травления в раствор вводят фосфорную кислоту или фосфаты (рис. 16). Для регулирования травления и увеличения адгезии химически осаждаемого металла с травленой поверхностью в хромовокислые растворы вводят и другие добавки ионы тяжелых металлов, ПАВ (хромин, хромпротект), карбоновые кислоты, окислители (перманганат калия, бромат натрия) или восстановители для образования трехвалентного хрома, который при небольших концентрациях действует благоприятно. Большие количества Сг(1П) замедляют процесс травления и прочной адгезии не удается достичь, поэтому его содержание в растворе травления, превышающее 30—50 г/л, недопустимо. [c.29]
chem21.info
Катион - хром - Большая Энциклопедия Нефти и Газа, статья, страница 1
Катион - хром
Cтраница 1
Катион хрома ( II) можно легко получить и стабилизировать либо комплексообразованием, либо осаждением нерастворимых солей. [1]
Превращение катионов хрома и марганца в комплексные анионы позволяет отделить их от железа. Висмут, удержанный катионитом, затем извлекается в виде комплексного иона действием раствора йодистого КЗЛР-Я и отделяется таким путем от ионов меди и свинца. Отделение висмута от сурьмы достигается вымыванием висмута из колонки раствором роданистого аммония, образующего с висмутом комплекс. [2]
Приготавливают окрашенный раствор исследуемой смеси катионов хрома и марганца окислением их соответственно до бихромат - и перманганат-ионов. Затем измеряют его оптическую плотность при 550 ммк, когда свет поглощает лишь один перманганат-ион, и при 430 ммк, когда наблюдается суммарное светопоглощение обоими окрашенными ионами. После этого приготавливают стандартные растворы хрома и марганца, окисляют их соответственно до бихромат - и перманганат-ионов и измеряют их оптические плотности. [3]
Приготавливают окрашенный раствор исследуемой смеси катионов хрома и марганца окислением их соответственно до бихромат-и перманганат-ионов. Затем измеряют его оптическую плотность при 550 нм, когда свет поглощает лишь один пер-манганат-ион, и при 430 нм, когда наблюдается суммарное светопоглощение обоими окрашенными ионами. После этого приготавливают стандартные растворы хрома и марганца, окисляют их соответственно до бихромат - и перманганат-ионов и измеряют их оптические плотности. [5]
Приготавливают окрашенный раствор исследуемой смеси катионов хрома и марганца окислением их соответственно до бихромат-и перманганат-ионов. Затем измеряют его оптическую плотность при 550 нм, когда свет поглощает лишь один перманганат-ион, и при 430 нм, когда наблюдается суммарное светопоглощение обоими окрашенными ионами. После этого приготавливают стандартные растворы хрома и марганца, окисляют их соответственно до бихро-мат - и перманганат-ионов и измеряют их оптические плотности. [6]
Из, тетраборат-ион ( 4к) катион хрома ( Ш) ( Зк) - осадок. [7]
Другой пример - повышение полноты осаждения катионов хрома ( Ш) Сг3 виде фосфата хрома ( Ш) СгРО4, из растворов при одновременном выделении осадка фосфата железа ( Ш) FePO4, чем пользуются в аммиачно-фосфатном методе качественного анализа катионов. [8]
Как было установлено [17], с катионом хрома ( III) образуются три комплексных соединения. Трехвалентный хром реагирует с этилендиаминтетрауксусной кислотой при комнатной температуре очень медленно. Вода связана координационно, так как не выделяется при нагревании до 100 и даже в высоком вакууме. При потенциометрическом титровании этого соединения щелочью оно ведет себя как одноосновная кислота, ион водорода которой нейтрализуется уже при рН ниже 3, и не происходит изменения окраски. Это доказывает, что ближайшая сфера атома металла не подвергается изменению. При дальнейшей нейтрализации форма кривой значительно изменяется при рК 7 5, что сопровождается переходом фиолетовой окраски в синюю. В этом случае нейтрализуется ион водорода из молекулы воды и комплексное соединение превращается в гидроксокомплекс. [9]
В 3 - ю аналитическую группу входят катионы хрома, марганца, железа, кобальта, никеля и цинка, т.е. d - элементов 4-го периода, а также катионы амфотерного алюминия - р-элемента 3-го периода. [10]
Дг: гидроксид-ион ( разб, 5к) катион хрома ( И) ( 4к, см. УО - осадок; катион оксония ( п / к) - раствор. [11]
Например, при анализе катионов, для того чтобы отделить катионы хрома от катионов железа, марганца и некоторых других, их окисляют в щелочной среде пероксидом водорода до анионов СгО1 -, переходящих в раствор, в котором и открываются ионы хрома. [12]
Соли этой кислоты и соли, в состав которых входит катион хрома ( III), как соли, соответственно, слабой кислоты и слабого основания, подвержены сильному гидролизу. Поэтому водные растворы хромитов имеют сильно щелочную реакцию, а солей, содержащих катион хрома ( III) - кислую. При нагревании раствора гидролиз усиливается. Соли хрома ( III) и слабых кислот нацело гидроли-зуются. [13]
Следует считать, что эти работы подтвердили лишь факт разрядки анионов хромовой кислоты, а не трехвалентных форм катионов хрома, вводимых искусственно в ванну. Многовалентный характер ионов хрома и большая тенденция их к образованию соединений комплексного типа чрезвычайно затрудняют расшифровку механизма разряда ионов на катоде и установление того, какие ионы разряжаются. Таким образом, возможность возникновения и разряда не стабильных, промежуточных катионов двух -, трех - и четырехвалентных форм, в сочетании с разрядом ионов водорода, изменением характера среды в прикатодном слое, категорически отрицать нельзя. [14]
В этом случае говорят, что катионы калия изоморфны катионам рубидия или аммония, а катионы алюминия изоморфны катионам хрома, или железа. [15]
Страницы: 1 2 3
www.ngpedia.ru
§ 23. Соединения хрома



 Все объявления
Все объявления
ЯндексДирект
Дать объявление
низкотемпературные морозильники с температурным режимом -24С, -55С, -85С
Адрес и телефон· www.winecoolers.ru
 Применение и токсичность соединений хрома. Соединенияхромашироко используются в различных отраслях народного хозяйства. Они применяются в кожевенной и текстильной промышленностях, используются для хромирования металлических изделий, для производства спичек,красок, кино- ифотопленок. Вхимическойпромышленности соединенияхромаприменяются какокислители. Ряд соединенийхромаприменяется вхимическихлабораториях в качестве реактивов. Ввидутоксичностисоединенийхромаони не применяются в медицине.
Применение и токсичность соединений хрома. Соединенияхромашироко используются в различных отраслях народного хозяйства. Они применяются в кожевенной и текстильной промышленностях, используются для хромирования металлических изделий, для производства спичек,красок, кино- ифотопленок. Вхимическойпромышленности соединенияхромаприменяются какокислители. Ряд соединенийхромаприменяется вхимическихлабораториях в качестве реактивов. Ввидутоксичностисоединенийхромаони не применяются в медицине.
Из соединений хрома, применяемых в различных отраслях народного хозяйства, наиболее ядовитыми являютсяхроматыидихроматы. Причемдихроматыболее ядовиты, чемхроматы.Хроматыидихроматыоказывают раздражающее и прижигающее действие накожуи слизистые оболочки, вызывая изъязвления. Под влияниемхроматовидихроматовможет наступитьгемолизи образуетсяметгемоглобин. После поступления соединенийхромаворганизмчерез пищевой канал может наступать припухлость, а затем ожоги слизистых оболочек рта, пищевода и желудка. Пораженные соединениямихромаучастки пищевого канала приобретают желтую окраску. При отравлении соединениямихромамогут наступить понос и кровавая рвота. Иногда рвотные массы имеют желтую или зеленую окраску. При поступлении ворганизмбольших количествпыли, содержащей соединенияхрома, развивается пневмония.
При острых отравлениях соединениями хромаони накапливаются в печени, почках и эндокринныхжелезах. Соединенияхромавыводятся изорганизмав основном через почки. В связи с этим при отравлении указанными соединениями поражаются почки и слизистые оболочки мочевыводящих путей.
Исследование минерализатов на наличие хрома
После разрушения биологического материала серной и азотной кислотамив полученном минерализатехромв основном находится в трехвалентном состоянии. Для обнаруженияхромав минерализатах применяют реакцию образования надхромовой кислоты и реакцию сдифенилкарбазидом.
Реакция образования надхромовой кислоты.ИоныхромаCr3+окисляют при помощиперсульфата аммонияв присутствиикатализатора(соли серебра) до дихромат-ионов. После прибавленияпероксида водородакдихроматуобразуется надхромовая кислота, имеющая голубую или сине-голубую окраску. Этой кислоте приписывают несколько формул: Н2CrO6, Н3CrO8, Н7CrO10и др.
Образование надхромовой кислоты можно представить следующими уравнениями:
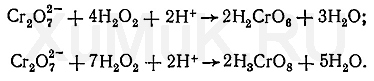
Чувствительность реакции образования надхромовой кислоты понижается в присутствии солейжелеза(III) исурьмы(III), для маскировки которых прибавляют фосфаты. Надхромовая кислота быстро разлагается в водныхрастворах. Поэтому из водныхрастворовее экстрагируют органическимирастворителями(этиловый эфир,этилацетат,амиловый спирти др.), в которых надхромовая кислота более устойчива, чем вводе.
Выполнение реакции.В пробирку вносят 5 мл минерализата, по каплям прибавляют 30%-йрастворгидроксида натриядо рН = 7. Затем в пробирку вносят еще 1 мл минерализата и содержимое пробирки взбалтывают. После этого в пробирку вносят 1—2 капли 10 %-горастворанитрата серебра, 0,5 гперсульфата аммонияи нагревают на кипящей водяной бане в течение 20 мин. Затем пробирку с содержимым охлаждают в ледянойводев течение 10—15 мин. К охлажденнойжидкостидобавляют 1 мл насыщенногорастворадигидрофосфатанатрияи проверяют рН среды. При необходимостижидкостьдоводят до рН=1,5—1,7. После этого в пробирку вносят уксусно-этиловый эфир, толщина слоя которого должна быть около 0,5—0,6 см, и 2—3 капли 25 %-горастворапероксида водорода. Содержимое пробирки энергично взбалтывают. При наличииионовхромаCr3+в мине-рализате слой органическогорастворителяприобретает окраску (от голубой до синей). Предел обнаружения: 2 мкгхромав 1 мл. Граница обнаружения: 0,2 мгхромав 100 г биологического материала.
Реакция с дифенилкарбазидом.При выполнении этой реакцииионыхрома, находящиеся в минерализате, окисляютперсульфатом аммонияв присутствиикатализатора(ионы серебра) до дихромат-ионов. Чувствительность этой реакции понижаютионыжелеза(III),сурьмы(III) и др. Для маскировки мешающихионовприбавляют фосфаты.
Образовавшиеся дихромат-ионы реагируют с дифенилкарбазидом. Вначале дихромат-ионы окисляютдифенилкарбазид(I) додифенилкарбазона(II), который не имеет окраски. При дальнейшемокисленииобразуется дифенилкарбадиазон (III), имеющий светло-желтую окраску:

При этой реакции дихромат-ионы восстанавливаются до двухвалентного хромаCr2+, но не до Cr3+.ИоныCr2+с енольной формойдифенилкарбазона(IV)даютвнутрикомплекснуюсоль(V), имеющую красно-фиолетовую окраску:
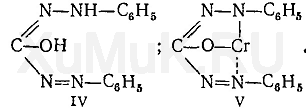
Выполнение реакции.В пробирку вносят 1 мл минерализата, к которому прибавляют 4 млводы, 1 каплю 10 %-горастворанитрата серебраи 0,5 гперсульфата аммония. Пробирку со смесью нагревают на кипящей водяной бане в течение 20 мин, а затем в нее вносят 1 мл насыщенногорастворадигидрофосфатанатрияи по каплям добавляют 5 %-йрастворгидроксида натриядо рН=1,5—1,7. После доведенияжидкостидо указанного рН к ней добавляют 1 мл 0,25 %-горастворадифенилкарбазидав смесиэтилового спиртаиацетона(1:1) и взбалтывают содержимое пробирки. При наличииионовхромав минерализатерастворприобретает розовую или красно-фиолетовую окраску. Предел обнаружения: 0,002 мкгхромав 1 мл. Граница обнаружения: 0,1 мгхромав 100 г биологического материала.
Обнаружение хромат-ионов в присутствии перманганат-ионов.Обнаружению хромат-ионов при помощи реакции сдифенилкарбазидоммешают перманганат-ионы, имеющие собственную окраску. Поэтому перед выполнением реакции на хромат-ионы сдифенилкарбазидомвосстанавливают перманганат-ионы при помощиазида натрияNaN3, который представляет собойсольазотистоводородной кислотыΗ—Ν=Ν≡Ν. Хромат-ионы сазидом натрияпрактически не реагируют. Несколько кристалликовазида натриядостаточно для быстроговосстановленияперманганат-ионов.
Выполнение реакции.В углубление на капельной пластинке вносят каплю исследуемогораствора, прибавляют каплю концентрированнойсерной кислотыи несколько кристалликовазида натрия. Смесь перемешивают стекляннойпалочкойдо исчезновения окраски перманганат-ионов. Затем прибавляют каплю 1 %-го спиртовогорастворадифенилкарбазида. В присутствиихроматовпоявляется сине-фиолетовая или красная окраска. Предел обнаружения: 0,5 мкг хромат-ионов в пробе.
studfiles.net
Хром III действие на ионы
Представляет интерес экспериментальное использование хрома при образовании комплексов Сг(1П) с нуклеотидами, например с АТР". Хром вытесняет ионы магния, образуя с нуклеотидами очень прочные хелатные комплексы. Характерные для таких комплексов полосы поглощения света и парамагнитные свойства ядер хрома делают эти комплексы интересным орудием при исследовании механизмов действия фосфотрансфераз. [c.506] Число реакций, катализируемых Сг(П1), ограничено вследствие склонности Сг(1П) к образованию кинетически инертных аквокомплексов, в которых скорость обмена координационно связанной воды на другие лиганды очень мала (см. табл. 4). Большинство кинетических методов определения хрома основано на каталитическом действии ионов Сг(УТ) в реакциях окисления перекисью водорода органических соединений. Выход реакций определяют фотометрическими, люминесцентными и полярографическими методами. [c.59]Окисление кумола в присутствии солей марганца, кобальта, хрома, свинца, железа, меди, никеля показало, что соли металлов переменной валентности значительно ускоряют процесс гомогенного окисления. Резинат марганца ускоряет окисление кумола особенно эффективно в начальной стадии, сильно сокращая индукционный период. При добавлении более 5 — 10 мг л эффективность резината марганца снижается, и при концентрации 72—144 мг/л скорость накопления гидроперекиси резко падает, так как существенно вырастает скорость распада гидроперекиси кумила под действием ионов марганца. С повышением концентрации катализатора кинетика накопления гидроперекиси перестает зависеть ог температуры. Так, при концентрации резината марганца 0,36 мг л кинетические кривые накопления гидроперекиси при 110 и 120° С практически совпадают [30]. [c.339]
Примечание. Определение никеля можно проводить в присутствии Ре +, Мп , Си и Сг +. Влияние устраняют связыванием его в устойчивый виннокислый комплекс Мп + даже при трехкратном избытке по отношению к ионам никеля определению не мешает. Мешающее действие ионов меди не сказывается при содержании до 20% (по отношению к количеству никеля), а влияние ионов хрома устраняют добавлением Сг + в раствор сравнения и стандартные растворы. [c.364]
На рис. 12-12 приведен пример исследования поверхности с помощью оже-спектроскопии [13]. (Заметим, что кривые на рисунке есть производные сигнала.) Исследовалась кремниевая пластинка, покрытая слоем нихрома. Первоначально на поверхности в наибольшей концентрации присутствовали атомы кислорода. После удаления под действием ионного пучка поверхностного слоя толщиной 10 нм кислород практически исчезал и появлялись хром и никель, а на глубине 20 нм практически исчезали и они, уступая место чистому кремнию. Очевидно, что [c.263]
Изучение относительной скорости восстановления замеш енных бензил-хлоридов под действием ионов двухвалентного хрома в водном этаноле при 27,5 0,5° С показало следующие отношения, представленные в табл. 5 303] [c.528]
Опыт 7. Действие иона СОз . Карбонаты щелочных элементов выделяют из раствора солей хрома (П1) серо-зеленый осадок гидроксида хрома [c.278]
Для мытья посуды, предназначенной для бактериологических, фармакологических и биологических исследований, не следует использовать хромовую кислоту из-за биологического действия ионов хрома [6]. [c.34]
В современных хроматографах Цвет , ЛХМ-8М0, Хром наряду с катарометрами используют более чувствительные детекторы, в частности, пламенно-ионизационные детекторы, действие которых основано па следующем. При обычных условиях газы ие проводят ток. Но еслп под действием пламени или изучения в газе образуются ионы и электроны, оп становится проводимым. За счет сгораиия водорода в детекторе (рис. 13) возникает пламя. Как только в пламя попадает компонент, образуются заряженные частицы, и между электродами, к которым прилагается напряжение --200 в, протекает ток он усиливается и подается на записываю-П1,ее устройство. [c.22]
Так как коррозия развивается вследствие преимущественной диффузии ионов железа через поверхностную пленку к газообразной среде, то наружный слой этой пленки обогащен серой и состоит из РеЗг. При повышении температуры РеЗг начинает распадаться с выделением элементной серы и образованием более термостабильного сульфида. Высокотемпературная коррозия под действием сероводорода в процессе гидроочистки наиболее опасна в интервале 350—450 °С, особенно если она сопровождается обезуглероживанием карбидных соединений. Последнее приводит к меж-кристаллитному разрушению металла — так называемой межкри-сталлитной коррозии. Чтобы ее предотвратить, достаточно легировать сталь 17% хрома. При температурах ниже 260 °С газообразные смеси с любым содержанием сероводорода малоагрессивны. [c.253]
Согласно второй точке зрения, металлы, пассивные по определению 1, покрыты хемосорбционной пленкой, например, кислородной. Такой слой вытесняет адсорбированные молекулы НаО и уменьшает скорость анодного растворения, затрудняя гидратацию ионов металла. Другими словами-, адсорбированный кислород снижает плотность тока обмена (повышает анодное перенапряжение), соответствующую суммарной реакции М гё. Даже доли монослоя на поверхности обладают пассивирующим действием [16, 17]. Отсюда следует предположение, что на начальных этапах пассивации пленка не является диффузионно-барьерным слоем. Эту вторую точку зрения называют адсорбционной теорией пассивности. Вне всякого сомнения, образованием диффузионно-барьерной пленки объясняется пассивность многих металлов, пассивных по определению 2. Визуально наблюдаемая пленка сульфата свинца на свинце, погруженном в НаЗО , или пленка фторида железа на стали в растворе НР являются примерами защитных пленок, эффективно изолирующих металл от среды. Но на металлах, подчиняющихся определению 1, основанному на анодной поляризации, пленки обычно невидимы, а иногда настолько тонки (например, на хроме или нержавеющей стали), что не обнаруживаются методом дифракции быстрых электронов . Природа пассивности металлов и сплавов этой группы служит предметом споров и дискуссий вот уже 125 лет. Представление, что причиной пассивности всегда является пленка продуктов реакции, основано на результатах опытов по отделению и исследованию тонких оксидных пленок с пассивного железа путем его обработки в водном растворе К1 + или в ме-танольных растворах иода [18, 19]. Анализ электроно рамм пле- [c.80]
Следует отметить, что оценка свойств гидроксидов с точки зрения представлений Косселя носит приближенный характер, ибо исходным критерием служит только радиус иона. Поскольку не принимаются во внимание такие важные критерии, как тип иона и его поляризующее действие, то возможны противоречивые выводы. Например, исходя из радиус иона 8с (0,83 А гидроксид скандия должен был бы Обладать амфотерными свойствами, а в действительности он является осиМаниеМ. У трехвалентного хрома радиус иона еще меньше и равен 0,64 А, НО его гидроксид, в отличие от гидроксида скандия, амфотерен. Здесь скаэьвиется Другой тип иона (тип 8 + пе ), отличающийся высокими П0ляриза191бнными свойствами. [c.178]
Вместе с тем, необходимо выделить группу легко пассивирующихся металлов и сплавов, коррозионная устойчивость которых в атмосферных условиях не уступает благородным металлам. К ним следует отнести титан, тантал, цирконий, ниобий, хром, алюминий. Пассивное состояние этих металлов обусловлено образованием на их поверхности химически инертных оксидны пленок. Пассивирующие пленки могут разрушаться под действием ионов галогенов (С1-, Вг , 1 , Р ), поэтому в морской атмосфере на алюминиевых сплавах, нержавеющих сталях и других пассивирующихся системах могут появляться локальные очаги коррозии. [c.90]
Модификация медного катализатора, полученная введением окиси хрома, является особенно подходящим катализатором дегидрирования спиртов. Данбар и Арнольд [268] получили активный и стабильный катализатор, осу-1цествив совместное осаждение окислов меди и хрома действием разбавленного едкого натра на 15—20%-ный раствор нитратов меди и хрома. Осадок фильтровали, отмывали водой до освобождения от ионов и замешивали с силикагелем. Полученный катализатор сушили при 105—110° и восстанавливали водородом [c.134]
А. М. Смирнова и Н. Т. Кудрявцев отмечают, что ультразвук практически не влияет на характер зависимости выхода по току от изменения состава электролита и режима осаждения, а также на внешний вид, твердость и внутренние напряжения в электроосажденном хроме. Действие ультразвука аналогично действию интенсивного перемешивания, при котором резко снижается катодная поляризация при низких плотностях тока и не наблюдается практически изменения поляризации при высоких значениях На вращающемся катоде и в ультразвуковом поле начало осаждения хрома сдвигается в сторону более высоких плотностей тока. После устранения ультразвука хром начинает осаждаться при том же режиме, при котором в ультразвуковом поле не происходило осаждения. Из этого авторы заключают, что наложение ультразвукового поля тормозит выделение хрома, что, по-видимому, объясняется затруднениями в образовании на катоде адсорбционной пленки, обусловливающей повышение потенциала катода до величины, обеспечивающей восстановление шестивалентных ионов хрома до металла. [c.76]
Восстановление заключается в реакции связи Сг = 0 с AgH+ с превращением в Сг—О—Н и освобождением электронов с параллельными спинами, характеризуюшими хром в состоянии окисления — 3. Это сопровождается выигрышем обменной энергии, который обеспечивается в состоянии максимальной мультиплетности. К такому же типу относится и каталитическое действие ионов меди [8]. [c.235]
Нестабильность перекиси водорода и чувствительность к различным загрязнениям долгое время являлись серьезным препятствием на пути ее широкого внедрения в технику. Было проведено много работ по изысканию способов стабилизации перекиси водорода, в результате чего было установлено, что в качестве стабилизаторов могут быть использованы ортофосфорная и пирофосфориая кислоты и их соли, оловянная кислота и ее соли, гидроксихиполин и др. [4, 9, 22]. Практическое применение нашли ортофосфорная кислота, стан-наты и пирофосфаты. Так, при добавлении к 87%-пой перекиси водорода 23 мг л ортофосфорной кислоты стабильность ее значительно повышается [9]. Действие стабилизатора зависит от его природы и характера загрязнений. Универсального стабилизатора перекиси водорода пока не найдено.Например, катализируюш,ее действие ионов меди заметно ослабляется оловянной кислотой и ее солями, а ионов хрома — ортофосфорной кислотой и пирофосфатами. [c.654]
Однако большое число экспериментальных данных не объясняется удовлетворительным образом при помощи хиноидных формул красящих солей. Так, например, не совсем ясно, почему красящая соль (розанилин) значительно глубже и сильнее окрашена, чем соответствующее иминное основание (основание Гомолки), так как, согласно формулам, оба вещества имеют один и тот же хромофор (хинон-иминную группу) и, следовательно, должны были бы быть одинаково окрашены. Далее, классическая теория не может объяснить, почему введение второго ауксо-хрома в ион фуксониммония вызывает сильное углубление и усиление цвета (см. выше, хлоргидрат фуксониммония и фиолетовый Дебнера). Вообще говоря, старая теория не в состоянии объяснить действия ауксохромных групп. [c.528]
По отношению к хрому активирующее действие ионов хлора не проявляется, хром очень легко пассивируется при анодной поляризации в растворах хлоридов, и поэтому влияние SO 4"" не может быть выявлено. На молибденовый электрод ионы сульфата в присутствии хлоридов не оказывают влияния. По отношению к твердому раствору железо — хром (сталь Х28) пассивирующие свойства сульфат-ионов проявляются вполне определенно (рис. 150). В чистом хлориде эту сталь можно заполяризовать лишь до потенциала +0,6 в, после чего она переходит в активное состояние. В присутствии же сульфата сталь удается заполяризовать до +1,2 в. Наблюдаемый эффект аналогичен тому, который был получен на хромоникелевой стали IX18H9T. [c.307]
Исследование пассивирующего действия сульфат-ионов с помощью меченых атомов. Для того чтобы доказать адсорбционный механизм пассивирующего действия сульфат-ионов, изучали адсорбцию хлор-ионов с помощью радиоактивного индикатора F (период полураспада 4-10 лет, удельная активность 0,058 мкюри/г). Число адсорбированных ионов хлора определяли по изменению активности 0,01-н. Na l, отбирая пробы до и после адсорбции. Чтобы эти изменения концентрации хлористого натрия были значительными, использовали пористый электрод с больщой поверхностью (около 10 см ), полученный прессованием порошка хрома [23]. Применение хромового электрода вместо электрода из нержавеющей стали принципиально возможно, так как было показано, что именно наличие хрома в составе нержавеющих сталей определяет в основном пассивирующее действие ионов SO4". Адсорбция выражалась количеством хлор-ионов, поглощенных образцом из раствора. В электролитической ячейке катодное и анодное пространства были разделены, чтобы воспрепятствовать диффузии продуктов катодной реакции к аноду. [c.309]
Весьма йерспективньш источником для световой сварки является оптический квантовый генератор— лазер. В настоящее время мощность лазерных источников достаточна для расплавления любых металлов. Для световой сварки могут применяться оптические квантовые генераторы как импульсного действия с твердым активным веществом, в качестве которого наиболее часто используется синтетический рубин (окись алюминия с добавкой окиси хрома), так и непрерывного действия — ионно-газовый лазер. Излучение лазера с помощью оптической системы может быть сфокусировано в пятно очень малых размеров, обладающее высокой плотностью энергии. [c.156]
Замещение лигандов в инертных комплексах проходит с большим трудом, исключительно медленно, даже в условиях, при которых комплексы термодинамически не очень устойчивы. Подобные соединения часто образуют хром (III), кобальт (III), платиновые металлы. Способность давать такие комплексы проявляется при экстракции внутрикомплексных соединений прежде всего на стадии экстракции — инертным оказываются, например, акво-комплексы. Для того чтобы обеспечить образование внутрикоми-лексного соединения, в ряде случаев нужно нагревать раствор элемента с реагентом, введенным в водную фазу. Это было уже рассмотрено в главе I и в предыдущем параграфе. Сейчас для нас важно, что образовавшиеся в тех или иных условиях внутрикомплексные соединения сами нередко оказываются инертными. Протолиз их (разрушение за счет действия ионов водорода) проходит очень медленно. [c.170]
Такое действие ионов подтверждается и опытами Кюсснера, который, подвергая анодному воздействию металлические хром и марганец в растворах при различных температурах, часто получал ионы хрома и марганца всех возможных валентностей, но лишь в различных соотношениях. [c.440]
При инициировании реакции окисления изопропилового спирта в качестве инициаторов были испытаны сернокислые соли кобальта, хрома и марганца. В табл. 3 приведены результаты инициирующего действия этих металлов. Как видно, инициирующее действие ионов металлов, по сравнению с перекисными соединениями и газообразным бромистым водородом, выражено гораздо слабее. Из трех металлов, действие ионов которых здесь изучалось, наи-лучщими инициирующими свойствами обладают ионы кобальта. [c.32]
Это общая схема реакции, которая включает, вероятно, ряд элементарных стадий. Изучение [29] диспропорционирования катиона бнс-я-дифенилхрома показало, что образующийся вначале ион хрома действует далее как восстановитель [c.220]
В сернокислой среде окисляют ион хрома до иона СГО4 действием надсернокислого аммония в присутствии катализатора — азотнокислого серебра. [c.127]
Реагенты, генерируемые фотохимическим путем. При неизме-няющемся коэффициенте полезного действия генерации количество образующегося реагента пропорционально произведению времени облучения на интенсивность облучения при постоянной интенсивности света оно пропорционально времени облучения. Единственным примером фотохимического титрования может служить титрование соединений ванадия (V) и хрома (VI) ионами железа (И), генерируемыми фотохимическим путем из ионов железа (П1) в присутствии щавелевой кислоты . [c.18]
Опыт 9. Действие иона НР04 . Гидрофосфаты щелочных металлов осаждают аморфный осадок фосфата хрома зеленого цвета [c.279]
Сарджент высказал впервые идею об образовании на поверхности катода пленки, состоящей из продуктов восстановления хромовой кислоты и препятствующей осаждению хрома. Действие сульфат-ионов при электровосстановлении хромовой кислоты Либрейх трактовал с точки зрения растворения образующейся на катоде пленки, которая препятствует разряду ионов хрома. Эта идея о наличии на поверхности катода пленки и ее влияния на процесс восстановления хромовой кислоты была более обстоятельно развита в работах ]Июллера [17]. Он предположил, что во время электролиза на поверхности электрода образуется нерастворимая пленка примерно следующего состава [c.157]
Определению мешает присутствие в стали кобальта, а также больших количеств (>2%)хрома. В первом случае фиксирование точки эквивалентности при титровании становится невозможным из-за наличия имеющих розовую окраску Со -ионов, а во втором — сильно затрудняется образованием Сг О "-ионов при действии (Nh5)2S208. [c.391]
В основе бихроматометрии лежат реакции окисления бихромат-ионом. Окисляющее действие его обусловлено переходом анионов гО . содержащих хром в степени окисления +6, в катионы Сг + [c.392]
chem21.info
Основные свойства ионов хрома - Справочник химика 21
Теория Бренстеда — Лоури объединяет в общую группу прото-литических реакций все виды взаимодействия между кислотами и основаниями, в том числе нейтрализацию, гидролиз, диссоциацию кислот и оснований, распад растворителя на ионы и др. Из определения кислоты и основания по протолитической теории вытекает, что все атомы, характеризующиеся большой электроотрицательностью, могут образовывать кислоты, так как сильнее притягивают электроны, чем протоны. Наоборот, атомы, обладающие малой электроотрицательностью, могут образовывать основания, так как они сильнее притягивают протоны, чем электроны. Отсюда следует, что в высшем состоянии окисления элемент должен образовать соединение, со свойствами кислоты, так как электроотрицательность центрального комплексообразующего атома возрастает с повышением состояния окисления химического элемента. Например, соединения Мп (И) и Мп (ИГ) обладают основными свойствами, соединения Мп (IV) амфотерны, Мп (VI) и Мп (VII) образуют кислоты. Аналогичные соотношения наблюдаются у хрома, ванадия и других элементов. Можно сказать, что основания обладают присущими им свойствами не потому, что они способны отщеплять гидроксильный ион, но вследствие того, что гидроксильный ион способен присоединять протон с образованием воды. [c.54] Особое свойство ионов М + состоит в их способности образовывать основные карбоксилаты, в которых атом кислорода расположен в центре треугольника из атомов металла (24.1), сами металлы связаны мостиковыми карбоксильными группами, а шестое координационное место у каждого из них занято молекулой воды или другим лигандом. Эта структура с оксо-центром доказана для карбоксилатов хрома, марганца, железа, рутения, родия и иридия. Такие же структуры были найдены для соединений кобальта (III), [c.450]Катализаторами окисления НС1, как видно из изложенного выше материала, могут быть соединения как переходных (Си, Fe, Сг и др.), так и непереходных (Mg и др.) металлов. Поэтому можно предполагать, что для протекания этого процесса необходимой предпосылкой является активация молекулы НС1, которая происходит путем ее координационного связывания с катализатором. Поэтому кислотно-основные свойства катализаторов, обусловливающие их способность образовывать с НС1 соединения координационного типа, являются, очевидно, обязательным условием проявления активности контактов в рассматриваемой реакции. Хлорная медь, как уже отмечалось, и, по-видимому, в меньшей мере, хлориды других элементов, обладают такой способностью. У окиси хрома склонность к координационному связыванию НС1 резко увеличивается после адсорбции кислорода, создающей на поверхности ионы Сг +. [c.280]
Обработку металлов и покрытий можно проводить в хромат-но-фосфатных растворах, которые используются в основном для обработки металлов и покрытий на основе алюминия и его сплавов, цинка, кадмия и др. с целью получения поверхностных слоев, отличающихся высокими коррозионно-защитными свойствами и повышенной стойкостью к истиранию. Защитная способность пленок в коррозионно-активных средах связана с наличием шестивалентных ионов хрома, обладающих сильным пассивирующим действием, а также соединений трехвалентного хрома, образующего труднорастворимые соединения, а повышение стойкости пленок в условиях истирания — с наличием в растворе нитрата свинца [10]. [c.51]
Ничего общего в электронной структуре того и другого иона нет. Но у них одинаковая валентность (-+-3) и близкие значения ионного радиуса. Этим и объясняется, что в трехвалентном состоянии хром как бы повторяет в основном свойства классического трехвалентного металла — алюминия. [c.676]
Степень окисления иона оказывает существенное влияние на его химические свойства. Чем выше степень окисления, тем сильнее проявляются кислотные и ослабляются основные свойства элемента и тем больше степень гидролиза его солей. Например, pH растворов солей Fe составляет 5—6, а солей Fe + — около двух. Гидроксид сурьмы (III) обладает амфотерными свойствами, а сурьмы(V)—кислотными гидроксид хрома (III) имеет амфотерные свойства, а ион СгО , где хром имеет степень окисления -4-6, является анионом кислоты средней силы и т. д. [c.17]
В ряду гидроокисей хрома различных степеней окисления Сг(ОН)г—Сг(ОН)з—НгСгО закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловдено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Если соединения двухвалентного хрома очень сильные восстановители и легко окисляются в трехвалентное состояние, то соединения трехвалентного хрома могут, с одной стороны, проявлять окислительные свойства при действии сильных восстановителей, переходя в соединения хрома (2+). а с другой стороны, сильными окислителями (например, галогенами) могут быть окислены в соединения шестивалентного хрома. [c.343]
Поэтому окиси многих металлов могут действовать в них как основания -доноры ионов 0 " и благодаря этому легко в них растворяться с образованием часто характерно окрашенных растворов. Ион ВО2 может, помимо акцепторных (кислотных) свойств, проявлять и донорные (основные) свойства. Они проявляются, например, в присутствии трехокиси хрома [c.227]
С возрастанием валентности и уменьшением ионного радиуса элемента основные свойства его гидрата окисла должны ослабляться, а кислотные усил иваться. Это мы и наблюдаем на гидратах окислов хрома [c.149]
Возможно ли получение иона Сг + Устойчиво ли это состояние Какими свойствами должен обладать гидроксид хрома (И) — кислотными или основными Приведите уравнения реакций. [c.167]
У металлов, проявляющих разные степени окисления, характер соединений может быть различным и подчиняется определенным закономерностям. В частности, чем больше радиус иона металла и меньше его степень окисления, тем сильнее выражены основные свойства у оксида и гидроксида этого металла. И, наоборот, с уменьшением радиуса иона металла и увеличением степени окисления усиливаются кислотные свойства его соединений. Например, оксид хрома (И) СгО—основной, оксид хрома (И1) СггОэ — амфотерный, а оксид хрома (VI) СгОз — кислотный. [c.260]
Закономерности в изменении потенциала и скорости коррозии находятся в хорошем соответствии с теми значениями концентрации хромат-ионов, которые содержатся в водных вытяжках. Все это указывает на то, что основным пассивирующим агентом в пигментных смесях является хромат-ион. При исследовании кинетики анодной реакции также подтвердилось, что пассивирующие свойства водных вытяжек сильно зависят от соотношения пигментов в водной вытяжке, полученной из одного фосфата хрома, стальной электрод слабо пассивируется. В вод- [c.143]
Хром(П1)-наиболее распространенное состояние окисления хрома. Хром(П)-хороший восстановитель, а Сг(1у)-хороший окислитель. Как и следует ожидать, кислотность оксидов хрома изменяется в зависимости от его степени окисления СгОз обладает кислотными свойствами, СГ2О3-амфотерными, а СгО и Сг(ОН)2-основными. Распространенным оксианионом хрома является желтый хромат-ион, СгО , который в кислом растворе димеризуется с образованием оранжевого бихромат-иона [c.443]
Величина IgPpfi меняется в пределах 2,28—2,43. В эту подгруппу сульфидов включаются MnS, FeS, oS, NiS, ZnS. К ним относится и сульфид ванадила VOS. Все сульфиды подгруппы сернистого аммония окрашены, кроме сульфида цинка (белый). Так как катион хрома (II) обладает сильным восстановительным действием и неустойчив (хотя и образуют черный очень малорастворимый сульфид rS), то здесь рассматриваются катионы хрома (III), хромат- и бихромат-ионы кроме марганца (II), рассматриваются также манганат- и перманганат-ионы. Аналитические свойства хрома (III) объясняются структурой электронейтрального атома (ЗiiЧs ). То же самое наблюдается у меди (И) (3d "4si). Трисульфид хрома черно-коричневый, подвергается гидролизу вследствие меньшей растворимости гидроокиси хрома (III). В табл. 38 сопоставлены основные характеристики катионов этой подгруппы. Все катионы данной подгруппы легко переходят из одной степени окисления в другую, используются при редоксметодах анализа и как катализаторы в кинетических методах. В химико-аналитических реакциях этих ионов сказывается сходство их электронной структуры по горизонтальному направлению. Катионы ярко окрашены и образуют разнообразные комплексные соединения. 8-оксихинолин, который называют органическим сероводородом , дает характерные, ярко окрашенные внутрикомплексные соединения с этими катионами, начиная от титана и до цинка (табл. 38). [c.205]
Все три элемента близки по химическим свойствам. Это относится, в частности, к поливалентности, способности образовывать изополи-и гетерополисоединения, проявлению как металлических, так и неметаллических свойств.Основные свойства окислов усиливаются от хрома к вольфраму. Хромовая кислота Н2СГО4 более сильная, чем вольфрамовая. Устойчивость соединений с низшей валентностью растет от вольфрама к хрому. Соединения Мо(У) более устойчивы, чем (V). Соединения Сг(П1) — ярко выраженные ионные соединения. Соединения (У) и Мо(У) почти не имеют ионного характера. Об этом, в частности, говорит их высокая летучесть. Молибден и вольфрам намного более способны образовывать изополи- и гетерополисоединения, чем хром. [c.159]
Хром находится в 6-й группе, в его электронной оболочке на два электрона больше, чем у титана. В основном состоянии атом хрома содержит две полузаполненные оболочки [Аг]3( 4з с шестью неспаренными электронами. Благодаря наличию шести валентных электронов и не очень высокой электроотрицательности хрома (1,6) химия его очень богата и разнообразна он проявляет все степени окисления от -2 до -Ьб. Как и в случае титана, самые низкие степени окисления (-2, -1,0 и -Ы) проявляются только в комплексных соединениях с л-акцепторными лигандами, например в карбониле Сг(СО)в. Наиболее характерна для хрома степень окисления -ЬЗ и, соответственно, электронная конфигурация иона В природе хром встречается в основном в виде соединений Сг(Ш), например хромистого железняка ГеО СГ2О3, правда на Урале встречается красная свинцовая руда РЬСгО , в которой хром находится в степени окисления -Ьб, характеризуюш ейся выраженными окислительными свойствами. [c.347]
Типы хемосорбции, наблюдаемые на окиси хрома, рассмотрены Барвеллом и др. [63, 64] хемосорбция на окиси хрома, так же как и на окиси алюминия, может быть диссоциативной и недиссоциативной. Основное качественное различие между окисью хрома и окисью алюминия в отношении хемосорбционных свойств связано с влиянием переменной валентности хрома. Вследствие этого окись хрома, во-первых, легко адсорбирует кислород с образованием поверхностных ионов хрома, имеющих заряд больше трех. Во-вторых, окись хрома легче, чем окись алюминия, диссоциативно хемосорбирует такие молекулы, как водород или алканы, так как поверхностные ионы могут [c.65]
Значительное сходство в свойствах соединений молибдена и вольфрама проявляется в их ярко выраженной способности образовывать изо- и гетерополисоединения (см. 9.4). У хрома эта способность выражена гораздо слабее. В нормальных молибдатах или вольфраматах одновалентных металлов отношение МаО МоОз= = 1(или МаО 0з=1). В изополимолибдатах МаО МоО ,Изополимолибдаты (изополнвольфраматы) изучены в основном для щелочных металлов и иона аммония ЫН . Подобные соединения для щелочно-земельных и других металлов известны, но мало изучены. По количеству молекул МоОз и Оз, входящих в состав изополисоединений, различают целый ряд типов этих соединений, существующих в основном в водной форме. Например [c.384]
В практическом отношении нри выборе системы раствор— носитель всегда следует помнить о возможной сильной агрессивности раствора в отношении носителя при очень высоком или очень низком pH. Степень этого воздействия зависит, кроме всего прочего, и от величины поверхности носителя. Опыт показывает, что вещества в активной форме (например, у-АЬОз) намного реакционноспособнее, чем вещества, подвергнутые высокотемпературной обработке и превращенные в кристаллические модификации с низкой поверхностью и с низкой собственной активностью (например, а-А Оз). Уголь относительно инертен, особенно в сильнографитированном состоянии, но окись алюминия с высокой поверхностью и окись хрома чувствительны к воздействию растворов с высоким и низким pH на алюмосиликаты и цеолиты действуют растворы с низкими pH, а на двуокись кремния с высокой поверхностью— растворы с высоким pH. Эта проблема возникает главным образом при выборе pH раствора, применяемого для ионного обмена или пропитки, с тем чтобы стабилизовать желаемый ион металла в растворе в таком случае необходимо поступиться или стабильностью иона, или химической устойчивостью носителя. Едва ли следует подчеркивать, что добавляемые кислоты или основания (или буфер) должны образовывать летучие соединения, так как это позволяет избежать загрязнения катализатора. Тем не менее, когда кислоты или основания применяют в отсутствие буфера и начальное pH соответствует значениям, при которых носитель не взаимодействует-с ними, полностью устранить возможность агрессивного воздействия на носитель все же трудно, так как концентрация кислоты или основания может возрастать в процессе сушки. Даже если в раствор, применяемый для пропитки или обмена, не добавляют кислот или основ.аний, способность носителя взаимодействовать с ними может оказаться важной. Например, обладающий основными свойствами носитель увеличивает степень гидролиза растворенного вещества, если гидролиз сопровождается образованием кислоты. [c.185]
В других случаях следует обратить внимание на каждый ион, окруженный более или менее постоянной оболочкой из молекул воды, причем катионы гидратируются сильнее, чем анионы. В случае сильно электроположительных металлов притяжение в основном электростатическое и участники каждой гидратной оболочки довольно быстро сменяются. У переходных металлов, образующих прочные комплексы, по-видимому, имеются определенные группы из шести координированных молекул воды вокруг каждого катиона. Строго говоря, свойства раствора, например хлорного хрома, обусловлены наличием не Сг , а СгСНаО) . Поэтому неправильно говорить, что ионы окисного хрома — зеленые и эта окраска изменяется при комплексообразовании. Более точно утверждение, что зелеными являются гидратированные ионы хрома и изменение окраски происходит при замещении молекул воды на ионы хлора, молекулы аммиака и т. п. с образованием таких ионов, как Сг(Н20)4С1з, Сг(Н20)з(ЫНд)Г и т. д. (см. стр. 161). Кислую реакцию раствора хлорного хрома также надо рассматривать как следствие постепенной диссоциации аквокатиона [c.291]
Все три элемента обладают значительным сходством химических свойств. К таковым относятся, в частности, поливалентность, способность образовывать изополи- и гетерополисоединения. Все три элемента обладают как металлическими, так и неметаллическими свойствами. Основные свойства окислов усиливаются от хрома к вольфраму. Хромовая кислота Н2СГО4 более сильная, чем вольфрамовая. Устойчивость соединений низших валентностей растет от вольфрама к хрому. Соединения молибдена (V) более устойчивы, чем вольфрама (V). Соединения хрома (III) —ярко выраженные ионные соединения. Соединения вольфрама (V) и молибдена (V) почти не имеют ионного характера. Об этом, в частности, говорит их высокая летучесть. [c.272]
Высший окисел хрома — окись хрома(У1) — является кислотным окислом, он образует хроматы и бихроматы. Низший окисел СгО имеет основной характер он образует ион хрома(П) Сг + и его соли. В гидроокиси хрома(1П) Сг(ОН)з этот элемент находится в промежуточной степени окисления, и поэтому гидроокись обладает амфотерными свойствами. С кислотами она образует соли хрома 1П), такие, как сульфат хро-ма(1П) Сг2(804)з, а в растворах сильных оснований растворяется с образованием гидроксохромит-иона Сг(0Н)4. [c.647]
Гидроокиси Ре(ОН)г, Ге(ОН)з и Мп(ОН)з обладают слабо основными свойствами, а гидроокиси А1(0Н)з, Сг(ОН)з и Zn(0H)2 — амфотерными свойствами, что используется в качественном анализе для разделения катионов И1 группы на две подгруппы. К первой подгруппе относят катионы Ре +, Fe +.Mn , ко второй — катионы А1 +, Сг= +, Zn +. Если к раствору смеси катионов П1 группы прибавить в избытке раствор щелочи, то катионы первой подгруппы выпадут в осадок в виде гидроксидов Ге(ОН)г, Ре(ОН)з, Мп(ОН)2, а в растворе будут находиться ионы АЮ ", СгО " и ZnO . На практике избыток раствора щелочи добавляют в присутствии окислителя Н2О2 или Вгз. Это необходимо для того, чтобы перевести хромит-ион rOj в хромат-ион СгО -. Последующим действием раствора хлорида бария легко отделить ион СгО от ионов АЮ и ZnO ". В присутствии окислителя ионы железа (II) переходят в ионы железа (III) [c.272]
Основной особенностью шпинелей системы МпРе2 а СГх04 является малая величина магнитного момента при 0°К и аномальная зависимость момента от степени замещения [52]. Обнаружена также высокая восприимчивость парапроцесса в сильных магнитных полях [53]. Для объяснения магнитных свойств этих ферритов предполагалось [52—54], что часть магнитных моментов ионов хрома располагается антипараллельно полному моменту В-подрешетки или под углом к нему. Однако при ис- [c.25]
Как из.ме.чяются кислотные и основные свойства гидратов окис.юв хрома в ряду Сг(ОН)г — Сг(ОН)з — Н2СГО4 Объяснить эти изменения, принимая во внимание величину радиуса центрального иона и его заряд. [c.136]
Помимо редких земель, из других металлов-активаторов, излучение которых протекает со слабым участием энергетического спектра кристалла, необходимо указать ещё церий, хром и марганец. Они наиболее часто применяются в качестве активаторов в технических люминофорах. Хотя церий по существу должен быть отнесён к редким землям, но по харак- 1 теру излучения (и поглощения) занимает особое место. Энергетические уровни его в состоянии возбужде-= ния расположены на периферии иона и подвержены таким образом активному влиянию решётки [27, 89, 99]. Поведение хрома в люминофорах исследовано преимущественно Дейч-бейном [63, 62, 61, 65]. В решётке корунда (А12О3) излучение можно рассматривать как обязанное основным состояниям трёхвалентного иона хрома, расщеплённым под влиянием поля решётки. Положение с марганцем несколько сложнее. Несмотря на сходство данного металла с хромом, которое обнаруживается по ряду оптических свойств и электронной конфигурации обоих металлов, механизм поглощения и излучения марганца не может быть интерпретирован с той же определённостью. [c.294]
Для Сг (III) характерна преимущественная координация азот- н кислородсодержащих аддендов, с которыми он образует прочные ковалентные связи. Однако эти связи отличаются меньшей прочностью, чем в соединениях платиновых металлов. Следствием этого является возможность проявления оптической и геометрической изомерии. Вследствие значительной стереохи-мической определенности этих соединений и высокой степени ковалентности связи центральный ион — адденд возможно, что химические свойства этих соединений окажутся объясненными с позиций закономерности трансвлияния. Однако для окончательного суждения о справедливости этой закономерности в химии хрома требуется систематическое исследование соединений Сг (III), Примеры основных типов комплексов Сг (III) даны в табл, 64. В шестивалентном состоянии хром дает многочисленные изополисоединения, например КгСгзОю. [c.208]
Соединения хрома (III) по многим свойствам напоминают соединения алюминия. Это обусловлено тем, что соединения трехналентных алюминия и хрома имеют в основном ионное строение. Близость величины ионных радиусов А1 + и Сг + является причиной сходства свойств образуемых этими ионами соединений. [c.275]
Гидроксиды некоторых металлов являются амфолита ми, т. е. проявляют как основные, так и кислотные свойства. Поэтому они растворяются в избытке гидроксидов натрия или калия е образованием соответствующих анионов. К этим гидроксидам относятся гидрокеиды цинка, алюминия, олова (И) и (IV), сурь-мы(П1) и (V), хрома и частично меди (II). Уравнения реакций взаимодействия соответствующих ионов с гидроксидом натрия или калия записывают следующим образом, например с нонами алюминия [c.545]
Хромит — под этим названием большей частью описывают хромшпинелиды — шпинели, в которых трехвалентный ион представлен в основном хромом. Но Сг + часто в значительной мере бывает замещен А1 + и Ре +, а двухвалентный металл представлен смесью Мд2+ и Ре +. Поэтому свойства хромшпинелидов колеблются в широких пределах, например плотность от 4 до 5 г/см , а твердость от 5,5 до 7. По внешнему виду они не отличаются от магнетита, но у хромшпинелидов черта бурая и они не разлагаются в кислотах и щелочах. Некоторые разности хромшпинелидов — слабомагнитные (высокое содержание окси- [c.446]
Каждая клетка состоит из огромного числа атомов и молекул. Попробуем разобраться, насколько они универсальны и какие функции выполняют в клетках Оказалось, что из периодической системы элементов всего лишь шесть биоэлементов используются для построения подавляющего числа биологически значимых молекул углерод С, ьшслород О, водород Н, сера 8, азот N и фосфор Р. Еще 16 микроэлементов присутствуют в клетках в различных количествах и соотношениях. К ним относятся железо Ре, медь Си, цинк Zn, марганец Мп, кобальт Со, иод I, молибден Мо, ванадий V, никель N1, хром Сг, фтор Р, селен 8е, кремний 81, олово 8п, бор В, мышьяк Аз и пять ионов натрий Na , калий К , магний Mg , кальций Са " , хлор С1 . Каков бы ни был принцип отбора атомов для процессов жизнедеятельности, он не связан с их распространенностью в природе. Например, из галогенов только хлор и иод выбраны природой, хотя фтор и бром обладают не меньшей доступностью. По-видимому, в основу отбора положен принцип пригодности и целесообразности. Например, шесть основных биоэлементов имеют набор свойств, достаточный для построения почти всех необходимых для клетки молекул. [c.6]
Положение о связи активности с d-электронной конфигурацией усиленно отстаивалось Дауденом [78]. Имеется много экспериментальных подтверждений этой точки зрения для области хемосорбции и катализа на металлах, и Дауден попытался распространить ее на окислы переходных металлов. Успешнее всего это можно было сделать для реакций с участием водорода, потому что для этого газа, в отличие от кислорода, хемосорбция не обязательно осуществляется путем простого переноса электрона. Мы уже упоминали (раздел IV, А), что хемосорбция водорода на окиси цинка и закиси никеля ниже 100° не оказывает влияния на электропроводность, и отсюда можно сделать вывод о том, что осуществляется слабая форма хемосорбции, возможно, путем ковалентной связи через ионы металла. Для построения ряда активности наиболее пригодной для исследования является реакция обмена Нг — Ог. Она была изучена Дауденом, Маккензи и Трепнеллом [79], которые указали, что нельзя согласиться с прежними предварительными выводами об rt-характере проводимости (например, в окиси цинка или в восстановленной окиси хрома) как об основном факторе, объясняющем высокую активность в реакциях с участием водорода [80]. Вместо этого, согласно интерпретации названных авторов, их результаты указывают на пример такого изменения свойств в ряду ионов переходных металлов, которое отличается наличием двух максимумов, причем низкая активность окиси железа характеризует устойчивость а -конфигурации. Имеются сомнения в надежности некоторых из их экспериментальных [c.345]
chem21.info
Качественное обнаружение иона хрома. — КиберПедия
4.1.Реакция образования дифенилкарбазида хрома.
К 1 мл минерализата добавляют 4 мл воды, 1 каплю 10% раствора нитрата серебра, 0,5 г. персульфата аммония и нагревают в течении 20 минут на кипящей водяной бане (жидкость приобретает в желтую окраску). Затем добавляют 1 мл насыщенного раствора Nah3PO4, по каплям 10% раствор КОН до создания рН 1-2 и 1 мл раствора дифенилкарбазида. При наличии хрома появляется окрашивание от светло-розового до красно-фиолетового. Предел обнаружения- 0,002 мкг/мл.
4.2.Реакция образования надхромовых кислот.
К 5 мл минерализата в пробирке добавляют по каплям 30% раствор NaOH до создания рН 7, затем добавляют еще 1 мл минерализата, затем капель 10% раствора нитрата серебра, 0,5 г персульфата аммония и реакционную смесь нагревают в течении 20 минут на кипящей водяной бане (жидкость приобретает в желтую окраску). Затем ее охлаждают до температуры +100 или ниже под струей холодной воды и к охлажденному раствору добавляют 1 мл насыщенного раствора Nah3PO4. При рН 2 прибавляют уксусно-этиловый эфир и 2-3 капли пергидроля. Содержимое пробирки энергично перемешивают. При наличии хрома слой органического растворителя окрашивается в голубой или интенсивно-синий цвет. Предел обнаружения –2 мкг/мл.
Качественное обнаружение иона серебра.
5.1.Реакция образования дитизоната серебра.
В пробирку помещают 5 мл минерализата, к нему добавляют 5 мл хлороформа и по каплям 0,01% раствор дитизона в хлороформе. При наличии ионов серебра появляется золотисто-желтое окрашивание хлороформного слоя. Чувствительность реакции 0,04 мкг.
5.2.Реакция образования хлорида серебра.
К части минерализата добавляют 0,05 г хлорида натрия. При наличии иона серебра образуется белый осадок (муть), растворимый в 25% растворе аммиака (оставляют для последующих опытов).
5.3.Реакция с сульфатом железа (II).
Одну каплю раствора из опыта 5.2 помещают на фильтровальную бумагу, на которую ранее был нанесен в виде пятна раствор сульфата железа(II). При наличии серебра в центре пятна возникает черная окраска (металлическое серебро), а по краям - красно-оранжевое кольцо (Fe3+).
5.4.Реакция перекристаллизации хлорида серебра.
Каплю аммиачного раствора из опыта 5.2 помещают на предметное стекло и дают капле медленно испариться (без нагревания). При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров и четырехугольников (смотреть под микроскопом под большим увеличением).
5.5.Реакция с азотной кислотой.
К 0,1-0,5 мл аммиачного раствора из опыта 5.2 добавляют азотную кислоту до рН=1 (по универсальному индикатору). При наличии иона серебра выпадает белый осадок. Чувствительность реакции 0,1 мкг.
5.6.Реакция с иодидом калия.
К 0,5 мл аммиачного раствора из опыта 5.2 добавляют 0,5 мл насыщенного раствора иодида калия. При наличии иона серебра в пробе выпадает желтый осадок или муть.
5.7.Реакция с тиомочевиной и пикриновой кислотой.
Каплю аммиачного раствора из опыта 5.2 помещают на предметное стекло и выпаривают. На сухой остаток наносят каплю насыщенного раствора тиомочевины и пикриновой кислоты. При наличии иона серебра появляются желтые игольчатые кристаллы и сростки из них в виде розеток. Чувствительность реакции 0,1 мкг.
ЗАНЯТИЕ № 3
| ТЕМА: | Химико - токсикологический анализ соединений меди, сурьмы, висмута, цинка, кадмия, мышьяка, таллия. |
| ЦЕЛЬ: | Сформировать знания по проведению дробного анализа меди, сурьмы, висмута, цинка, кадмия, мышьяка, таллия. |
САМОСТОЯТЕЛЬНАЯ ПОДГОТОВКА СТУДЕНТА К ЗАНЯТИЮ:
Основные термин и понятия:
Понятия: внутрикомплексное соединение, ионный ассоциат. Использование дитизона, солей диэтилдитиокарбамата, бриллиантового зеленого в дробном анализе «металлических ядов».
Инструментальные методы анализа « металлических» ядов.
Логическая структура темы:
| ДРОБНЫЙ АНАЛИЗ «МЕТАЛЛИЧЕСКИЕ ЯДЫ | |
| ХТА соединений меди | |
| Качественный анализ | Количественный анализ |
| Предварительная реакция с (ДДТК)2Pb | Комплексонометрия |
| Выделение из минерализата в виде (ДДТК)2Cu Реэкстракция с HgCI2 | Фотометрия |
| ZnSO4 и (Nh5)2[Hg(SCN)4] | ААС |
| CdCl2 и K4[Fe(CN)6] | |
| Nh5SCN и пиридин | |
| ААС | |
| ХТА соединений сурьмы | |
| Качественный анализ | Количественный анализ |
| Малахитовый и бриллиантовый зеленый | Фотометрия |
| Na2S2O3 | ААС |
| ААС | |
| ХТА соединений таллия | |
| Качественный анализ | Количественный анализ |
| Малахитовый и бриллиантовый зеленый | Фотометрия |
| Дитизон | ААС |
| ААС | |
| ХТА соединений мышьяка | |
| Качественный анализ | Количественный анализ |
| Предварительная реакция Зангер - Блека | Визуальная колориметрия |
| (ДДТК)Ag в пиридине | Аргентометрия |
| метод Марша | Фотометрия |
| ААС | ААС |
| ХТА соединений висмута | |
| Качественный анализ | Количественный анализ |
| Предварительные реакции Тиомочевина, 8-оксихинолин | Комплексонометрия |
| Выделение из минерализата в виде (ДДТК)3Bi | Фотометрия |
| Реэкстракция HNO3 | ААС |
| Бруцин и KBr | |
| CsCl и KI | |
| Тиомочевина | |
| ААС | |
| ХТА соединений цинка | |
| Качественный анализ | Количественный анализ |
| Предварительная реакция с дитизоном | Комплексонометрия |
| Выделение из минерализата в виде (ДДТК)2Zn | Фотометрия |
| Реэкстракция | ААС |
| Na2S | |
| K4[Fe(CN)6] | |
| (Nh5)2[Hg(SCN)4 | |
| ААС |
Литература для самоподготовки:
1. Вергейчик Т.Х. Токсикологическая химия [Текст] / Т.Х.Вергейчик-М.:МЕДпресс-информ,2009-с.96-100,324-346.
2.Швайкова М.Д. Токсикологическая химия: Учебник. - М.: Медицина, 1975. - с. 311 - 349.
3.Крамаренко В.Ф. Токсикологическая химия: Учебник. - Киев: Выща школа -1989. - с. 323 - 379.
4.Белова А.В. Руководство к практическим занятиям по токсикологической химии. - М.: Медицина, 1976. - с. 137 - 187.
5. Токсикологическая химия (под ред.Т.В.Плетенёвой).М. : ГЭОТАР.-
Медия,2005.-с.232-238,359-398.
Вопросы для самоподготовки:
1.Каковы особенности использования дитизона и диэтилдитио-карбаматов в дробном анализе «металлических ядов»?
2.Чем обусловлено применение (ДДТК)2Pb в дробном анализе меди?
3. Как отличить соединения сурьмы от соединений таллия в химико - токсикологическом анализе?
4.Как обнаружить соединения мышьяка при помощи метода Марша?
5.Как отличить налет мышьяка от налета сурьмы в восстановительной трубке Марша?
6. Решите задачи
6.1. Для количественного определения меди экстракционно-фотометрическим методом по реакции образования диэтилдитиокарбамата приготовили стандартный раствор Cu S O4 х 5 h3 0 (мол. Масса 249,68) , для чего в мерную колбу V 1000 мл внесли 0,3928 г вещества , 30 мл воды и 1 мл конц. серной кислоты. После растворения объём раствора в колбе довели до метки дистиллированной водой.
В делительные воронки вносили по 0,05; 0,1; 0,3; 0,5; 0,8; 1,0; 1,2 и 1,4 мл стандартного раствора и проводили экстракцию с ( ДДТК )2 Pb . Хлороформные фазы V 10 мл подвергали фотометрированию на ФЭК –56 М ( кювета 5 мм, светофильтр синий, l 440 нм , раствор сравнения – хлороформ). При этом получены следующие данные :
| Объём стандартного раствора | Концентра-ция в мкг | Оптическая плотность А* |
| 0,05 | ||
| 0,1 | ||
| 0,3 | ||
| 0,5 | ||
| 0,8 | ||
| 1,0 | ||
| 1,2 | ||
| 1,4 |
*- данные у преподавателя.
10 мл минерализата ( общий объём 200 мл ), полученного из 200 мл мочи , доводили до рН 3 , вносили в делительную воронку, прибавляли 5 мл хлороформного раствора (ДДТК)2 Pb , взбалтывали 3 мин , хлороформную фазу отделяли , а водную повторно экстрагировали. Хлороформные вытяжки объединяли и фотометрировали в тех же условиях, что и стандартный раствор. Оптическая плотность равна 0, 452 ( индивидуальное задание).
Построить градуировочный график, рассчитать концентрацию меди в 1 л мочи, сделать вывод о возможности отравления.
6.2. Рассчитать концентрацию мг/100 г висмута в печени , если после минерализации 50 г органа на комплексонометрическое титрование 100 мл минерализата с индикатором пирокатехиновым фиолетовым пошло 9,10 мл 0,1012 н раствора трилона Б .
6.3. При минерализации 100 г печени получен минерализат объемом 200 мл. Качественный анализ минерализата дробным методом показал наличие катионов цинка. Рассчитать количественное содержание цинка в биологическом объекте (на 100 г), если на титрование 10 мл минерализата (после предварительной экстракции и реэкстракции) затрачено 0,45 мл 0,01 Н раствора трилона Б (индикатор – хромоген черный). Т Zn2+ / Тр Б = 0,003300 г/мл.
Тестовые задания по теме:
ТЗ 1. В дробном анализе «металлических ядов» имеют значение только ........ замещенные дитизонаты.
ТЗ 2. Диэтилдитиокарбаминовая кислота при рН=4 и ниже разлагается с образованием соединений.
1. Дитиокарбамата натрия и этилового спирта. 2. Диэтиламина и сероуглерода. 3. Триэтиламина и сероводорода.
4. Диэтиламина и оксида углерода. 5. Диэтилкарбаминовой кислоты и сероводорода.
ТЗ 3. Реактив, используемый для выделения меди из минерализата в виде (ДДТК)2Cu.
1. (ДДТК)Na. 2. (ДДТК)Nh5. 3. (ДДТК)Ag. 4. (ДДТК)H.
5. (ДДТК)2Pb.
ТЗ 4. Реактив ,используемый для обнаружения меди
1. Дитизон. 2. Малахитовый зеленый. 3. Аммония роданид и пиридин. 4. Серная кислота. 5. Натрия тиосульфат.
ТЗ 5. Тип соединения , получаемого при взаимодействии SbCl6 - с бриллиантовым зеленым
1. Ионный ассоциат. 2. Внутримолекулярный комплекс.
3. Межмолекулярный комплекс. 4. Простая соль . 5. Ацианион.
ТЗ 6. Реактив, позволяющий отличить таллий от сурьмы
1. Бриллиантовый зеленый. 2. Дитизон. 3. Натрия сульфат.
4. Натрия персульфат. 5. Диэтилдитиокарбамат натрия.
ТЗ 7. Предварительная реакция обнаружения цинка.
1.С дитизоном 2 С ДДТК Na 3.С калия гексацианоферратом 4. С натрия сульфитом 5. С натрия сульфидом.
ТЗ 8. Установите последовательность действий при определении мышьяка по методу Марша.
1. Исследование налета. 2. Проверка наличие налета .
3. Взаимодействие с аммиачным раствором нитрата серебра. 4. Отложение буро - серого налета на фарфоровой поверхности. 5. Зажигание водорода выходящего из восстановительной трубки.
ТЗ 9. Реактив, позволяющий отличить мышьяк от сурьмы
1. Сероводород 2. Серная кислота 3. Аммиачный раствор нитрата серебра 4. Калия бромид 5. Дитизон.
ТЗ 10. Предварительная реакция обнаружения висмута
1.С бромидом калия и бруцином 2. С тиомочевиной 3. С диэтилдитиокарбаматом натрия 4.С цезия хлоридом и калия иодидом 5. С натрия сульфитом .
ТЗ 11-12. Установите соответствие
Объект исследования Реактив для количественного ФЭК определения
| 1. Медь 2. Сурьма | А. Диэтилдитиокарбамат свинца Б. Оксин В. Дитизон Г. Диэтилдитиокарбамат натрия Д. Бриллиантовый зеленый |
ТЗ 13-14. Установите соответствие
Объект исследования Реактив обнаружения.
| 1. Сурьма 2. Висмут | А. Кислота хлороводородная Б. Кислота пикриновая В. Калия гексацианоферрат (II) Г. Тиомочевина Д. Тиосульфат натрия |
ТЗ 15. Метод количественного определения ионов кадмия
1.Фотометрия.2.Комплексонометрия.3.Гравиметрия.4.Поляриметрия 5.Кондуктометрия.
СОДЕРЖАНИЕ АУДИТОРНОГО ЗАНЯТИЯ:
1.Семинар по теме занятия.
2.Практикум по теме занятия.
3.Оформление протокола практического занятия.
4.Тестовый контроль усвоения темы.
Практикум
cyberpedia.su










