Хроматы и дихроматы. Хромат хрома
Хроматы и дихроматы, свойства, формула, получение и реакции
Формула хромата
Хроматы — соли хромовой кислоты h3CrO4.
Реакции хроматов
Получение хроматов
Получают их взаимодействием CrO3 с основными оксидами (сплавление):
CrO3 + ZnO → ZnCrO4,
или, что более распространённо, окислением соединений Cr3+ в щелочных растворах:
2KCrO2 + 3h3O2 + 2KOH → 2K2CrO4 + 4h3O,
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8h3O.
При этом происходит изменение зелёной окраски раствора в жёлтую от иона CrO42-.
Свойства хроматов
Хромат-ион при подкислении переходит в дихромат-ион (при этом окраска раствора становится оранжевой), в растворах существует равновесие между хомат- и дихромат-ионами:
2CrO42- + 2H+ ↔ 2HCrO4- ↔ Cr2O72- + h3O.
Хроматы устойчивы в нейтральной и щелочной среде, а дихроматы — в кислой.
Применение хроматов
Хроматы применяют в качестве сильных окислителей, как красящие вещества. Хроматы калия и натрия применяют в качестве консервантов древесины, как протраву при хранении тканей. Нерастворимые хроматы некоторых металлов обладают яркими, насыщенными цветами, поэтому на их основе делают краски: жёлтые кроны (PbCrO4, ZnCrO4, SrCrO4), красный свинцово-молибденовый крон (PbCrO4 и MoCrO4), создающий гамму оттенков от розового до фиолетового SnCrO4.
Физиологические свойства
Все соединения шестивалентного хрома, в том числе хроматы и дихроматы, весьма токсичны и канцерогенны.
Таблица. Названия кислот и их солей.
| HAlO2 | Метаалюминиевая | Метаалюминат |
| HBO2 | Метаборная | Метаборат |
| h4BO3 | Ортоборная | Ортоборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| HCN | Циановодородная | Цианид |
| h3CO3 | Угольная | Карбонат |
| h3C2O4 | Щавелевая | Оксолат |
| h5C2O2 (Ch4COOH) |
Уксусная | Ацетат |
| HCl | Хлороводородная | Хлорид |
| HClO | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| HCrO4 | Хромовая | Хромат |
| HCr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HMnO4 | Марганцевая | Перманганат |
| h3MnO4 | Марганцовистая | Манганат |
| h3MoO4 | Молибденовая | Молибдат |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Нитрат | |
| HPO3 | Метафосфорная | Метафосфат |
| HPO4 | Ортофосфорная | Ортофосфат |
| h5P2O7 | Двуфосфорная (Пирофосфорная) | Дифосфат (Пирофосфат) |
| h4PO3 | Фосфористая | Фосфит |
| h4PO2 | Фосфорноватистая | Гипофосфит |
| h3S | Сероводородная | Сульфид |
| h3SO3 | Сернистая | Сульфит |
| h3SO4 | Серная | Сульфат |
| h3S2O3 | Тиосерная | Тиосульфат |
| h3Se | Селеноводородная | Селенид |
| h3SiO3 | Кремниевая | Силикат |
| HVO3 | Ванадиевая | Ванадат |
| h3WO4 | Вольфрамовая | Вольфрамат |
65. Хроматы и дихроматы
Хроматы – соли хромовой кислоты Н2Сг04, существующей лишь водных растворах с концентрацией не выше 75 %. Валентность хрома в хроматах – 6. Хроматы щелочных металлов и магния имеют хорошую растворимость в воде, а растворимость щелочноземельных металлов очень резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4. Хроматы – желтые кристаллические вещества – желтую окраску обеспечивает хромат-ион Сг042-. Дихроматы – соли дихромовой кислоты Н2Сг07. В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы имеют ярко-оранжевую окраску, обеспеченную дихромат-ионом: Сг072-. Хромат и дихромат-ионы способны к взаимопревращению в зависимости от кислотности среды: если раствор подкислить, то хромат-ионы будут переходить в дихромат-ионы по схеме:
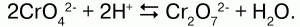
Если добавить щелочи, то пойдет обратная реакция:
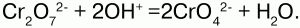
Хроматы получают взаимодействием оксида хрома (VI) или раствора хромовой кислоты h3CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов, или путем окисления комплексных солей – гидроксохроматов в избыточном растворе щелочи:
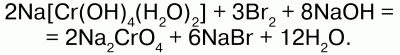
Хромат калия K2CrO4 – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Дихроматы – сильные окислители:
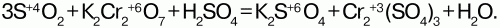
Получают дихроматы из соединений Cr (III) в кислой среде:
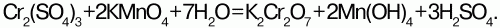
Дихромат аммония (Nh5)2Cr2O7 – оранжевые кристаллы, не образует кристаллогидратов. При слабом нагревании он самовоспламеняется с выбросом искр – раскаленных частиц Cr2O3, N2 и паров воды – «химический вулкан».
Дихромат калия K2Cr2O7?2h3O и Na2Cr2O7 – хромпики, оранжево-красные кристаллы, кристаллогидратов не образует. Используется в пиротехнике, в хроматометрии, в производстве спичек. Смесь равных объемов раствора K2Cr2O7 и концентрированной серной кислоты – хромовая смесь – является очень сильным окислителем, в лабораториях применяется для мытья стеклянной посуды. Хроматы применяются для протравы семян, при крашении, в лакокрасочной, кожевенной (в качестве дубящих реагентов кожи), текстильной промышленности; используются в лабораторном способе разделения хрома-тов кальция, стронция и бария.
Наиболее распространенным в природе, минералом является минерал PbCrO4 – крокоит. Хромат – тарапакаит и дихромат калия – лопецит – также являются природными минералами.
66. Общая характеристика семейства железа
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта [Co(CO)5]);
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4, который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
studfiles.net
ХРОМАТЫ И ДИХРОМАТЫ | Энциклопедия Кругосвет
ХРОМАТЫ И ДИХРОМАТЫ. Хроматы – соли не существующей в свободном состоянии хромовой кислоты h3CrO4, получаемой лишь в виде водных растворов с концентрацией не выше 75%. Их получают при взаимодействии оксида хрома(VI) или раствора хромовой кислоты h3CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов. Хорошо растворяются в воде хроматы щелочных металлов и магния, а для щелочноземельных металлов растворимость настолько резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4, что на этом удалось построить лабораторный способ разделения кальция, стронция и бария: хромат кальция не выпадает в осадок из миллимолярных (0,001 моль/л) растворов, а осадок хромата стронция, в отличие от хромата бария, растворяется под действием уксусной кислоты.
Кристаллические хроматы и их растворы в воде имеют желтый цвет. При их подкислении, например, добавлением небольшого количества разбавленной серной кислоты ионы CrO42- превращаются в дихроматные ионы Cr2O72-, отщепляя воду, и приобретают оранжевый цвет:
2CrO42- + 2 h4O+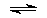 Cr2O72- + 3h3O
Cr2O72- + 3h3O
В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы – сильные окислители. В кислой среде для них характерна полуреакция:
Cr2O72- + 14H+ + 6 е- = 2Cr3+ + 7h3O,
где каждый атом хрома(+VI) в анионе принимает по три электрона и превращается в катион Cr3+, тотчас же присоединяющий к себе молекулы воды, переходя в гексааквакатион. Раствор при этом становится зеленым.
Особые свойства у дихромата аммония: он легко разлагается. При слабом нагревании дихромат аммония (Nh5)2Cr2O7 самовоспламеняется с выбрасыванием искр (этот опыт называют химическим вулканом) – раскаленных частичек оксида хрома(III) Cr2O3, газообразного азота N2 и паров воды. Хромат калия K2CrO4 плавится без разложения при 968° С, а дихромат калия K2Cr2O7 разлагается в соответствии с уравнением реакции:
4K2Cr2O7 = 4K2CrO4 + 2 Cr2O3 + 3O2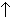
Наиболее широко применяются хромат и дихромат калия и дихромат аммония.
Хромат калия K2CrO4 – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Плотность 2,732 г/см3, температура плавления 968,3° С, растворимость при 20° С составляет 63,0 г/100 г воды.
Дихромат калия K2Cr2O7 – оранжево-красные кристаллы, кристаллогидратов не образует, плотность 2,684 г/см3, плавится при 397° С (дальнейшее нагревание расплава ведет к разложению), растворимость при 20° С равна 12,48 г соли на 100 г воды. Техническое название дихромата калия K2Cr2O7 - хромпик. Широко используется как окислитель в спичечной промышленности, пиротехнике и как реагент в хроматометрии.
Хроматометрия (точнее – дихроматометрия) – объемный (титриметрический) метод химического анализа (см. ТИТРОВАНИЕ), основанный на применении раствора K2Cr2O7 определенной концентрации и позволяющий определить содержание восстановителей и некоторых катионов металлов.
Смесь равных объемов насыщенного на холоде раствора K2Cr2O7 и концентрированной серной кислоты (хромовая смесь) обладает очень сильным окислительным действием и применяется в лабораториях для мытья химической посуды.
Дихромат аммония также не образует кристаллогидратов, но разлагается при нагревании. Это оранжевые кристаллы с плотностью 2,15 г/см3 и растворимостью 35,6 г/100 г воды (при 20° С). Удобный исходный реагент для получения высокочистого оксида хрома(III) (стойкий зеленый пигмент и составная часть некоторых катализаторов и известной смеси для полировки оптики – пасты ГОИ). Кроме того, дихромат аммония применяется как компонент светочувствительного слоя фотоматериалов и ряда пиротехнических составов, консервант древесины, окислитель в органическом синтезе и отбеливатель для жиров, воска и парафина.
Хроматы применяются также в качестве протравы при крашении, дубящих реагентов в кожевенном производстве, для протравы семян (K2CrO4), ингибиторов коррозии (CaCrO4, BaCrO4, ZnCrO4), пигментов (баритовый желтый BaCrO4, желтый крон PbCrO4, красный крон Pb2CrO5) а также выступают в роли компонентов материалов для термохромных датчиков.
Хроматы встречаются в природе, в первую очередь это, например, минерал крокоит PbCrO4. Именно этот минерал, привезенный во Францию с Урала («сибирский красный свинец»), послужил в 1797 сырьем для получения оксида хрома, из которого Никола Воклен впервые выделил новый элемент – хром. Другие хроматные минералы – лопецит (дихромат калия, калиевый хромпик), и тарапакаит (хромат калия) распространены значительно меньше.
Любовь Аликберова
www.krugosvet.ru
Хром, определение в виде хромата
Работа 1. Определение хрома в виде хромата (бихромата) методом сравнения [c.67]Определение хрома в виде хромата (дихромата) методом сравнения [c.432]
Определение в виде хромат-иона [258]. Метод основан на окислении хрома (III) до хромат-иона желтого цвета. В качестве окислителей используют перекись водорода в щелочной среде или [c.141]
При определении серы в горных породах в присутствии хрома пробу разлагают обычно сплавлением с содой и селитрой или спеканием со смесью соды и окиси цинка, как указано выше. Однако при выщелачивании сплава или спека в водную вытяжку переходит также и хром в виде хромата щелочного металла. Хромат восстанавливают до Сг(1И) и связывают его в ацетатный комплекс [c.193]Другая методика предполагает определение хрома в виде хромат-ионов. Хромат-ионы дают хорошо выраженные катодные ф —/-кривые при восстановлении на ртутном электроде в щелочном растворе [223]. В кислых растворах электродный процесс осложняется предшествующей химической реакцией [224]. [c.137]
Полученный плав обрабатывают водой при кипячении, фильтруют и промывают нерастворимый в воде остаток 1 %-ным раствором карбоната натрия. В остатке можно определить железо, титан и цирконий ранее описанными методами . В фильтрате можно определить колориметрически хром, если он присутствует в количестве достаточном, чтобы придать раствору заметную окраску (см. ниже, стр. 978). После этого, или тотчас же, если не проводили колориметрического определения хрома, прибавляют достаточное количество нитрата аммония, чтобы весь карбонат йог вступить с ним в реакцию, и нагревают на водяной бане, пока не будет удалена ббльшая часть карбоната аммония. При этом осаждается весь или почти весь алюминий вместе с фосфором и частью присутствующего ванадия. Осадок промывают разбавленным раствором нитрата аммония, пока желтый цвет хромата не исчезнет совершенно из промывных вод, после чего растворяют осадок в азотной кислоте и осаждают фосфор раствором молибдата аммония. Фильтрат от алюминия и фосфора, содержащий хром в виде хромата и большее или меньшее количество ванадия, может быть обработан, как описано ниже. j [c.977]
Ход определения. Анализируемый раствор, в 100 мл которого содержится около 0,1 г хрома в виде хромата, нейтрализуют до начала выделения осадка, растворяют этот осадок в уксусной кислоте и нагревают до кипения. Затем по каплям прибавляют 10. мл раствора хлорида бария, дают постоять 2 ч на водяной бане и фильтруют. Осадок промывают 10%-ным спиртом и прокаливают. Если в прокаленном осадке заметны зеленые частицы, прокаливание продолл ают для их окисления. [c.1136]
Лабораторная работа 29. Определение хрома в виде хромата (дихромата) методом сравнения [c.445]
Полное отделение хрома от других элементов требуется в редких случаях. Обычно отделение хрома от целого ряда элементов достигается при выщелачивании сплава водой при этом хром в виде хромат-иона переходит в раствор. Однако следует иметь в виду, что в растворе будут находиться также ванадий, молибден, уран и мышьяк. Большинство элементов переменной валентности мешают объемному определению хрома. [c.150]
Определение хрома 1) в виде хромата, 2) при помощи дифенилкарбазида, [c.430]
ОПРЕДЕЛЕНИЕ ХРОМА В ВИДЕ ХРОМАТА 357 [c.357]
Целый ряд неорганических реактивов и соединений использован для чувствительных и надежных методов определения следов металлов, например марганца — в виде перманганата, хрома — в виде хромата, титана — с перекисью водорода, ванадия — с перекисью водорода или с фосфорновольфрамовой кислотой, мышьяка и других металлов — по образованию молибденовой сини, висмута и платины — с иодидом, золота и теллура —в виде коллоидных металлов и т, п, [c.83]
Уиллард и Гибсон предложили методику определения хрома и ванадия в хромитовых рудах и сталях. Они сообщили, что хром и ванадий могут быть полностью окислены кипящей 70%-ной хлорной кислотой до хромовой и ванадиевой кислот. Хром отделяли от ванадия, марганца и железа осаждением в виде хромата свинца из 1 М раствора хлорной кислоты. [c.122]
Нами в качестве примера, иллюстрирующего принципиальную возможность концентрирования элементов переменной валентности в виде неорганического соединения на электроде, приводится подробное описание полярографического определения хрома с предварительным концентрированием его в виде хромата бария. [c.191]
Для определения посредством нитрозо-К-соли требуется отделение кобальта от железа и меди, а иногда и от других металлов, например хрома, которые нежелательны в относительно больших количествах. Железо можно отделить достаточно полно, экстрагируя хлорид железа (III) эфиром из солянокислого раствора 1. Медь можно осадить сероводородом в кислой среде. Окислением перекисью натрия в горячем растворе пользуются для осаждения кобальта и переведения хрома в раствор в виде хромата. [c.271]
ОПРЕДЕЛЕНИЕ ХРОМА В ВИДЕ ЩЕЛОЧНОГО ХРОМАТА [c.191]
Хром присутствует в сточных водах цехов металлообрабатывающих предприятий, в водах некоторых химических производств, кожевенных заводов и в загрязненных этими стоками поверхностных водах. В растворе хром может встречаться в виде трехзарядного катиона или в виде анионов — хромат- или бихромат-ионов. Хром (III) устойчив, и в обычных условиях нельзя предполагать окисления его до шестивалентного. В растворенном состоянии хром (III) находится только в кислой среде. В нейтральной и щелочной средах он гидролизуется с выделением гидроокиси хрома (III). Комплексообразующие вещества препятствуют гидролизу. Хром (VI) может встречаться в щелочных растворах в виде хромат-ионов, в кислых растворах — в виде бихромат-ионов, если же восстановители присутствуют, то происходит восстановление шестивалентного хрома до трехвалентного В твердой фазе находится преимущественно гидроокись хрома (III) В питьевых и поверхностных водах с низким содержанием хрома обычно определяют его общее содержание. В сточных водах в зависи мости от цели анализа определяют хром в растворе и в твердой фазе в растворе определяют и шестивалентный, и трехвалентный хром Для определения хрома приводится колориметрический метод с дифенилкарбазидом, применимый при содержании хрома от 0,05 до 1 мг л. При анализе проб, содержащих хром в больших концентрациях, пробу надо предварительно разбавить. Ниже описаны методы определения хрома (VI) и общего содержания хрома. Содержание хрома (III) находят по разности. [c.302]Определение r(VI). Для гравиметрического определения Gr(VI) используют хроматы бария (ПР = 1,6-10 при 18° С), свинца (ПР = 1,8-10 при 20° С), серебра (ПР = 2-10" при 25° С), ртути(1) (ПР=2-10" при 25° С). Определению хрома в виде хромата ртути(1) мешают многие ионы [132]. Осаждение Ag2 r04 возможно в присутствии двукратных количеств магния и равных количеств Мп(П), Fe(IH), Си(П), Ti(IV), Zr, Ni, Со и больших количеств SO4 . Ионы AsO , W0 , VO3, С1 мешают определению [1100]. [c.31]
Осаждение хрома в виде хромата серебра Ag2 r04, хромата ртути Hg2 r04 и хромата бария ВаСг04 представляет интерес главным образом для группового разделения и качественного испытания на хром, а не для количественного его определения, так как многие другие элементы также образуют нерастворимые соединения с этими реагентами. [c.597]
При анализе многих силикатов и руд для определения ванадия образец сплавляют со щелочами и выщелачивают водой. При этом наряду с ванадием в раствор переходит также хром в виде хромата желтая окраска последнего мешает определению ванадия. Влияние небольши количеств хрома легко устраняется при- [c.234]
Эти соединения реагируют в слабокислой среде с тяжелыми металлами — ртутью(1 и II), медью, кадмием, образуя внутрикомплексные соли, окрашенные в синий, фиолетовый или красный цвет . Продукты реакции могут экстрагироваться бензолом, хлороформом и другими растворителями. По-видимому, дифенил кар базид сначала окисляется воздухом до дифенил-карбазона, который затем активно взаимодействует с упомянутыми металлами однако точный ход реакции не выяснен. Эти реактивы малопригодны для определения каких-либо тяжелых металлов (за исключением хрома в виде хромата), хотя карбазон иногда используется для определения ртути для этой цели он оказался менее пригодным, чем дитизон. Для качественных определений были получены и применяются производные дифенил-карбазида, карбазона, а также динафтилкарбазид и его производные [c.157]
Поэтому целесообразно перед определением отделить хром в виде хромата экстракцией метилизобутилкетоном (МИБК). В этом случае образование окрашенного хелата и фотометрическое определение можно провести не1юсредственно в органической фазе [506]. [c.417]
Сущность работы. Хроматный электролит представляет собой щелочной раствор СгОз, в котором хром находится в виде хромата. Определение последнего основано на тифовании раствора солью Мора с амперомефической индикацией точки эквивалентности. [c.277]
Исследования, проведенные в ряде стран, показали, что металлы, широко применяемые в промышленности и распространенные в окружающей среде, могут оказывать на организм человека не только токсикологическое, но и канцерогенное воздействие [935, 987]. К химическим канцерогенам относят такие металлы, как бериллий, хром, никель потенциальными канцерогенами являются кобальт, кадмий, свинец и некоторые другие металлы [931]. Понятие канцерогенность металла относится не к элементу как таковому, а к его определенному физико-химическому состоянию. Например, канцерогенность хрома может быть объяснена следующим образом. Этот элемент в виде хромат-аниона с помощью сульфатной транспортной системы проникает через клеточную мембрану, тогда как катион хром(П1) сквозь нее не проходит. Клеточная метаболическая система восстанавливает хромат до хрома(П1), который в отличие от оксоаниона хрома(VI) образует прочные комплексы внутри клетки с нуклеиновыми кислотами, протеинами и нуклеозидами, вызывая повреждения ДНК, которые в свою очередь ведут к мутации, а следовательно, и к развитию рака [931]. Согласно концепции Мартелла канцерогенность металла связана со степенью его электроположительности. Ионы электроположительных металлов образуют лабильные комплексы и большей частью не канцерогенны. Ионы же металлов с низкой электроположительностью образуют высококовалентные связи с донорными группами биолигандов и способны подвергаться только очень медленным обменным реакциям с другими лигандами, находящимися в биологических системах, что в конечном счете обусловливает канцерогенное действие этих катионов [931]. [c.500]
Фосфор в силоксановой резине определяют в сернокислом растворе колориметрически в виде фосфорномолибденовой сини при Х = 680 нм [234, 235] после отделения двуокиси кремния. Бор определяют также в сернокислом растворе путем титрования ш елочью с маннитом [247]. Хром определяют сразу после выщелачивания содового плава в воде колориметрическим методом в виде хромата натрия. Определение олова основано на обратном комплексонометрическом титровании хлоридом цинка в среде с pH = 5 [223, 230]. Этот метод применим, если отсутствуют элементы, которые тоже титруются в этой среде. В противном случае необходимо олово отделить (см. разд. П. 10.3). [c.113]
Например, хром определяют гравиметрически в виде оксида СггОз (молярная масса 152) и в виде хромата ВаСг04 (молярная масса 253,3 г/моль). Потеря 1 мг осадка СгзОз дает при пересчете на хром ошибку в 0,7 мг, а потеря 1 мг осадка ВаСг04 вызывает при вычислении количества хрома ошибку только в 0,2 мг. Следовательно, одинаковая по абсолютной величине погрешность определения дает меньшую ошибку в случае гравиметрической формы с большей моляр ЮР1 массой. [c.193]
Хром. В качестве теркостабилизирующей и ингибирующей добавки для сохранения подвижности буровых растворов при высоких забойных температурах используют хроматы и бихроматы щелочных металлов. Хотя добавки их не превышают десятых долей процента, оцейивать содержание токсичного хрома в отходах бурения в некоторых случаях будет необходимо. Хром (VI) в щелочных растворах чаще всего находится в виде хромат-ионов. В присутствии восстановителей шестивалентный хром может перейти в трехвалентный. Поэтому обычно определяют общее содержание хрома в растворе или твердой фазе в зависимости от цели анализа. В справочной литературе для анализа хрома в воде рекомендуются титриметрический метрд определения хрома (VI) с сульфатом железа (II) и колориметрический метод определения с дифенилкарбазидом. Этими же методами определяют и общее содержание хрома в пробе. Содержание хрома (III) устанавливают по разности результатов определения общего и шестивалентнбго хрома. [c.160]
Отделение марганца от хрома и кобальта. Хром и кобальт иногда мешают определению марганца. Отделить эти элементы от марганца можно, осаждая последний персульфатом аммония в аммиачной среде. Хром при этом остается в растворе в виде хромата, а кобальт в виде комплексного кобальтиаммина. Марганец осаждается полностью, но осадок захватывает немного хрома и кобальта. Лучшее отделение от хрома получается, если хром предварительно окислить в кислой среде, например хлорной кислотой. [c.872]
Эти реактивы не очень пригодны для определения какого-либо тяжелого металла (за исключением хрома, находящегося в виде хромата), хотя еще недавно дифенилкарбазои применяли для определения ртути он оказался для этой цели значительно менее пригодным, чем дитизон. Для качественных реакций были предложены производные дифенилкарбазвда и дифенилкарбазона, а также динафтилкарбазид и его производные 2 . [c.116]
Непрямой колориметрический метод определения свинца основан на осаждении последнего в виде хромата РЬСгО или в виде двойного хромата КаРЬ(СЮ4)2 и на определении хрома днфе. нилкарбазидом в промытом осадке после растворения последнего в кислоте . [c.116]
chem21.info
Хромат-ион восстановление в хром III
Действие окислителей и восстановителей. Катионы бария, стронция, кальция, магния, алюминия устойчивы по отношению к окислителям и восстановителям. Ионы марганца, хрома (III), железа (И) и (III) и висмута (III) вступают в реакции окисления и восстановления как в кислой, так и щелочной средах. В щелочной среде хлор, бром, перекись водорода, гипохлорит, двуокись свинца, перманганат окисляют ионы хрома (III) в хромат, а в кислой среде — в бихромат. [c.39] При избытке в растворе ионов водорода (кислая среда) хромат-ионы переходят в дихромат-ионы, а при избытке гидроксильных ионов (щелочная среда) наблюдается обратное явление. Кислородсодержащие соединения хрома обладают окислительными свойствами, как правило, в кислой среде. Процесс восстановления хрома происходит по таким схемам [c.22]Для получения вещества с максимальной каталитиче- ской активностью необходимо проводить реакцию при = нагревании до возможно более полного восстановления хромового ангидрида. Если вместо кипячения реакцион- ную смесь нагревать при циркуляции на паровой бане в течение 16 час. без перемешивания, вся она оседает в виде черного геля, который можно раздробить, профильтровать и высушить обычным путем. Полученный катализатор обнаруживает при ароматизации нормаль- ного гептана активность, выражаемую цифрой 140. При термохимическом анализе этот гель обнаруживает ела- бую, но, несомненно, экзотермическую реакцию при 215—220°. Хромат трехвалентного хрома, приготовлен-ный обработкой раствора нитрата хрома аммиачным раствором хромата аммония или добавлением избытка аммиака к раствору, содержащему нитрат хрома (3) и хромовый ангидрид, обнаруживает сильно экзотермическую реакцию при нагревании до 215—220°. При приготовлении геля окиси хрома по описанному методу, можно считать, что ионы Сг+++, образовавшиеся в процессе восстановления, соединяются с неизмененной хромовой кислотой, образуя хромат трехвалентного хрома. Для восстановления этого соединения требуются более жесткие условия (при термохимическом ана- лизе приготовленный по описанному методу гель не обнаруживает экзотермической реакции при 215— 220°). [c.186]
Гравиметрически хром в виде хромистой соли может быть осажден аммиаком в растворе, свободном от железа и алюминия. Гидроокись хрома прокаливают до постоянной массы и взвешивают в виде окиси хрома (молекулярный вес 152). Соляная и серная кислоты на осаждение влияния не оказывают (1 мг окиси хрома эквивалентен 0,6843 мг хрома). Объемным способом хром обычно определяют восстановлением хромата в кислом растворе, добавляя иодид калия и титруя освободившийся иод стандартным раствором тиосульфата натрия. Присутствие больших количеств магния, кальция, бария, стронция, цинка, кадмия, алюминия, никеля и кобальта не оказывают влияния даже в присутствии соляной и серной кислот. В процессе титрования, когда зеленая окраска восстановленного хрома (III) начнет преобладать над коричневато-красной окраской свободного иода, добавляют небольшое количество раствора крахмала и продолжают титровать тиосульфатом до исчезновения синей окраски крахмала (1 мл 0,1 н. раствора тиосульфата натрия эквивалентен 0,001734 г хрома). [c.124]
При восстановлении хрома из оксида хрома Сг Оз алюминотермическим путем к оксиду хрома для более энергичного протекания реакции добавляется некоторое количество более богатого кислородом соединения хрома — хромат калия КаСгО. Напишите уравнение реакции восстановления алюминием этого соединения, представив его и продукты реакции в виде отдельных оксидов, и укажите, что получится при этой реакции в качестве шлака (вместо оксида алюминия). Составьте суммарное уравнение реакции. Калий в данных условиях алюминием не восстанавливается. [c.130]
Однако и в кислой, и в щелочной среде окисление хрома (III) приводит к уменьшению pH раствора обратный же процесс — восстановление хрома (VI) — сопровождается увеличением pH. Поэтому, в соответствии с принципом Ле Шателье, при повышении кислотности среды равновесие смещается в направлении восстановления хрома(VI), а при уменьшении кислотности — в направлении окисления хрома(III). Иначе говоря, окислительные свойства соединений хрома(VI) наиболее сильно выражены в кислой среде, а восстановительные свойства соединений хрома(III)—в щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах. [c.649]
Таким образом, при низких значениях pH растворов происходит интенсивное восстановление хрома, который задерживается на колонке. Только при значениях pH, близких к 11, хромат-ион практически нацело переходит в фильтрат, но проводит разделение шестивалентного и трехвалентного хрома при таких значениях pH не представляется возможным. [c.60]
Наиболее распространенным загрязнителем этого типа, особенно в условиях нефтеочистительных заводов, является сероводород. Его основное действие сводится к восстановлению хрома-тов, которые применяются для ингибирования коррозии. Это может оказаться настолько серьезным, что сделает невозможным применение хроматов и вынудит прибегнуть к применению менее эффективных ингибиторов. Другим обычным газообразным продуктом, загрязняющим охладительные башни, является ЗОг, попадание которого в систему сопровождается снижением величины pH и стимулированием коррозии. Вредное влияние оказывают также примеси аммиака, которые вызывают повышение pH при одновременном стимулировании коррозии деталей оборудования, изготовленных из меди и адмиралтейской латуни. В систему могут попадать и другие загрязнения, входящие в состав охлаждаемой жидкости. Таким образом, можно заметить, что примеси газов к рециркуляционной воде не могут 1е действовать как возможные причины помех. [c.86]
Авторы полагают, что рассматриваемое взаимодействие этилена с катализатором является не чем иным, как восстановлением хрома в катализаторе до промежуточного валентного состояния. Тот факт, что катализатор, активированный в токе воздуха, работает без индукционного периода, объясняется его легкой восстанавливаемостью. Катализатор, активированный в вакууме, содержит хроматы хрома, более устойчивые к восстановлению [22]. Лишь значительное снижение температуры, когда скорость восстановления сильно уменьшается, приводит к появлению индукционного периода на катализаторе, активированном воздухом. [c.162]
Испытуемый раствор может быть аммиачным. Однако в этих условиях хромат-ион полностью не извлекается. Чтобы повысить степень извлечения хрома, необходимо раствор пропустить че рез анионит три раза, причем при втором и третьем фильтровании надо добавить каплю пергидроля для окисления восстановленного хрома. Только таким путем можно добиться полного отделения хрома от никеля. [c.215]
Эффект действия хромат-ных пигментов возрастает с увеличением их растворимости в воде, т. е. с ростом степени ионизации. Растворимость хроматов металлов 2п, 5г, Ва, РЬ соответственно равна 1,1 0,6 0,001 и 0,00005 г/л. Таким образом, наиболее ценными в противокоррозионном отношении и вследствие этого самыми распространенными являются хроматы цинка — цинковые крона. При воздействии воды они образуют растворы с pH 7,0—7,6 и концентрацией хромат-ионов З-Ю моль/л и более. Этой концентрации оказывается достаточно для того, чтобы сместить потенциал железа в нейтральной среде до +0,3- + 0,5 В, при котором наступает его пассивное состояние (рис. 5.13). Механизм действия хроматных пигментов связан с адсорбцией хромат-ионов на поверхности металла, восстановлением хрома из шестивалентного до трехвалентного состояния и образованием нерастворимых сложных комплексных соединений Ре + и Сг +. При этом адсорбируются комплексные ионы, образующиеся при действии воды на хроматные пигменты [c.171]
Эффект действия хроматных пигментов возрастает с увеличением их растворимости в воде, т. е. с ростом степени ионизации. Растворимость хроматов металлов 2п, 5г, Ва, РЬ соответственно равна 1,1 0,6 0,001 и 0,00005 г/л [6, с. 662]. Таким образом, наиболее ценными в противокоррозионном отношении и вслеД ствие этого самыми распространенными являются хромать цинка — цинковые крона. Их применяют в грунтовочных составах как по черным, так и особенно по цветным металлам (алюминию, сплавам алюминия и магния). Механизм действия хроматных пигментов связан с адсорбцией иона СгО на поверхности металла, восстановлением хрома из- иле- [c.165]
Получение хромовых сплавов из растворов хромовой кислоты имеет свои особенности, обусловленные спецификой катодного процесса при электроосаждении хрома [1 ]. Как известно, при восстановлении хромовой кислоты в присутствии других катионов (Си++, 2п++, N1++, Ре++, Со++) потенциал восстановления которых более положителен, чем потенциал восстановления хрома, выделяется только хром, а перечисленные катионы не восстанавливаются [2]. Причина этого аномального явления связана с тем, что на поверхности катода в процессе электролиза образуется пленка, которая препятствует проникновению к электроду, а следовательно, и восстановлению перечисленных катионов. В состав этой пленки входят хромат-ионы, продукты их неполного восстановления и некоторое количество чужеродных анионов (804, С1 , Вг , ВР ) [31, без [c.198]
А. Т. Ваграмян с сотр. [42] показал, что образующаяся на катоде в процессе электролиза пленка, наоборот, способствует восстановлению хромат-ионов до металла. По данным авторов, в чистом растворе хромовой кислоты электроды из хрома, железа, никеля, кобальта или других металлов покрываются прочной окисной пленкой, которая препятствует восстановлению ионов хрома даже при поляризации катода до высокого электроотрицательного потенциала. В этих условиях выделяется только водород, причем при повышенном перенапряжении. Восстановление хромат-иона на этих электродах возможно только в присутствии небольшого количества указанных выше анионов, которые служат как бы катализаторами процесса. При этом в зависимости от потенциала изменяется как характер, так и скорость электрохимических реакций. Последнее иллюстрируется поляризационными кривыми, полученными потенциостатическим методом в растворе [c.415]
Электрохимическое получение пероксодисерной кислоты возможно только в диафрагменном электролизере, в котором катодное восстановление ионов персульфата практически не протекает. Получение персульфатов осуществляют как в диафраг-менных, так и в бездиафрагменных электролизерах. Поэтому в лабораторном электролизере для получения персульфата аммония диафрагму можно не применять, что облегчает охлаждение электролита с помощью катода-холодильника. В этом случае в электролит кроме роданида аммония добавляют небольшое количество хромата калия. Последний образует в прикатодном слое защитную пленку гидроксида хрома, играющую роль диафрагмы. [c.187]
Высокозарядные ионы металлов способны восстанавливаться ступенчато и давать несколько полярографических волн. Это характерно, например, для анионов хромата, молибдата, вольфрамата, ванадата, катионов железа (П1), кобальта и др. На рис. 25.8 показано восстановление хромат-ионов в растворе гидроксида аммония. Первая волна соответствует восстановлению хромат-ионов до хрома (П1), вторая — переходу хрома(И1) в хром (И). Высшая степень окисления образует волну при более положительном потенциале, чем средняя (или низшая) степень окисления. Это явление иногда используют для устранения влияния посторонних ионов. Так, никель (И восстанавливается легче кобальта (И) и мешает определению последнего. В этом случае можно сначала окислить кобальт до трехвалентного, например пероксидом водорода в аммиачном растворе. Полярогра- [c.502]
Температура электролита и плотность тока оказывают большое влияние на выход по току и свойства катодных осадков хрома. Выход металла по току при повышении температуры уменьшается, а при увеличении плотности тока возрастает (рис. 3.31). Предполагают, что первое связано с удалением с поверхности катода продуктов восстановления хромат-ионов и растворением пленки, второе объясняется тем, что повышение плотности тока способствует накоплению продуктов реакции Сг + —>Сг + и уплотнению пленки, а это затрудняет протекание более легко идущих реакций (а) и (б) и способствует увеличению скорости осаждения металлического хрома. Для каждой температуры при прочих равных условиях существует определенный минимум плотности тока, ниже которого хром не осаждается на катоде. [c.317]
Образование высших спиртов можно также увеличить, применяя значительные количества веществ сильно основного характера. Например, если окись цинка обработать раствором двухромовокислого калия, то после восстановления хрома до трехвалентного получают катализатор, содержащий ципкат калия и хромат калия, которые промотируют синтез высших спиртов 33]. [c.149]
Приведенные в табл. 5 катализаторы [10], за исключением № 12 и 13, получены путем осаждения из концентрированных )астворов азотнокислых солей цинка [2п( ЫОз)2 — 252 г/л] и Сг(ЫОз)з — 232 г/л] насыщенным раствором карбоната аммония [(КН4)2СОз — 400г/л]. Сухие осадки прогревали в токе водорода при 400° С в течение 14 ч. Полученные таким путем цинк-хромовые катализаторы не требуют стадии восстановления, что существенно. Некоторые из них (6, 7, 8) обладают большей общей поверхностью, производительностью и удельной активностью, чем промышленные катализаторы (12 и 13), полученные мокрым и сухим способами с последующим восстановлением хромата в хромит цинка. [c.118]
Для защиты от коррозионного раэрушения стального оборудования горячей минерализованной водой с повышенным содержанием углекислого газа целесообразно использовать в качестве ингибиторов неорганические соединения. Хроматы, водные растворы аммиака, силикат натрия, фосфаты применяют в некоторых отраслях промышленности для защиты от коррозионного разрушения стального оборудования. В закрытых циркуляционных системах успешно применяют хроматы, а также -комбинированные ингибиторы, составной частью которых являются хроматы и -бихроматы. В -присутствии хроматов окисление происходит непосредственно на поверхности металла с -образованием защитной пленки из окиси железа, содержащей некоторое количество окиси хрома — продукта восстановления хромата. В том случае, если защитная пленка из окиси железа уже имелась на поверхности, роль хромата заключается в залечивании слабых участк-о.в такой пленки, а также в упрочнении и утолщении ее за счет смеси окислов железа и хрома. [c.220]
Хромат-ион в нейтральных растворах дает четыре волны при потенциалах —0,3б, —1,0 е, —1,5 в и —1,7 в (нас. к. э.) соответственно. Относительная высота первой волны увеличивается с уменьшением концентрации rOi) . Предполагается, что эта волна обусловлена восстановлением хромат-иона, но ввиду образования пленки гидроокиси хрома или основного хромата восстановление не протекает полностью. [c.329]
Примечание. При использовании чистых реактивов в описанном выше ходе анализа не наблюдается восстановления хрома (VI), но для уверенности в том, что весь хром присутствует в виде хромата, раствор можно дополнительно окислить персульфатом. После экстракции ванадия раствор подкисляют до —0,5 н. концентрации серной кислотой, добавляют 1мл1% -ного нитрата серебра и 0,5 г персульфата аммония на каждые 25 мл раствора и затем кипятят в течение 10 мин. Охлаждают, фильтруют для удаления осадка хлорида серебра или других нерастворимых веществ, вводят 1—2 мл раствора дифенилкарбазида и доводят водой до 25 или 50 мл. Вероятно, перманганат также может быть использован для окисления. [c.356]
Осадки хрома. Очень интересный случай имеет место при хромировании, где совместное осаждение окислов представляется абсолютно необходимым для получения удовлетворительного осадка. Наилучшим электролитом для осаждения этого металла может на первый взгляд показаться раствор хромовой соли. При испытании он, однако, обычно дает очень плохие результаты. Бриттон и Весткотт получили некоторые намеки на успех при хромировании из комплексных щавелевокислых растворов. С другой стороны, хорошие результаты получаются при применении растворов хромовой кислоты, содержащей серную кислоту. Для металла, который в ряду потенциалов находится на отрицательном конце, применение раствора, содержащего одновременно кислоту и окислитель, может казаться ненадежным. В действительности же среда, в которой происходит электроосаждение, не соответствует общему составу электролита. У катода хромовая кислота восстанавливается в соль хромовой кислоты и образуется тонкая пленка (которая обычно считается хроматом хрома) предполагают, что осаждение происходит из этой пленки. Если кислотность ванны недостаточна, пленка утолщается и становится видимой, давая интерференционные цвета. Это — не желательно, поэтому для получения лучших результатов концентрация кислоты должна быть такой, чтобы не растворить пленки полностью и вместе с тем достаточной для поддержания ее в пределах таких толщин, при которых она невидима Присутствие пленки считается необходимым для успешного осаждения металлического хрома, но мнения о роли ее расходятся. Есть предположения, что вещество пленки только мешает току расходоваться на нежелательные реакции, как, например, выделение водорода. Вещество пленки, — полагает Либрейх — имеет высокое значение перенапряжения, и в присутствии ее возможно восстановление хрома до металлического состояния хотя выход по току очень низкий. Число центров кристаллизации, образующееся в окислительной пленке, растет нелегко, и получается мелкокристаллический блестящий металлический слой. Естественно, [c.672]
Установлено [104], что определяющее влияние на процесс регенерации оказывает содержание ионов Сг в исходных образцах. В каталитическом выгорании углерода наиболее активное участие принимают как раз эти ионы хрома, способные легко менять валентность между Сг и Сг и катализировать окисление углерода по стадийному механизму. С увеличением количества Сг повыщается доля ионов хрома, принимающих участие в каталитическом выгорании углерода что и ускоряет процесс регенерации. Каталитическое окисление углерода происходит при попеременном окислении-восстановлении катализатора за счет образования и восстановления высщих оксидов хрома, вероятней всего СЮ3. Добавление к Сг Оз щелочных металлов приводит к образованию хроматов этих металлов и увеличению содержания ионов Сг в образцах, что ведет к ускорению выгорания углерода. Промотирование СГ2О3 щелочными металлами увеличивает количество ионов хрома, способных легко менять валентность, и облегчает возможность восстановления катализатора при зауглероживании и окисления его при регенерации. Индукционный период регенерации при промотировании СгзОз сокращается. Возрастание концентрации щелочного металла ведет к увеличению содержания ионов Сг в катализаторе [109]. [c.47]
Термостойкость неминерализованных буровых растворов определяется не только типом применяемых для обработки химических реагентов понизителей водоотдачи или вязкости и составом твердой фазы, но и в ряде случаев.от наличия в системе специальных добавок, которые сами по себе, т. е. без реагентов-понизителей водоотдачи или вязкости, не оказывают сколько-либо заметного влияния на вязкостные и фильтрационные свойства буровых растворов. К таким добавкам в основном относятся хроматы и би-хроматы натрия и калия. (Хромовые соли калия по стоимости значительно выше, а по действию аналогичны натриевым солям.) Применение метода раздельного введения хромовых солей в буровой практике Советского Союза началось в начале 60-х годов по предложению Э. Г. Кистера и быстро получило широкое распространение. Наиболее важные химические свойства хроматов — сильная окислительная способность с восстановлением шестива-лентного хрома до трехвалентного и склонность к интенсивному комплексообразованию. Окислительные свойства хроматов зависят от pH среды, наличия восстановителя и температуры. Особенно, как указывает Э. Г. Кистер, в присутствии сильных восстановителей хроматы могут окисляться в нейтральной и даже слабощелочной среде. При нагревании восстановление хроматов усиливается и проявляется даже при высоких значениях pH. Заметно ускоряется этот процесс при 80 С, а при 130—150 С достигает максимума (кривая зависимости выполаживается). [c.176]
Считается, что при электролизе хромовой кислоты на катоде образуется фазовая пленка, состоящая из продуктов неполного восстановления ионов хрома, которая играет большую роль в процессе восстановления хромат-иона до металла. Однако о характере влияния этой пленки на катодный процесс мнения различных исследователей расходятся. В ряде прежних работ (Е. Мюллер, С. Каспер и др.) высказывалось предположение, что пленка препятствует прониканию хромат-ионов к электроду и тормозит восстановление их до металла. Процесс в значительной степени облегчается в присутствии посторонних анионов (ЗОГ, 31р4, сг), которые частично разрушают пленку, обеспечивая тем самым доступ хромат-ионов к поверхности катода. [c.415]
Температура электролита и плотность тока оказывают большое влияние на выход по току и свойства катодных осадков хрома. Выход металла по току при повышении температуры уменьшается, а при повышении плотности тока увеличивается (рис. ХП-18). Предполтгают [42], что первое связано с удалением от поверхности катода продуктов восстановления хромат-ионов и [c.418]
Первые исследования в области электролитического получения хрома из растворов хромовой кислоты принадлежат Г. Либрейху и Э. Мюллеру Первый рассматривал процесс как ступенчатое восстановление СгОз через Сг + и Сг + до металла. Э. Мюллер обосновывал непосредственный разряд шестивалентного хрома до металла. Он же высказался за существование пленки основных хроматов хрома, образующихся в. непосредственной близости к катоду. [c.516]
Опыт 2. Восстановление сульфид-иоиамн хроматов и дихроматов. К 2—3 каплям раствора хромата или дихромата калия прилейте 4 -5 капель раствора сульфида аммония и слегка нагрейте. Отметьте цвет образовавшегося осадка, состоящего из гидроксида хрома (П1) и серы. [c.142]
Касаясь гомогенно-каталитического варианта, необходимо остановиться на комплексообразовании в катализе. Обычно для технологических процессов характерно использование больших количеств субстрата, а главной задачей является увеличение селективности каталитического процесса и снижение выхода побочных продурстов, приводящих к загрязнению окружающей среды. При этом постепенный переход к технологиям, в которых в качестве окислителей используют лишь О2, Н2О2 и О3, кажется перспективным и экономически и экологически, поскольку продуктом их восстановления является вода, а не водные растворы солей различных металлов (натрия в случае таких окислителей, как гипохлорит, хрома — в случае хроматов и т. д.). [c.619]
Электрохимическое восстановление монохроматных анионов с максимальным выходом желаемого продукта наблюдается на катодах с высоким перенапряжением водорода. Использование жидкого ртутного катода не всегда удобно. Поэтому для восстановления хромата натрия до гидроокиси хрома используют кадмиевортутный электрод, обладающий достаточно большим перенапряжением для разряда ионов водорода. [c.105]
В состав растворов для хроматной обработки входят обычно соли шестивалентного хрома (бихроматы натрия, калия, аммония) и активирующие анионы (СГ, N0 , SOV, POV, СНзСОО" и др.), в присутствии которых нарушается сплошность хроматной пленки и через ее поры взаимодействие раствора с металлом и рост пленки. Толщина хроматных пленок колеблется от нескольких десятых долей микрометра до 0,5 мкм. В процессе обработки при наличии анионов происходит восстановление шестивалентного хрома до трехвалентного и образуются труднорастворимые хроматы или гидрохроматы. [c.97]
chem21.info
Бихромат хромом - Справочник химика 21
ХРОМАТОМЕТРИЯ (бихроматометрия) — тнтри-метрич. метод анализа, основанный на примененип р-ра бихромата калия. Нормальный окислительный потенциал системы бихромат — хром (III) равен 1,36, [c.379]Для улучшения противокоррозионных свойств и уменьшения пористости фосфатной пленки ее рекомендуется обработать раствором основного бихромата хрома. В исходном состоянии это порошок темно-кортневого цвета. Пфед употреблениш основной бихрс яат хрома нужно растворить в воде при 60-70 ° С. Полученный раствор (концентрацией 0,7- [c.29]
Окислительный потенциал бихромата при pH О равен 1,33 в. Система бихромат/хром (III) принадлежит к числу медленных систем. Соли хрома (III) в кислой среде окисляются очень медленно. Бихромат-ионы реагируют с заметной скоростью только в достаточно кислой среде. При pH 2 большую часть времени реакция проходит медленно. Когда pH возрастает, потенциал быстро падает, а в шелочной среде идет обратная реакция — соли хрома (III) легко окисляются до хроматов. [c.557]Предложите методику получения бихромата хрома из сульфата хрома. [c.91]
Небольшие количества металлического цинка в окиси цинка можно определить косвенным методом. Цинк окисляют бихроматом, а непрореагировавшую часть бихромата — хром(У1) — определяют фотометрически с дифенилкарбазидом [821. [c.467]
Растворы, содержащие шестивалентный хром, нейтрализуют 20 %-ным раствором гидроокиси натрия до pH 4,0—5,0, пассивирующие растворы КП-2А и основной бихромат хрома — до 3,0—5,0-. [c.175]
СгОз 2 СгаОз + 3 Оз СгОз-СгаОз СгО + СгаОз -> Сга (Сг207)3 Бихромат хрома Сгг(Сг04)з Монохромах хрома [c.86]
Хроматы и бихроматы. Хром в своем высшем окислительном состоянии (6-Ь) не образует основной гидроокиси r(OH)g. Соответствующий окисел СгОз представляет собой вещество красного цвета, называемое трехокисью хрома, или хромовым ангидридом оно обладает кислотными свойствами. Трехокись хрома растворяется в воде с образованием красного раствора двухромовой кислоты Н2СГ2О7 [c.419]
Хромаммония сульфат (хромаммиачные квасцы) Хрома оксид Хроматы, бихроматы Хрома фосфат однозаме-щенный [c.684]
При 270—280° К2СГО4 реагирует с продуктом разложения СгОз— бихроматом хрома [c.569]
Для приготовления пассивирующего раствора на основе КПн2А, основного бихромата хрома и хромового ангидрида применяют воду, соответствующую требованиям п. 2 табл. 18 настоящего стандарта. [c.209]
Одна условная тющса массовой концентрации шестивалентного хрома в растворе основного бихромата хрома соответствует 0,113 кг/и состава основного бихромэта хрома. [c.210]
Корректирование пассивирующего раствора основного бихромата хрома проводят по массовой концентрации шестивалентного хрома, исходя из того, что введение 22,3 г основного бихромата хрома на 100 дм пассивирук>щего раствора повышает массовую концентрацию шестивалентного хрома на одну точку . [c.210]
chem21.info
хромат - Справочник химика 21
Предлагается [352] реактивировать алюмосиликатные катализаторы, содержащие менее 0,2 вес. % никеля (или меди, железа и ванадия), пропиткой достаточным количеством водного раствора соединений хрома, которые разлагаются при прокаливании с образованием окиси хрома, а затем обрабатывать катализатор при 538—705 °С водяным паром 2—48 ч. При этом на каждый атом никеля наносится два или больше атома хрома. Количество окиси хрома должно быть не менее 0,5 вес. % на массу катализатора. Для пропитки применяют водный раствор нитрата, ацетата хрома, хромата и бихромата аммонпя или наносят хром в процессе крекинга добавлением к крекируемому сырью нафтената, оксалата или комплексного цианида хрома. [c.223] При восстановлении хрома из оксида хрома Сг Оз алюминотермическим путем к оксиду хрома для более энергичного протекания реакции добавляется некоторое количество более богатого кислородом соединения хрома — хромат калия КаСгО. Напишите уравнение реакции восстановления алюминием этого соединения, представив его и продукты реакции в виде отдельных оксидов, и укажите, что получится при этой реакции в качестве шлака (вместо оксида алюминия). Составьте суммарное уравнение реакции. Калий в данных условиях алюминием не восстанавливается. [c.130]Соединения хрома (VI) ядовиты, и поэтому в помещениях (цеха для хромирования), где работают с трехокисью хрома, хроматами и их производными, требуется усиленная вентиляция. [c.106]
Сг (ОН)з при действии сильных окислителей в щелочной среде переходит в соединения шестивалентного хрома — хроматы, например [c.323]
В, 6В, 7В подгруппы. Образуют анионы ванадат, ниобат, танталат, хромит, хромат, молибдат, вольфрамат, манганит, манганат, перманганат. Технеций и рений образуют анионы аналогично марган- [c.149]
Хромсодержащие осадки перерабатывают с получением смешанных оксидов ферромагнитного диоксида хрома, основного сульфата хрома, фосфата хрома, хроматов, ферритов [80]. На основе ферритов и связующих добавок (например, эпоксидной смолы) получают материал, способный поглощать электромагнитные волны, защищать от магнитного воздействия. [c.120]
Тетраоксихромат цинка, фосфат хрома, хромат кальция, микротальк, красный железооксидный пигмент [c.156]
Медь (ацетат, хромит, хромат) [c.6]
Промотированные металлы или окислы металлов, например восстановленная медь, олово, кадмий или свинец и в некоторых случаях железо или никель, содержащие такие активаторы, как марганец, магний, цинк или окись хрома хроматы и хромиты особенно пригодны для процессов восстановления, например медь с хромовокислым аммонием при нагревании превращается в хромит меди перед употреблением он восстанавливается обработкой водородом [c.257]
ХРОМАТЬ Хроматы металлов первой группы и аммония [c.220]
Желательно продолжить работу с этими веществами. К другим кислородсодержащим веществам, исследование которых могло бы привести к получению новых соединений, относятся двуокись и трехокись селена, двуокись и трехокись теллура, трех-окись серы, пятиокись иода, трехокись хрома, хромат- и бихромат- ионы и т. д. [c.176]
Исследования, проведенные в нашей стране, позволили впервые в мировой практике предложить способ биохимической очистки соединений шестивалентного хрома (хроматов и бихроматов), а также хлоратов и перхлоратов. Метод основан на способности специально выведенных микроорганизмов использовать соединения хрома при окислении органических веществ, содержащихся в сточных водах. При этом в нейтральной или слабощелочной среде происходит восстановление ионов шестивалентного хрома до трехвалентного, который осаждается в виде гидроокиси, а хлораты и перхлораты восстанавливаются до практически безвредных хлоридов. Степень очистки достигает 99,4%, остаточное содержание хрома в стоках не превышает 0,4 мг/л. Технологическая схема включает усреднение производст- [c.57]
Окрашенными соединениями являются все соли катионов III аналитической группы, образуемые кислотами с окрашенными анионами все соли трехвалентного хрома—зеленые или фиолетовые, соединения шестивалентного хрома (хроматы)—желтые, бихроматы—оранжевого цвета соли никеля—зеленые кобальта—красные соединения марганца двухвалентного—розовые, четырехвалентного—черно-бурые, шестивалентного (манганаты)— зеленые, семивалентного (перманганаты)—красно-фиолетовые. Ацетат железа (III)—коричнево-чайного цвета, арсенат железа (III)— [c.206]
Непосредственное восстановление бихромата натрия аммиаком идет при 300° до хроми-хромата натрия. Хромат натрия при этой температуре не реагирует с аммиаком. При 700° бихромат и хромат натрия восстанавливаются аммиаком до хромитов [c.617]
При этом окис ) хрома получают по так называемой упрощенной схеме хроматно-серного метода, заключающейся в двухстадийном восстановлении монохромата сначала часть щелочного раствора монохромата восстанавливают жидкой серой в автоклаве, затем к полученной суспензии окиси хрома в щелочном тиосульфатном растворе добавляют остальную часть монохроматного раствора и серную кислоту и смесь кипятят. После этого дополнительно обрабатывают раствор в автоклавах при 150°. Отфильтрованный осадок хроми-хроматов прокаливают, при этом он превращается в окись хрома, не содержащую адсорбированной Щелочи, так как процесс восстановления завершается в кислой среде. Эта окись хрома не требует дальнейшей обработки и выпускается в качестве готового продукта. Раствор, оставшийся после отделения хроми-хроматов, перерабатывают на товарный сульфат натрия. В упрощенном варианте хроматно-серного метода отсутствует ряд операций, имеющихся в основном варианте — выщелачивание, фильтрование с репульпациями и сушка окиси хрома. [c.620]
Эта простая реакция обычно сопровождается побочными реакциями вследствие склонности хромового ангидрида к образованию стойких соединений с окисью хрома — хроми-хроматов состава СгОз п СггОз. [c.531]
Хроми-хроматы окрашены в черный цвет и с трудом разлагаются при прокаливании. Чтобы предупредить их образование, хромовый ангидрид прокаливают при высокой температуре и добавляют к нему восстановители. В этих условиях хроми-хроматы не образуются. [c.531]
Вследствие быстрого восстановления хромпика образование трудно разлагаемых хроми-хроматов не происходит. [c.532]
Возможно также, что в качестве конечных продуктов разрушения хроматов свинца образуются более сложные продукты типа хроми-хроматов СггОз СгОз и в качестве промежуточных продуктов — соединения типа перхроматов. [c.254]
Чтобы предупредить образование хроми-хроматов, хромовый ангидрид прокаливают при высокой температуре и добавляют к нему восстановители. В этих условиях хроми-хроматы не образуются. [c.410]
Как может быть получена окись хрома Окись хрома нерастворима в воде, растворах щелочей и кислот. Как можно перевести окись хрома в растворимое состояние (сравните с аналогичным вопросом для двуокиси титана) Напишите уравнения реакций, согласно которым из окиси хрома можно получить водный раствор хлорного хрома безводный хлорный хром металлический хром хромат калия хромит натрия. [c.70]
Лит. см. при ст. Хром, Хроматы, Хрома окислы. [c.380]
Окрашенными соединениями являются все соли катионов И1 аналитической группы, образуемые кислотами с окрашенными анионами все соли трехвалентного хрома — зеленые или фиолетовые, соединения шестивалентного хрома (хроматы) — желтые, бихроматы — оранжевого цвета соли никеля — зеленые кобальта — красные соединения марганца двухвалентного — розовые, четырехвалентного — черно-бурые, шестивалентного (манганаты) — зеленые, семивалентного (перманганаты) — красно-фиолетовые. Ацетат железа (И1)—коричнево-чайного цвета, арсенат железа (Н1) —зеленый, бромид железа ([I) — красный, хлорид железа (И1) — коричнево-желтый, гексацианоферрат (Н) железа — берлинская лазурь и гексацианоферрат (Н1) железа — турнбулева синь и роданид кобальта — синие роданид железа (И1) — красный. [c.242]
Так, хроматы можно превратить в бихроматы, и наоборот. Под действием различных окислителей Н Оа, С , Вг , КМПО4 и др. в щелочной среде соединения трехвалентного хрома переходят в соединения щестивалентного хрома — хроматы [c.211]
Введением ингибирующих присадок может быть обеспечено также повышение защитной способности лакокрасочных покрытий. Так, модифицированные сульфонатами и серофосфорсодержащими веществами изолирующие глифталевые грунтовки по своим защитным свойствам не уступают пассивирующим, модифицированным фосфатом хрома, хроматом кальция, хроматом свинца, тетраоксихроматом цинка, но по сравнению с последними не содержат токсичных хроматов, которые, кроме того, легко восстанавливаются с образованием трехвалентного хрома, не принимающего участия в процессе ингибирования. [c.176]
Хромит Хромат Гидроокись серебра в водном растворе NaOH, низкая температура [1159] [c.1305]
В этой связп уместно рассмотреть методы ириготовления таких катализаторов. Обычно окись алюминия пропитывают концентрированным раствором водорастворимой соли активных веществ и затем нагревают до 600—800°. В большинстве случаев применяют соли с максимальной степенью окисления активного элемента, папример, для хрома — хроматы, а для молибдена — молибдаты. [c.300]
Б патенте [80]рекомендуется восстанавливать алюмосиликатные катализаторы, содержащие не более 0,2 % вес. с/К1 См., сГе, V), пропиткой водным раствором соединений рома, разлагающихся при прокаливании с образованием , с последующей обработкой водяным паром в течение 2-48 ч при 538-705°С. Количество 0 должно быть меньше 0,5% от веса катализатора. Прииеняют водный раствор нит- рата и ацетата хрома, хромата и бихромата аммойия или в процессе крекинга добавляют к крекируемому сырью нафтеват, оксалат или комплексный цианид хрома. [c.60]
Пигменты и иаиолпигели для В. г. и э. не должны растворяться в воде и содержать примеси водорастворимых со,11сй. Кроме того, эти ингредиенты должны быть высокодисперсными, а также химически ииерттп.1-ми по отношению к кислым водоразбавляемым смолам. В качестве пигментов наиболее часто применяют двуокись титана рутильной модификации, железоокисные соединения (природные и синтетические), сажу, окись хрома, хромат стронция, фталоцианины, в качестве наполнителей — различные силикаты с pH [c.248]
Соединение СгОг лучше всего рассматривать как хромил-хромат (Сг0)гСг04, т. е. как соединение основного Сг и кислого Сг , а не соединение хрома со степенью окисления +4. Двуокись хрома термодинамически устойчива, но не образуется легко из водных растворов из-за кинетических эффектов [вероятно, связанных с тенденцией хрома (И1) образовывать октаэдрические комплексы, а не ионы СгО+]. [c.335]
Другой метод получения хром-хроматиых покрытий заключается в обработке стальных изделий в одном растворе. Для этого используют разбавленный универсальный электролит, содержащий, г/л хромового ангидрида 35. .. 50, серной кислоты 0,35. .. 0,5. Процесс ведут при плотности катодного тока 50 А/дм . Образуется покрытие внутренний слой — металлический хром, внешний — хроматная пленка. Для обеспечения высокой адгезии осаждаемых затем лакокрасочных покрытий с поверхностью хроматной пленки в электролит рекомендуется вводить активаторы — роданит натрия и двойную фтористую соль натрия (или калия) и алюминия. [c.693]
Окрашенными соединениями являются все соли этих катионов, образуемые кислотами с окрашенными анионами все соли трехвалентного хрома—зеленые или фиолетовые, соединения шестивалентного хрома (хроматы)—желтые, бихроматы—оранжевого цвета соли никеля—зеленые кобальта—красные соединения марганца двухвалентного—розовые, четырехвалентного— черно-бурые, шестивалентного (манганаты)—зеленые, семивалентного (перманганаты)—крас1ю-фиолетовые. Ацетат железа (ill)— коричнево-чайного цвета, арсенат железа (111)—зеленый, бромид железа (Н)—красный, хлорид железа (III)—коричнево-желтый, железогексацианоферрат (II)—берлинская лазурь и железогекса-цианоферрат (111)—турнбулева синь—синие роданид железа (111)—красный. [c.174]
Дегидрогенизация этилбензола с образованием стирола легко идет при температурах порядка 550—670°, особенно в присутствии катализаторов, в качестве каковых рекомендованы трудно восстанавливаемые окислы и сульфиды Са, Sr, Mg, Mo, V, а также фосфаты хрома, хромат магния и другие рекомендовано также прибавление к этим катализаторам небольших количеств окислов железа или меди (1—3%). При сиижеппом парциальном давлении паров этилбензола, например, путем введения в зону реакции паров воды или азота, выходы стирола при 650° могут достигать 82,7% на затраченный этилбензол. [c.552]
При прокаливании шихты, содержащей соду, она рёагирует с хромит-хроматами даже при 600°. Это послужило основанием для предложения способа переработки хромита, заключающегося в предварительном получении хромит-хромата кальция при 1000° с последующей обработкой полупродукта содой при 600—700°. В этом способе исключается необходимость в наполнителе (окиси магния, доломите), а следовательно, уменьшается количество отбросов, которое при возврате окиси кальция- в процесс становится незначительным [c.583]
Отстоявшийся монохроматный щелок подвергают травлению — обработке 73—77%-ной серной кислотой-для перевода монохромата в бихромат. После травки в раствор добавляют гипохлорит кальция (или хлорную известь) для окисления хрома, содержащегося в хроми-хроматах. Полученный раствор бихромата натрия ( красный щелок) выпаривают в две стадии в многокорпусных вакуум-выпарных батареях. После первой выпарки до концентрации ЫагСгаО 600—660 г/л отделяют на центрифуге выпавшие кристаллы безводного сульфата натрия и щелок упаривают вторично до концентрации ЫагСггО 1100—1350 г/л. [c.601]
Эта простая реакция обычно сопровождается побочными, вследствие склонности хромового ангидрида к образованию стойких соединений с окисью хрома — хроми-хроматов состава СгОз пСггОз. Хроми-хроматы окрашены в черный цвет и с трудом разлагаются при прокаливании. [c.410]
Окрашенными соединениями являются все соли катионов, образованные кислотами, в состав которых входят окрашенные анионы или катионы все соли трехвалентного хрома—зеленые или фиолетовые, соединения шестивалентного хрома (хроматы)—желтые, бихроматы—оранжевого цвета соли никеля—зеленые ко-бальтзт-красные соединения двухвалентного марганца—розовые, четырехвалентного—черно-бурые, шестивалентного (манганаты)—зеленые, семивалентного (перманганаты)—красно-фиолетовые ацетат железа (III)—красно-чайного цвета арсенат железа (III)—зеленый бромид железа (II)—красный хлорид железа (III)—коричнево-желтый железогексацианоферрат (II) железа—берлинская лазурь, гексацианоферрат (III) железа—турн-булева синь, роданид кобальта—синйй роданид железа (III)— красный. [c.279]
chem21.info









