Электронные конфигурации атомов элементов Периодической системы. Электронная конфигурация атома хрома в основном состоянии
Электронные конфигурации атомов | Задачи 183
Задача 183. Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1р3 б) 3p6 в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2р4 и) 3p7.Решение:а) Электронная конфигурация 1p3 не реализуется, потому что первый энергетический уровень (n = 1 ) содержит только s-подуровень. Максимальное число электронов на каждом энергетическом уровне равно 2n2, где n - главное квантовое число. Так на первом энергетическом уровне (n = 1) может находиться максимальное число электронов 2(2 .12 = 2). Следовательно, не только неправильно указан подуровень, но общее число электронов.
б) 3p6 – электронная конфигурация возможна, потому что на третьем энергетическом уровне содержатся s-, p- и d-подуровни. На p-подуровне содержится три атомные орбитали, а в каждой орбитали, согласно правилу Хунда, может находиться максимальное число электронов равное двум. Поэтому на 3p-подуровне может максимально находиться шесть электронов (3 . 2 = 6).
в) Электронная конфигурация 3s2 верна, потому что на третьем энергетическом уровне (n = 3) находятся s-, p- и d-подуровни. Согласно правилу Хунда, на s-подуровне, состоящем из одной атомной орбитали, может находиться максимальное число электронов равное двум.
г) Электронная конфигурация 2s2 реализуется, потому что на втором энергетическом уровне (n = 2) содержатся s- и p-подуровни, и на s-подуровне, в его единственной атомной орбитали, может содержаться максимальное число электронов равное двум.
д) Электронная конфигурация 2d5 не реализуется, потому что во втором энергетическом уровне (n = 2) d-подуровень не содержится, в этом слое расположены только s- и p-подуровни.
е) Электронная конфигурация 5d2 реализуется, потому что на пятом энергетическом уровне (n = 5) содержатся s-, p- d- и f-подуровни. Подуровень d содержит пять атомных орбиталей, в которых может находиться максимальное число электронов равное десяти (5 . 2 = 10). Запись 5d2 означает, что на 5d-подуровне содержится два неспаренных электрона.
ж) Электронная конфигурация 3f12 не реализуется, потому что на третьем энергетическом уровне (n = 3) могут находиться только s-, p- и d-подуровни.
з) Электронная конфигурация 2p4 реализуется, потому что на втором энергетическом уровне (n = 2) могут находиться только s- и p-подуровни. Подуровень p состоит из трёх атомных орбиталей, на которых, согласно правилу Хунда, может находиться до шести электронов.
и) Электронная конфигурация 3p7 не реализуется, потому что на p-подуровне, состоящем из трёх атомных орбиталей, согласно правилу Хунда, максимальное число электронов равно 6.
Задача 184. Сколько вакантных Зd-орбиталей имеют возбужденные атомы: а) С1; б) V; в) Мn?Решение:а) электронная конфигурация атома хлора имеет вид: …3s23p53d0. Графическое заполнение валентного энергетического слоя атома хлора можно представить следующей схемой:
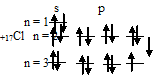
Таким образом, внешний энергетический уровень атома хлора имеет свободные орбитали на 3d-подуровне, что позволяет электронам переходить в возбуждённое состояние (перемещаться на более высокие свободные орбитали). У атома хлора возможно три состояния перемещения электронов на более высокие свободные орбитали, электроны с s- и p-подуровней переходят на 3d-подуровень:
1) При затрате некоторой энергии один из 3p-электронов атома хлора может быть переведён на вакантную 3d-орбиталь, при этом энергия атома возрастает, так что возникающая электронная конфигурация (1s22s22p63s23p43d1) соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
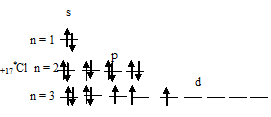
В данном случае 3d-подуровень содержит четыре вакантные орбитали возбуждённого атома хлора.
2) При затрате некоторой энергии два из 3p-электронов атома хлора могут быть переведены на вакантные 3d-орбитали, при этом энергия атома возрастает, так что возникает электронная конфигурация (1s22s22p63s23p33d2), которая соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
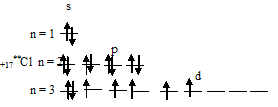
В таком возбуждённом состоянии атом хлора содержит три вакантные 3d-орбитали.
3) При затрате некоторой энергии один из 3s- и два 3p-электронов могут быть переведены на свободные 3d-орбитали, при этом энергия атома возрастает, так что возникающая конфигурация (1s22s22p63s13p33d3) также соответствует одному из возможных состояний хлора:
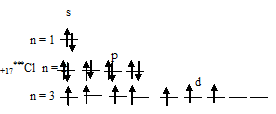
б) Электронная конфигурация валентного энергетического уровня атома ванадия имеет вид: …3d34s2. Графическая схема заполнения электронами имеет вид:
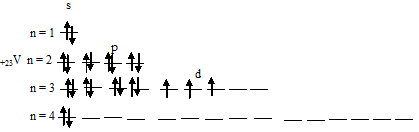
В возбуждённом состоянии атома ванадия один 4s-электрон может быть переведён на свободную 3d-орбиталь, так что возникающая электронная конфигурация валентного уровня (3d44s1) соответствует возбуждённому состоянию атома ванадия, что можно представить в виде схемы:
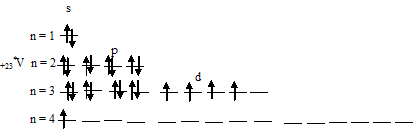
При возбуждении атома ванадия остаётся вакантной одна 3d-орбиталь.
в) Электронная конфигурация валентного энергетического уровня атома марганца имеет вид: …3d54s2. Графическая схема заполнения электронами имеет вид:
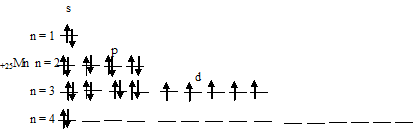
При возбуждении атома марганца один s-электрон переходит на 3d-орбиталь, при этом получается электронная конфигурация валентного уровня (3d64s1) соответствует возбуждённому состоянию атома марганца, что можно представить в виде схемы:
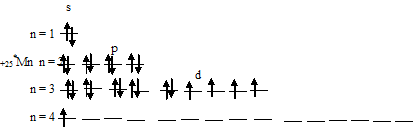
Из схемы вытекает, что при возбуждении атома марганца свободных d-орбиталей нет, так как на 3d-подуровне распределяются два спаренных электрона и четыре неспаренных. Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Задача 185. Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) Аs; г) Сг; д) Нg; е) Еu?Решение:а) Электронная формула атома бора 1s22s22p1. Валентность орбитали в этом атоме являются орбитали внешнего (второго) электронного, т.е. 2s-, 2p-орбитали. Графическая схема заполнения электронами этих орбиталей имеет следующий вид:
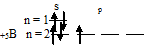
Следовательно, атом бора содержит один неспаренный 2p-электрон.
б) Электронная конфигурация валентного электронного слоя атома серы имеет вид: …2s22p4. Графическая схема заполнения электронами этого слоя имеет следующий вид:

Следовательно, атом серы в стационарном состоянии содержит два неспаренных электрона -, 2p-подуровне.
в) Электронная конфигурация валентного электронного слоя атома мышьяка имеет вид: …4s24p3. Графическая схема распределения валентных электронов имеет следующий вид:

Таким образом, атом мышьяка имеет три неспаренных электрона на 4p-подуровне.
г) Электронная конфигурация валентного электронного слоя атома хрома имеет вид: …3d5 4s1. Графическая схема заполнения электронами этого слоя имеет следующий вид:
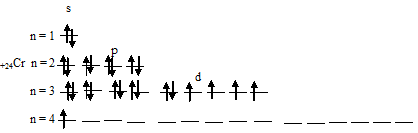
Следовательно, атом хрома в стационарном состоянии содержит шесть неспаренных электронов, из которых пять на 3d-подуровне и один на 4s-подуровне.
д) Электронная конфигурация валентного электронного слоя атома ртути имеет вид: … 6s26p0. Графическая схема заполнения электронами этого слоя имеет следующий вид:
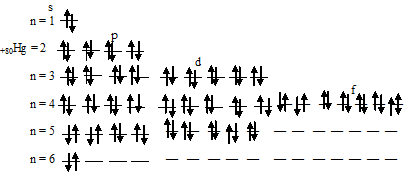
Атом ртути не содержит ни одного неспаренного электрона.
е) Электронная конфигурация валентного электронного слоя атома европия имеет вид: …4f7 6s2. Графическая схема заполнения электронами этого слоя имеет следующий вид:
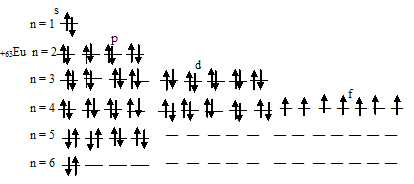
Таким образом, атом европия содержит семь неспаренных 4f-электронов.
Ответ: а) 1; б) 2; в) 3; г) 6; д) 0; е) 7.
Задача 186. Составить электронно-графические схемы ионов Ее2+ и Ее3+. Чем можно объяснить особую устойчивость электронной конфигурации иона Ее3+?Решение:Электронная формула атома железа имеет вид: 1s22s22p63s23p63d64s2. Графическая схема размещения электронов в квантовых ячейках атома железа будет иметь следующий вид:
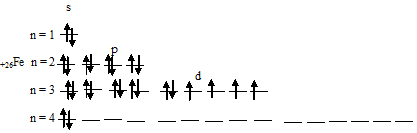
При отдаче двух 4s-электронов атомом железа образуется ион Ее2+, графическая схема размещения электронов в котором будет иметь вид:
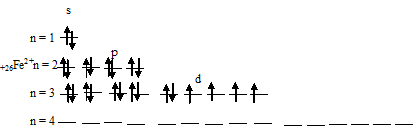
При отдаче трёх электронов (двух 4s- и одного 3d) атомом железа образуется ион Ее3+, графическая схема размещения электронов в котором будет иметь вид:
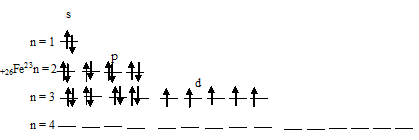
Таким образом, на внешнем энергетическом уровне иона Ее2+ содержится два 3s-, шесть 3p- и шесть 3d-электронов. Причём на 3d-подуровне содержатся четыре неспаренных и два спаренных электрона. Ион Ее3+ отличается от Ее2+ тем, что содержит на 3d-подуровне на один электрон меньше, и все они неспаренные, такая система 3d-подуровня является энергетически более устойчивой. Электростатическое взаимодействие между ядром и электронной плотностью у иона Ее3+ больше, чем у иона Ее2+.
Задача 187. Указать особенности электронных конфигураций меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?Решение:Так как число электронов в атоме элемента равно его порядковому номеру, то общее число электронов в атоме меди и хрома соответственно равно 29 и 24.
Последовательность заполнения энергетических уровней и подуровней в атоме элемента определяется правилами Клечковского, согласно которым электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией (меньшая сумма n + l). Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Электронные формулы атомов хрома и меди можно выразить следующим образом:
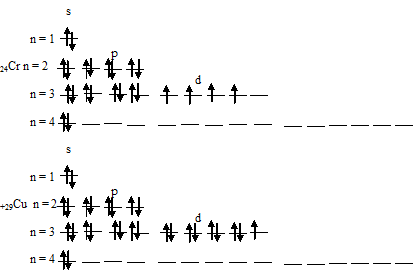
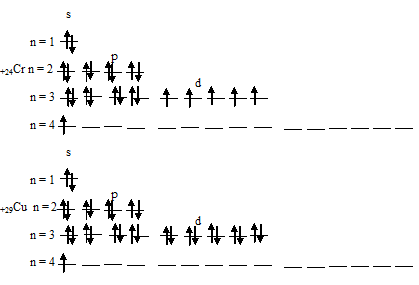
Экспериментально установлено, что на внешнем энергетическом уровне у хрома и меди находится по одному электрону. Объясняется это тем, что произошёл «провал» одного 4s-электрона у атомов хрома и меди на 3d-подуровень. Происходит это потому, что энергетически выгодным состоянием является состояние атома, когда при четырёх неспаренных электронах на 3d-подуровне происходит заполнение пятой свободной атомной орбитали. Поэтому электронная формула атома хрома имеет следующий вид: 1s22s22p63s23p63d54s1.
У атома меди все атомные орбитали 3d-подуровня заполнены, причём четыре полностью, а на пятой находится один неспаренный электрон. Такая система 3d-подуровня, состоящая из девяти электронов является энергетически неустойчивой, и поэтому происходит «провал электрона с 4s-орбитали на 3d-орбиталь. Электронную формулу атома меди можно теперь представить следующим образом: 1s22s22p63s23p63d104s1.
Таким образом, атомы хрома и меди на внешних энергетических уровнях содержат по одному 4-электрону. Графические схемы распределения электронов по квантовым ячейкам у атомов хрома и меди в стационарном состоянии будут иметь следующий вид:
buzani.ru
Электронные конфигурации атомов элементов Периодической системы.
⇐ ПредыдущаяСтр 2 из 20Следующая ⇒Распределение электронов по различным АО называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
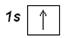
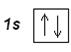
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s 1.
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками ↑ или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s-элементы, p-элементы, d-элементы, f-элементы.
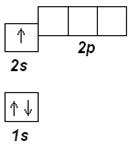
В атоме гелия Не (Z=2) второй электрон занимает 1s-орбиталь, его электронная формула: 1s 2. Электронографическая диаграмма:
Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [He].
Второй период открывает литий Li (Z=3), его электронная формула: 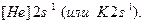 Электронографическая диаграмма:
Электронографическая диаграмма:
Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2s-орбиталь. Электронная формула Ве: [He] 2s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2р-орбиталь, В:1s22s22p1; его электронографическая диаграмма:
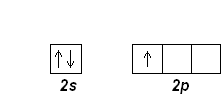
Следующие пять элементов имеют электронные конфигурации:
С (Z=6): [He] 2s 22p 2 N (Z=7): [He] 2s 22p 3

O (Z=8): [He] 2s 22p 4 F (Z=9): [He] 2s 22p 5
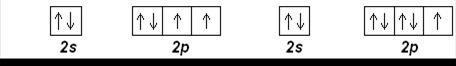
Ne (Z=10): [He] 2s 22p 6
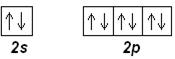
Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3s-орбиталь:
Na (Z=11): [Ne] 3s 1
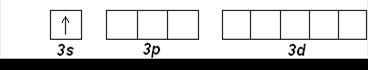
Mg (Z=12): [Ne] 3s 2
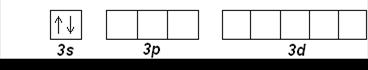
Затем, начиная с алюминия (Z=13), заполняется 3р-подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): [Ne] 3s 23p 1
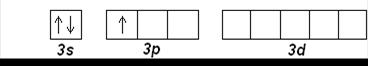

Ar (Z=18): [Ne] 3s 23p 6
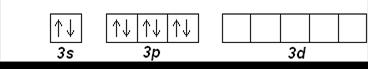
Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
В четвертом периоде, в соответствии с правилом (n+l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s-подуровень, а не 3d.Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение3d-подуровня:
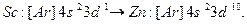
Электронные формулы d-элементов можно представить в ионном виде: подуровни перечисляются в порядке возрастания главного квантового числа, а при постоянном n – в порядке увеличения орбитального квантового числа. Например, для Zn такая запись будет выглядеть так: 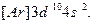 Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
В ряду 3d-элементов у хрома Сr (Z=24) наблюдается отклонение от правила (n+l). В соответствии с этим правилом конфигурация Сr должна выглядеть так: 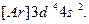 Установлено, что его реальная конфигурация -
Установлено, что его реальная конфигурация - 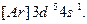 Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Отклонения от правила (n+l) наблюдаются и у других элементов (табл. 6). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4p-подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s-, 4d- и 5p- подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5s- и 4d-подуровней очень близки, и электрон с 5s-подуровня может легко переходить на 4d-подуровень. На 5s-подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s-подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n+l), должен занять 4f-подуровень. Однако у лантана La (Z=57) электрон поступает на 5d-подуровень. Заполненный на половину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (n+l). У тербия Tb (Z=65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем.
Таблица 6
Исключения из (n+l) – правила для первых 86 элементов
| Элемент | Электронная конфигурация | |
| по правилу (n+l) | фактическая | |
| Cr (Z=24) Cu (Z=29) Nb (Z=41) Mo (Z=42) Tc (Z=43) Ru (Z=44) Rh (Z=45) Pd (Z=46) Ag (Z=47) La (Z=57) Ce (Z=58) Gd (Z=64) Ir (Z=77) Pt (Z=78) Au (Z=79) | [Ar] 4s 23d 4 [Ar] 4s 23d 9 [Kr] 5s 24d 3 [Kr] 5s 24d 4 [Kr] 5s 24d 5 [Kr] 5s 24d 6 [Kr] 5s 24d 7 [Kr] 5s 24d 8 [Kr] 5s 24d 9 [Xe] 6s 24f 15d 0 [Xe] 6s 24f 25d 0 [Xe] 6s 24f 85d 0 [Xe] 6s 24f 145d 7 [Xe] 6s 24f 145d 8 [Xe]6s 24f 145d 9 | 4s 13d 5 4s 13d 10 5s 14d 4 5s 14d 5 5s 14d 6 5s 14d 7 5s 14d 8 5s 04d 10 5s 14d 10 6s 24f 05d 1 6s 24f 15d 1 6s 24f 75d 1 6s 04f 145d 9 6s 14f 145d 9 6s14f145d10 |
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f-подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f-элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d-подуровня (Hf – Hg) и 6p-подуровня (Tl – Rn).
В седьмом периоде 7s-подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n+l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. Отметим, что 6d- и 5f- подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n+l). Но в данном случае значение точной конфигурации 5f т5d mне столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
У лоуренсия Lr (Z=103) новый электрон поступает на 6d-подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Отметим, что описанные электронные конфигурации относятся к изолированным атомам в газовой фазе. Конфигурация атома элемента может быть совершенно иной, если атом находится в твердом теле или растворе.
Читайте также:
lektsia.com
Электронные конфигурации атомов элементов Периодической системы.
Распределение электронов по различным АО называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s 1.
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками ↑ или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
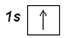
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s-элементы, p-элементы, d-элементы, f-элементы.
В атоме гелия Не (Z=2) второй электрон занимает 1s-орбиталь, его электронная формула: 1s 2. Электронографическая диаграмма:
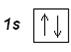
Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [He].
Второй период открывает литий Li (Z=3), его электронная формула: 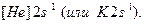 Электронографическая диаграмма:
Электронографическая диаграмма:
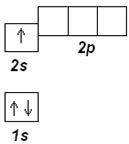
Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2s-орбиталь. Электронная формула Ве: [He] 2s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2р-орбиталь, В:1s22s22p1; его электронографическая диаграмма:
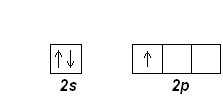
Следующие пять элементов имеют электронные конфигурации:
С (Z=6): [He] 2s 22p 2 N (Z=7): [He] 2s 22p 3

O (Z=8): [He] 2s 22p 4 F (Z=9): [He] 2s 22p 5
Ne (Z=10): [He] 2s 22p 6
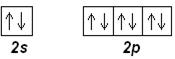
Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3s-орбиталь:
Na (Z=11): [Ne] 3s 1
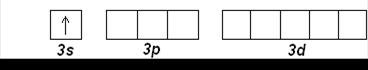
Mg (Z=12): [Ne] 3s 2
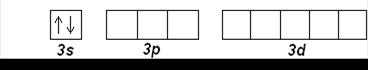
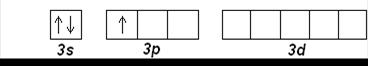
Затем, начиная с алюминия (Z=13), заполняется 3р-подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): [Ne] 3s 23p 1

Ar (Z=18): [Ne] 3s 23p 6
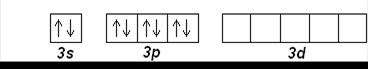
Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
В четвертом периоде, в соответствии с правилом (n+l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s-подуровень, а не 3d.Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение3d-подуровня:
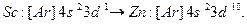
Электронные формулы d-элементов можно представить в ионном виде: подуровни перечисляются в порядке возрастания главного квантового числа, а при постоянном n – в порядке увеличения орбитального квантового числа. Например, для Zn такая запись будет выглядеть так: 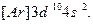 Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
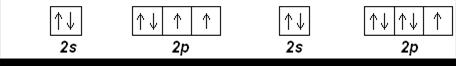
В ряду 3d-элементов у хрома Сr (Z=24) наблюдается отклонение от правила (n+l). В соответствии с этим правилом конфигурация Сr должна выглядеть так: 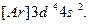 Установлено, что его реальная конфигурация -
Установлено, что его реальная конфигурация - 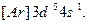 Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Отклонения от правила (n+l) наблюдаются и у других элементов (табл. 6). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4p-подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s-, 4d- и 5p- подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5s- и 4d-подуровней очень близки, и электрон с 5s-подуровня может легко переходить на 4d-подуровень. На 5s-подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s-подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n+l), должен занять 4f-подуровень. Однако у лантана La (Z=57) электрон поступает на 5d-подуровень. Заполненный на половину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (n+l). У тербия Tb (Z=65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем.
Таблица 6
Исключения из (n+l) – правила для первых 86 элементов
| Элемент | Электронная конфигурация | |
| по правилу (n+l) | фактическая | |
| Cr (Z=24) Cu (Z=29) Nb (Z=41) Mo (Z=42) Tc (Z=43) Ru (Z=44) Rh (Z=45) Pd (Z=46) Ag (Z=47) La (Z=57) Ce (Z=58) Gd (Z=64) Ir (Z=77) Pt (Z=78) Au (Z=79) | [Ar] 4s 23d 4 [Ar] 4s 23d 9 [Kr] 5s 24d 3 [Kr] 5s 24d 4 [Kr] 5s 24d 5 [Kr] 5s 24d 6 [Kr] 5s 24d 7 [Kr] 5s 24d 8 [Kr] 5s 24d 9 [Xe] 6s 24f 15d 0 [Xe] 6s 24f 25d 0 [Xe] 6s 24f 85d 0 [Xe] 6s 24f 145d 7 [Xe] 6s 24f 145d 8 [Xe]6s 24f 145d 9 | 4s 13d 5 4s 13d 10 5s 14d 4 5s 14d 5 5s 14d 6 5s 14d 7 5s 14d 8 5s 04d 10 5s 14d 10 6s 24f 05d 1 6s 24f 15d 1 6s 24f 75d 1 6s 04f 145d 9 6s 14f 145d 9 6s14f145d10 |
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f-подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f-элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d-подуровня (Hf – Hg) и 6p-подуровня (Tl – Rn).
В седьмом периоде 7s-подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n+l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. Отметим, что 6d- и 5f- подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n+l). Но в данном случае значение точной конфигурации 5f т5d mне столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
У лоуренсия Lr (Z=103) новый электрон поступает на 6d-подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Отметим, что описанные электронные конфигурации относятся к изолированным атомам в газовой фазе. Конфигурация атома элемента может быть совершенно иной, если атом находится в твердом теле или растворе.
Похожие статьи:
poznayka.org