Новая версия задачи С2 в ЕГЭ по химии 2012. Особенности и подводные камни. Взаимодействие оксида хрома 3 с карбонатом натрия
Al2O3 + Na2CO3 = ? уравнение реакции
В результате взаимодействия оксида алюминия с карбонатом натрия (Al2O3 + Na2CO3 = ?) происходит образование средней соли – алюмината натрия, а также выделение углекислого газа. Реакцию проводят при нагревании в температурном диапазоне 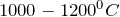 . Молекулярное уравнение реакции имеет вид:
. Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[ Al_2O_3 + Na_2CO_3 \rightarrow 2NaAlO_2 + CO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-39eba7a2d387cd834ef927b1b86110fe_l3.png)
Запишем ионные уравнения, учитывая, что оксиды на ионы не распадаются, т.е. не диссоциируют.
![Rendered by QuickLaTeX.com \[ Al_2O_3 + 2Na^{+} + CO_3^{2-} \rightarrow 2Na^{+} + 2AlO_2^{-} + CO_2;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6ad88f109137942746146896f8ce9c17_l3.png)
![Rendered by QuickLaTeX.com \[ Al_2O_3 + CO_3^{2-} \rightarrow 2AlO_2^{-} + CO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d5ac13aaf37252de1029415c9c272e6e_l3.png)
Первое уравнение называют полным ионным, а второе – сокращенным ионным.Оксид алюминия представляет собой кристаллы белого цвета, отличающиеся тугоплавкостью и термической устойчивостью. В прокаленном виде он химически пассивен; не реагирует с водой, разбавленными кислотами и щелочами. Проявляет амфотерные свойства; реагирует с концентрированными кислотами, щелочами в концентрированном растворе и при спекании.
![Rendered by QuickLaTeX.com \[Al_2O_3 + 6HCl_conc., hot \rightarrow 2AlCl_3 + 3H_2O;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-07177db4000fe79816713a5a489d99f8_l3.png)
![Rendered by QuickLaTeX.com \[Al_2O_3 + 2NaOH_conc., hot + 3H_2O \rightarrow 2Na[Al(OH)_4];\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7ceecefcf4650cf765e9d688363c50a6_l3.png)
![Rendered by QuickLaTeX.com \[Al_2O_3 + 2NaOH \rightarrow 2NaAlO_2 + H_2O;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-63450728605ad1304bd0493018d7fa92_l3.png)
![Rendered by QuickLaTeX.com \[Al_2O_3 + Na_2CO_3 \rightarrow 2NaAlO_2 + CO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8252378a5fcd49abe4c6d0c8bf24fa75_l3.png)
Оксид алюминия в промышленности получают из природных минералов, которые его содержат, например, бокситов, нефелинов, каолина, алунитов и т.д. В лаборатории эту процедуру осуществляют по следующему уравнению:
![Rendered by QuickLaTeX.com \[3Cu_2O + 2Al \rightarrow Al_2O_3 + 6Cu (1000^{0}C).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a9843be50046799fd289401d1693a6cf_l3.png)
ru.solverbook.com
Сложные задания на превращения неорганических веществ из ЕГЭ 2017.
Водный раствор нитрата меди (II) подвергли электролизу, в результате чего на катоде выделилось простое вещество красного цвета. Это вещество нагрели с оксидом меди (II). Образовавшееся соединение меди растворили в концентрированной серной кислоте. Далее к этому раствору добавили раствор сульфида натрия. Напишите уравнения четырёх описанных реакций.
1) Нитрат меди — соль, образованная катионом металла, расположенного правее водорода в ряду активности, и кислородсодержащим кислотным остатком. В случае растворов солей таких металлов на катоде протекает процесс восстановления катиона металла. В нашем случае его можно записать так:
катод: Cu2+ + 2e— => Cu0
Кислородсодержащие кислотные остатки (кроме остатков карбоновых кислот) не могут разрядиться на аноде, поскольку энергетически более выгодным является процесс окисления молекул воды:
анод: 2h3O — 4e- => O2 + 4H+
Количество электронов, которые отдает катод, равно количеству электронов, которые принимает анод. Подведем в связи с этим электронный баланс:
катод: Cu2+ + 2e— => Cu0 | ∙ 2
анод: 2h3O — 4e- => O2 + 4H+ | ∙ 1
2Cu2+ + 2h3O = 2Cu0 + O2 + 4H+ — ионное уравнение электролиза.
Добавив по 4 нитрат-иона в левую и правую часть уравнения и объединив их с противоионами, получаем полное уравнение электролиза:
2Cu(NO3)2 + 2h3O → 2Cu↓ + O2↑ + 4HNO3 (электролиз)
2) Высшие оксиды меди, железа, углерода могут реагировать соответственно с медью, железом, углеродом при нагревании. При этом образуется оксид с промежуточной степенью окисления элемента. В случае меди и оксида меди (II) реакция приводит к образованию оксида меди (I):
Cu + CuO → Cu2O (нагрев)
3) Cu+1 окисляется концентрированными серной и азотной кислотами до Cu+2:
Cu2O + 3h3SO4(конц.) → 2CuSO4 + SO2↑ + 3h3O
4) Две соли реагируют друг с другом в случае, если одновременно выполняются два требования:
* исходные соли растворимы
* в продуктах есть осадок или газ
Таким образом, реакция между растворимыми солями CuSO4 и Na2S возможна поскольку образуется осадок (CuS):
CuSO4 + Na2S → CuS↓ + Na2SO4
* среди редких случаев образования газа при взаимодействии солей обязательно следует помнить реакцию между растворами солей аммония и нитритов при нагревании, например:
Nh5Cl + KNO2 = N2↑ + 2h3O + KCl
scienceforyou.ru
Новая версия задачи С2 в ЕГЭ по химии 2012. Особенности и подводные камни
В 2012 году предложена новая форма задания С2 — в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций.Трудность такого задания состоит в том, что школьники очень плохо представляют себе экспериментальную, не бумажную химию, не всегда понимают используемые термины и протекающие процессы. Попробуем разобраться.Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно, не так, как предполагалось. В словаре приведены примеры неправильного понимания.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). Она не имеет никакого отношения к навесу над крыльцом.
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор.
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет.
- Осадок и остаток.Очень часто путают эти термины. Хотя это совершенно разные понятия.«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).«Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком.
- Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.Рассмотрим несколько примеров подобных заданий.
-
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:6Li + N2 = 2Li3N
- При взаимодействии нитридов с водой образуется аммиак:Li3N + 3h3O = 3LiOH + Nh4
- Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:2Nh4 + h3SO4 = (Nh5)2SO4
- Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:(Nh5)2SO4 + BaCl2 = BaSO4 + 2Nh5Cl
- После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
Nh5Cl + NaNO2 t° N2 + 2h3O + NaCl →
-
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18h3O
Al0 − 3e = Al3+ | 10 2N+5 + 10e = N20 3 - Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой). Образуется осадок гидроксида алюминия и выделяется углекислый газ:2Al(NO3)3 + 3Na2CO3 + 3h3O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3
- Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
2Al(OH)3 t° Al2O3 + 3h3O → - В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):NaNO3 + Nh5Cl = N2O + 2h3O + NaCl
- Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:3N2O + 2Nh4 = 4N2 + 3h3O
-
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:Al2O3 + Na2CO3 = 2NaAlO2 + CO2
- Алюминат натрия при растворении в воде образует гидроксокомплекс:NaAlO2 + 2h3O = Na[Al(OH)4]
- Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:Na[Al(OH)4] + SO2 = NaHSO3 + Al(OH)3
- Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:NaHSO3 + Br2 + h3O = NaHSO4 + 2HBr
- Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
NaHSO4 + NaOH = Na2SO4 + h3OHBr + NaOH = NaBr + h3O
-
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:ZnS + HCl = ZnCl2 + h3S
- Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:h3S + NaOH = Na2S + h3O
- Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):Na2S + FeCl2 = FeS + NaCl
- Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):FeS + O2 = Fe2O3 + SO2
- Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:SO2 + O2 = SO3
-
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
SiO2 + Mg = MgO + SiSi + Mg = Mg2Si
Можно записать при большом избытке магния суммарное уравнение реакции:SiO2 + Mg = MgO + Mg2Si
- При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):Mg2Si + h3O = Mg(OH)2 + Sih5
- Силан при сгорании образует оксид кремния:Sih5 + O2 = SiO2 + h3O
- Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:SiO2 + CsOH = Cs2SiO3 + h3O
- При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:Cs2SiO3 + HCl = CsCl + h3SiO3
Задания для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Ответы к заданиям для самостоятельного решения:
- Cu(NO3)2 → CuO → CuSO4 → CuS →СuO → Cu(NO3)2
2Cu(NO3)2 = 2CuO + 4NO2 + O2CuO + h3SO4 = CuSO4 + h3OCuSO4 + h3S = CuS + h3SO42CuS + 3O2 = 2CuO + 2SO2CuO + 2HNO3 = Cu(NO3)2 + h3O
- Ca3(PO4)2 → P → P2O5 →Na3PO4 → Ba3(PO4)2 → BaHPO4 или Ba(h3PO4)2
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO4P + 5O2 = 2P2O5P2O5 + 6NaOH = 2Na3PO4 + 3h3O2Na3PO4 + 3BaCl2 = Ba3(PO4)2 + 6NaClBa3(PO4)2 + 4h4PO4 = 3Ba(h3PO4)2
- Cu → NO2 → HNO3 → Zn(NO3)2 → Na2[Zn(OH)4]
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O4NO2 + O2 + 2h3O = 4HNO3ZnO + 2HNO3 = Zn(NO3)2 + h3OZn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
- NaCl → HCl →BaCl2 → BaSO4 → BaS → h3S
2NaCl + h3SO4 = 2HCl + Na2SO42HCl + Ba(OH)2 = BaCl2 + 2h3OBaCl2 + K2SO4 = BaSO4 + 2KClBaSO4 + 4C = BaS + 4COBaS + 2HCl = BaCl2 + h3S
-
Al2S3 → h3S → PbS →PbSO4 ↓ AlCl3 → Al(OH)3 Al2S3 + 6HCl = 3h3S + 2AlCl3AlCl3 + 3Nh4 + 3h3O = Al(OH)3 + 3Nh5Clh3S + Pb(NO3)2 = PbS + 2HNO3PbS + 4h3O2 = PbSO4 + 4h3O
- Al → Al2S3 → Al(OH)3 →K[Al(OH)4] → KAlO2 →AlCl3
2Al + 3S = Al2S3Al2S3 + 6h3O = 3h3S + 2Al(OH)3Al(OH)3 + KOH = K[Al(OH)4] K[Al(OH)4] = KAlO2 + 2h3OKAlO2 + 4HCl = KCl + AlCl3 + 2h3O
-
KI → I2 → HI → AgI ↓ Na2SO4 → BaSO4 2KI + Cl2 = 2KCl + I2I2 + Na2SO3 + h3O = 2HI + Na2SO4BaCl2 + Na2SO4 = BaSO4 + 2NaClHI + AgNO3 = AgI + HNO3
- Cr2O3 → KCrO2 → K[Cr(OH)4] →K2CrO4 →K2Cr2O7 → Cr2(SO4)3
Cr2O3 + 2KOH = 2KCrO2 + h3O2KCrO2 + 3h3O2 + 2KOH = 2K2CrO4 + 4h3O2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3OK2Cr2O7 + 3h3S + 4h3SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7h3O
- Al → K[Al(OH)4] → Al(OH)3 → Al2O3 → NaAlO2 2Al + 2KOH + 6h3O = 2K[Al(OH)4] + 3h3 K[Al(OH)4] + CO2 = KHCO3 + Al(OH)3
2Al(OH)3 t° Al2O3 + 3h3O → Al2O3 + Na2CO3 = 2NaAlO2 + CO2
- Si → K2SiO3 → h3SiO3 → SiO2 → CaSiO3 Si + 2KOH + h3O = K2SiO3 + 2h3 K2SiO3 + 2HCl = h3SiO3 + 2KCl
h3SiO3 t° h3O + SiO2 → SiO2 + CaCO3 = CaSiO3 + CO2
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
основных, амфотерных, кислотных – HIMI4KA

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
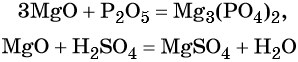
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
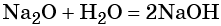
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
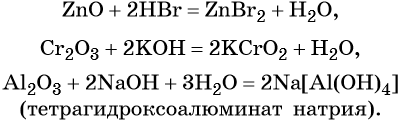
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
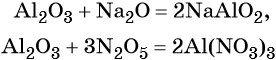
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
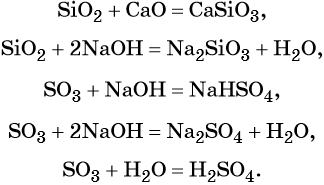
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:

Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода2) уксусная кислота и азот3) оксид лития и фосфор4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором2) водой и сульфатом натрия3) серной кислотой и оксидом фосфора (V)4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния2) оксидом углерода (II)3) оксидом азота (II)4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой2) уксусной кислотой и хлором3) оксидом натрия и азотом4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой2) серной кислотой3) оксидом лития4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой2) оксидом углерода (IV) и сульфидом натрия3) оксидом магния и азот4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью2) фосфором3) оксидом углерода (IV)4) оксидом магния
8. Оксид натрия реагирует с
1) водой2) сульфатом калия3) нитратом железа (II)4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором2) азотной кислотой и водой3) оксидом углерода (II) и железом4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)2) оксидом алюминия и оксидом хрома (II)3) соляной кислотой и оксидом кремния (VI)4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями2) растворяется в щелочах, но не реагирует с кислотами3) реагирует с оксидом натрия, но не реагирует с водой4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия2) водой3) оксидом серы (VI)4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой2) с водой и кислотами3) с водой и щелочами4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия2) оксидом калия3) оксидом азота (II)4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом2) водой и углекислым газом3) водой и гидроксидом калия4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом2) водой и углекислым газом3) водой и гидроксидом натрия4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой2) хлоридом калия3) гидроксидом натрия4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой2) оксидом фосфора (V) и водой3) сульфатом калия и водой4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой2) фосфатом кальция3) раствором гидроксида натрия4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом2) водой и углеродом3) водой и оксидом калия4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Na2O + HCl →Б) Na2O + CO2 →В) Na2O + O2 →
ПРОДУКТЫ РЕАКЦИИ1) Na2CO32) NaCl + h33) NaCl + h3O4) NaO35) Na2O2
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Na2O + h3SO4 (изб.) →Б) Na2O + Al2O3 →В) Na2O + P2O5 →
ПРОДУКТЫ РЕАКЦИИ1) NaHSO42) NaHSO4 + h3O3) NaAlO24) Na3PO45) Na2SO4 + h3O
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) CaO + h4PO4 (изб.) →Б) CaO + h3O →В) CaO + CO2 →
ПРОДУКТЫ РЕАКЦИИ1) Ca(h3PO4)2 + h3O2) CaCO33) Ca(OH)24) CaCO25) Ca3(PO4)2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) CaO + SiO2 →Б) CaO + h4PO4 (разб.) →В) CaO + HCl →
ПРОДУКТЫ РЕАКЦИИ1) Ca(h3PO4)2 + h3O2) Ca3(PO4)2 + h3O3) CaCl2 + h3O4) CaSiO3 5) Ca(OCl)2
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) ZnO + HCl →Б) ZnO + NaOH ⎯⎯h3O→В) ZnO + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ1) ZnCl2 + h3O2) ZnCl23) Na2[Zn(OH)4]4) Na2ZnO2 + h3O5) Na2ZnO2
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) ZnO + h4PO4 →Б) ZnO + NaOH + h3O →В) ZnO + C →
ПРОДУКТЫ РЕАКЦИИ1) Na2[Zn(OH)4] + h32) Na2ZnO23) Zn(h3PO4)2 + h3O4) Zn + CO5) Zn3(PO4)2 + h3O
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) P2O5 + h3O →Б) P2O5 + Ca(OH)2 ⎯⎯сплавление→В) P2O5 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ1) Ca3(PO4)2 + h3O2) CaHPO43) Na3PO4 + h3O4) Na3PO45) h4PO4
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) P2O5 + h3O →Б) P2O5 + Na2O →В) P2O5 + HNO3 →
ПРОДУКТЫ РЕАКЦИИ1) h4PO4 + HNO22) h4PO43) Na3PO44) h4PO35) HPO3 + N2O5
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) SO2 + Ca(OH)2 (изб.) →Б) SO2 + Na2O →В) SO2 + O2 →
ПРОДУКТЫ РЕАКЦИИ1) CaSO3 + h3O2) SO33) Ca(HSO3)24) Na2SO45) Na2SO3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) SO2 + h3S →Б) SO2 (изб.) + NaOH →В) SO2 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ1) Na2SO4 + h3O2) Na2SO3 + h3O3) NaHSO34) S + h3O5) NaHSO4
31. Дана схема превращений:
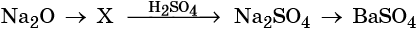
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
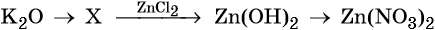
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
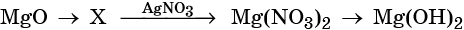
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
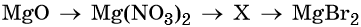
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
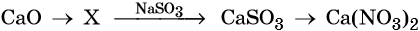
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
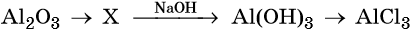
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
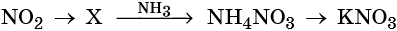
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
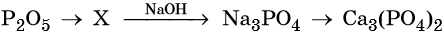
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
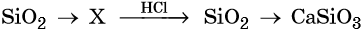
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:

Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
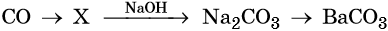
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
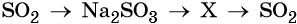
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
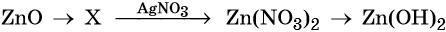
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
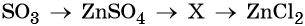
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
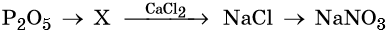
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
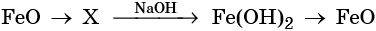
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
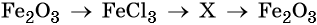
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
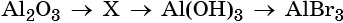
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
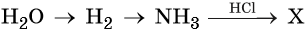
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
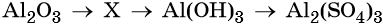
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Ответы
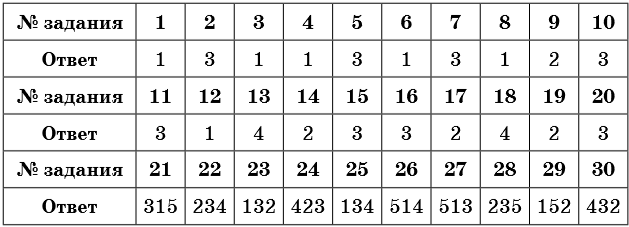
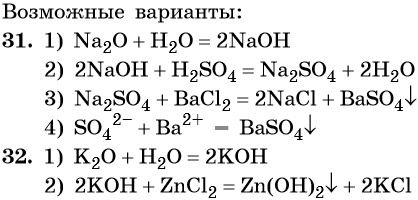
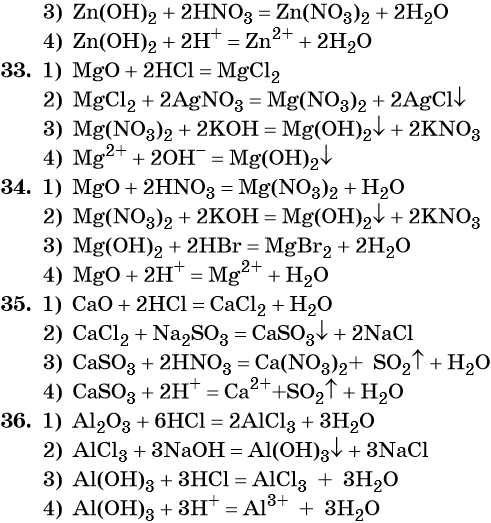
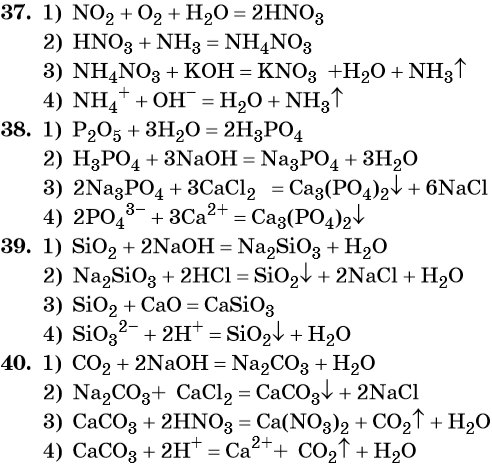
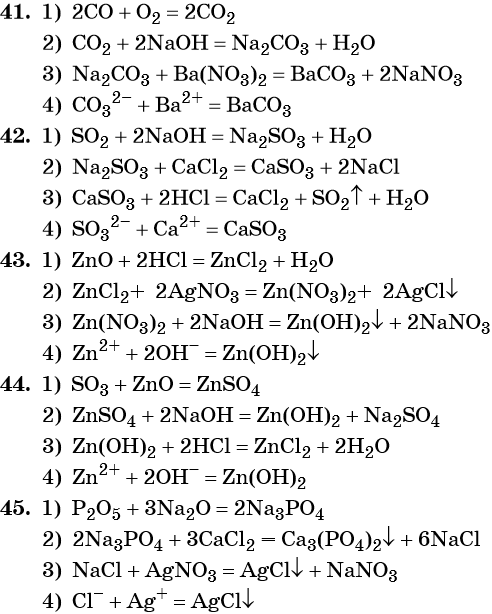
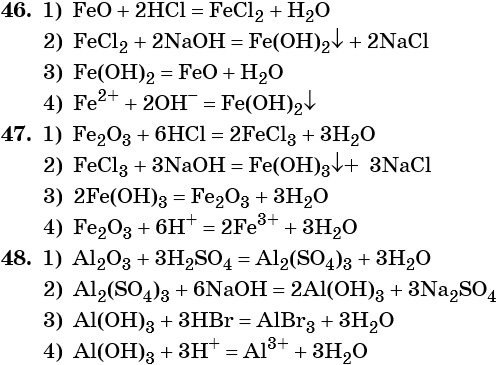
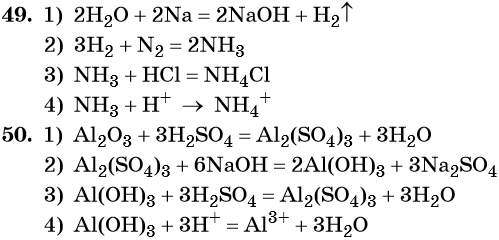
himi4ka.ru
Работа 7. ХРОМ И ЕГО СОЕДИНЕНИЯ
Описать опыт. Используя значения константы нестойкости ком-
плексов – Кн([Ag(Nh4)2]+) =9,3·10–8,Кн([Ag(S2O3)2]3-)=2,5·10–14 – объ-
яснить, почему йодид серебра не растворяется в избытке аммиака, но растворяется в растворе тиосульфата натрия.
Опыт 7. Окислительные свойства катиона Ag+
В пробирку внести 1–2капли раствора АgNO3,3–5капель3%-гораствора пероксида водорода и1–2капли раствора щелочи. Наблюдать образование мелкодисперсного металлического серебра. В отчете написать уравнение реакции, уравнять её методом полуреакций.
Контролирующие задания
1.Какие степени окисления являются характерными для меди? Приведите примеры соединений меди в данных степенях окисления.
2.Какой из реактивов позволит перевести металлическую медь в
растворимое состояние: HCl, h3SO4(конц), HNO3(конц), h3SO4(разб), ZnSO4, HI, NaOH, Pb(NO3)2? Напишите уравнения реакций.
3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu → CuCl2 → Cu(OH)2 → CuO → [Cu(Nh4)4](OH)2
4.Объясните причину устойчивости степени окисления +1 у серебра.
5.К нитрату серебра прилили раствор щелочи. Какое соединение выпало в осадок. Напишите уравнение реакции.
6.Какой из галогенидов серебра растворяется в воде? Объясните причину его хорошей растворимости.
Работа 11. ЦИНК, КАДМИЙ, РТУТЬ
Цинк, кадмий и ртуть находятся в побочной подгруппе второй группы периодической системы. Полное заполнение электронами предвнешних d-орбиталейи внешнихs-орбиталейобъясняет свойства этих элементов.
Zn, Cd, Hg – мягкие, легкоплавкие металлы, их температуры плавления ниже по сравнению с другими d-металлами,так как спаренные d- электроны атомов не принимают участия в образовании металлической связи. Ртуть, имеющая температуру плавления–38,8оС, является самым легкоплавким металлом, что позволяет использовать её в термометрах.
В своих соединениях цинк, кадмий и ртуть всегда двухвалентны. Для ртути известны соединения, в которых она, будучи двухвалентной (электронная валентность) проявляет степень окисления +1, например
studfiles.net
02 семестр / Лабораторные работы / d-металлы / lab6
11
М Г Т У и м е н и Н. Э. Б а у м а н а
Лабораторная работа
по химии.
«d - металлы».
Часть I
Выполнила: Косяк Анна
Факультет: НУК РЛМ
Группа: БМТ2 - 12
Дата выполнения: 05. 11. 2004
Дата сдачи: 12. 11. 2004
М О С К В А
2 0 0 4
Цель работы.
Ознакомиться с некоторыми металлами, являющимся d – элементами и изучить их свойства.
Теоретическая часть.
К d- элементам относятся все элементыIB–VIIIBподгрупп 4 – 7 периодов. В нашей лабораторной работе мы рассмотримCr,Mn,Cu,Zn.
Хром Cr.
Максимальная степень окисления равна 6. Тугоплавок и твердый. По отношению к воздуху и воде устойчив, вследствие образования оксидных пленок. В разбавленных кислотах HCl и h3SO4 хром окисляется, превращаясь в ионы Сr2+. Концентрированная и разбавленная азотная кислота и царская водка при комнатной температуре на хром не действуют, так как пассивируют его. По отношению к растворам щелочей в присутствии окислителей хром устойчив. Взаимодействуя с кислородом при высокой, температуре хром образует оксид Cr2O3. При действии аммиака на соли Cr3+ образуется серо – синий осадок Cr(OH)3 по свойствам похожий на Al(OH)3, и устанавливается система равновесий:
Cr3+ + 3OH- ↔ h4CrO3 ≡ HCrO2 * h3O ↔ H+ + CrO2- + 2h3O ↔ [Cr(OH)4]- + H+
При добавлении кислот равновесие смещается влево, а щелочей вправо. В концентрированных щелочах гидроксид хрома (III) растворяется, образуя комплексный ион [Cr(OH)6]3- . В щелочной среде под действием окислителей соединение хрома (III) легко окисляются в хроматы, содержащие ион CrO42- желтого цвета. При подкислении раствора, содержащего ионы CrO42-, желтая окраска переходит в оранжевую в результате образования бихромат – иона Cr2O72-. Хроматы и бихроматы в кислой среде являются сильными окислителями. Cr6+ восстанавливается до Cr3+.
Соли Cr3+ легко гидролизуютя, образуя гидросоли, являющиеся устойчивыми соединениями. Добавление к растворам солей карбоната натрия увеличивает степень гидролиза вследствие образования слабодиссоциированного вещества. Хром образует комплексные соединения, многие из которых являются очень прочными: [CrCl6]3-, [CrF6]3-, [Cr(CNS)6]3-. Координационное число для Cr3+ во всех комплексных соединениях равно 6. В избытке аммиака растворяется осадок Cr(OH)3:
Cr(OH)3 + 6Nh5OH = [Cr(Nh4)6](OH)3 + 6h3O
Марганец Mn.
Наиболее устойчивы его соединения со степенью окисления +2, +4, +7. Активный металл, легко растворяется в разбавленных кислотах, окисляясь до Mn2+. С повышением степени окисления уменьшается основной характер его оксидов и гидроксидов, повышаются их кислотные свойства:
MnO Mn2O3 MnO2 MnO3; Mn2O1
Mn(OH)2 Mn(OH)3 Mn(OH)4 h3MnO4; HMnO4
Основные свойства амфотерен кислотные свойства
При действии щелочей на соли Mn (II) образуется осадок Mn(OH)2 легко окисляющийся на воздухе в оксид – гидроксид марганца. Для соединений Mn (II) и Mn (III) характерны восстановительные свойства, а для соединений Mn (IV), Mn (VI), Mn (VII) – окислительные. Наиболее активно окислительные свойства проявляются у Mn (VII). Все соединения, в которых марганец находится в высшей степени окисления, являются очень сильными окислителями. Наибольшей окислительной способностью обладает перманганат – ион MnO4.
Соединения Mn (VI) – манганаты – малоустойчивы и в нейтральных и в кислых растворах подвергаются диспропорционированию.
Медь Cu.
Степень окисления проявляет от +1 до +3. Стандартный электродный потенциал положителен, поэтому в неокисляющих кислотах они не растворяются. Не обладают амфотерностью и со щелочами не взаимодействуют. Медь на воздухе постепенно покрывается зеленым налетом основной соли – карбоната гидроксомеди:
2Cu + O2 + CO2 + h3O = Cu(OH)2CO3
В концентрированной серной кислоте медь растворяется при кипячении:
Cu + 2h3SO4 = CuSO4 + SO2↑ + 2h3O
С азотной кислотой медь реагирует хорошо, восстанавливая ее до оксидов азота NO и NO2 в зависимости от концентрации кислоты и температуры.
Медь с кислородом образует оксид меди (I) Cu2O (красный) и оксид меди (II) CuO (черный). Оксид меди (I) во влажном состоянии неустойчив и происходит реакция диспропорционирования:
Cu2O → Cu + CuO
Оксидам меди (I) и (II) соответствуют: непрочный гидроксид CuOH (оранжевый) и гидроксид Cu(OH)2 (голубой).
Свойства меди и ее аналогов, включая способность образовывать комплексные соединения, широко используются при рафинировании металлов электролизом из водных растворов, гальваническом медении и золочении, фотографии, производстве зеркал и многих других процессах.
Цинк Zn.
Степень окисления в соединениях единственная 2+. В обычных условиях Zn постепенно окисляется кислородом воздуха только с поверхности, покрываясь плотной пленкой оксида. При наличии в среде CO2 образуется защитная пленка (ZnOH)2CO3 на его поверхности. В растворах щелочей пленка растворяется, что позволяет Zn вступать в реакцию с водой. При прокаливании образуются оксид ZnО – амфотерен.
Цинк растворяется в разбавленной соляной и серной кислотах с выделением водорода. С водой практически не реагирует, так как при погружении в воду реакция протекает на поверхности по уравнению:
Zn + 2h3O = h3↑ + Zn(OH)2↓
но тотчас же приостанавливается вследствие образования пленки гидроксида Zn(OH)2 .
При взаимодействии цинка с кислотами – окислителями в зависимости от концентрации и температуры образуются различные продукты реакции:
Zn + h3SO4 (k) → ZnSO4 + h3O + (SO2; S; S2-),
Zn + HNO3 → Zn(NO3)2 + h3O + (N2; NO; Nh5+).
Цинк – активный металл и может выступать в реакциях с водными растворами KМnO4, K2Cr2O7 как восстановитель.
Гидроксиды цинка являются слабыми основаниями, поэтому соли цинка в водных растворах подвергаются гидролизу с изменением рН среды.
При взаимодействии солей цинка с карбонатом натрия образуется карбонат цинка:
ZnCl2 + Na2CO3 = ZnCO3↓ + 2NaCl
который в воде практически нерастворим, но гидролизуется ею с образованием основного карбоната цинка:
2ZnCO3 + 2h3O = (ZnOH)2CO3 + h3CO3
Благодаря своему небольшому радиусу и наличию свободного электронного уровня ион Zn2+ является хорошим комплексообразователем, координационное число для цинка 4.
Практическая часть.
Опыт 1.
а) Название эксперимента.
Получение и свойства гидроксида хрома (III).
б) Ход эксперимента.
В две ячейки капельного планшета поместим по капле темно – синего сульфата хрома Cr2(SO4)3. К каждой капле добавим по капле раствора NaOH.
в) Наблюдения.
Окраска раствора меняется от темно – синей до зеленой.
г) Уравнения реакции.
Cr2(SO4)3 + 6NaOH = 2Сr(OH)3 + 3Na2SO4
Cr2(SO4)3
Сr(OH)3 + Na2SO4
NaOH
д) Иллюстрационный материале) Вывод.
При взаимодействии солей хрома с щелочами получается гидроксид хрома.
ж) Ход эксперимента.
В одну ячейку добавим 2 капли NaOH, а в другую 2 капли раствора серной кислоты h3SO4.
ж) Наблюдения.
В ячейке с кислотой цвет раствора стал сине – серый, осадок растворился. В ячейке с избытком щелочи осадок растворился, цвет сине - зеленый.
з) Уравнения реакции.
Сr(OH)3 + NaOH = NaCrO2 + 2h3O
2Сr(OH)3 + 2h3SO4 = Cr2(SO4)3 + 6h3O
Сr(OH)3
NaOH
NaCrO2 + h3O
Сr(OH)3
h3SO4
и) Иллюстрационный материал.
Cr2(SO4)3 + h3O
к) Вывод.Так как осадок гидроксида хрома растворился и в щелочи NaOH, и в кислоте h3SO4, то он амфотерный.
Опыт 2.
а)Название эксперимента.
Восстановление Cr+6 до Cr+3.
б) Ход эксперимента.
В ячейку капельного планшета мы поместили 1 каплю оранжевого раствора дихромата калия K2Cr2O7 и добавили к ней 1 каплю раствора серной кислоты h3SO4 и 2 капли хлорида олова SnCl2.
в) Наблюдения.
Сначала раствор был оранжевым, а при добавлении к нему хлорида олова и серной кислоты, цвет сменился на цвет морской волны.
г) Уравнение реакции.
K2Cr2O7 + 5h3SO4 + SnCl2 = Cr2(SO4)3 + 5h3O + K2SO4 + SnSO4 + Cl2
д) Иллюстрационный материал.
K2Cr2O7
h3SO4
SnCl2
Cr2(SO4)3 + h3O + K2SO4 + SnSO4 + Cl2
ж) Вывод
При воздействии на дихромат калия в кислой среде солью олова SnCl2, хром окисляется до +3.
Опыт 3.
а) Название эксперимента.
Взаимный переход хромата в дихромат.
б) Ход эксперимента.
К одной капле оранжевого раствора дихромата калия K2Cr2O7 в ячейку капельного планшета добавим 1 каплю раствора гидроксида натрия NaOH.
в) Наблюдения.
Цвет раствора меняется с оранжевого на желтый.
г) Уравнения реакций.
K2Cr2O7 + 2NaOH = K2CrO4 + h3O + Na2CrO4
K2Cr2O7
NaOH
K2CrO4 + h3O+ Na2CrO4
д) Иллюстрационный материал.е) Вывод.
Дихромат калия K2Cr2O7 не устойчив в щелочных средах и поэтому, превращается в них в хромат калия K2CrO4.
ж) Ход эксперимента.
К одной капле желтого раствора хромата калия K2CrO4 добавим 1 каплю раствора серной кислоты h3SO4.
з) Наблюдения.
Цвет раствора из желтого становится оранжевым.
и) Уравнения реакции.
2K2CrO4 + h3SO4 = K2SO4 + K2Cr2O7 + h3O
K2SO4 + K2Cr2O7 + h3O
к) Иллюстрационный материал.
K2CrO4
h3SO4
к) Вывод.Хромат калия K2CrO4 не устойчив в кислых средах и поэтому, превращается в них в дихромат K2Cr2O7.
Опыт 4.
а) Название эксперимента.
Получение гидроксида марганца и изучение его свойств.
б) Ход эксперимента.
В 3 ячейки капельного планшета капнем по одной капле сульфата марганца MnSO4. К каждой добавим по капле раствор гидроксида натрия NaOH.
в) Наблюдения.
Образуется кремовый осадок.
г) Уравнения реакции.
MnSO4 + 2NaOH = Mn(OH)2 ↓+ 2NaSO4
д) Иллюстрационный материал.
е) Вывод.
При взаимодействии солей марганца с щелочами выпадает осадок гидроксида марганца Mn(OH)2.
ж) Ход эксперимента.
К одной капле гидроксида марганца Mn(OH)2 добавим 2 капли раствора серной кислоты h3SO4, к другой 2 капли раствора гидроксида натрия NaOH, а третью оставим на воздухе, для окисления гидроксида марганца.
з) Наблюдения.
В той ячейке, где к гидроксиду марганца мы добавили кислоту, осадок растворился, и цвет раствора стал бесцветным. А в двух других ячейках осадок не растворился, цвет не изменился.
и) Уравнения реакции.
2Mn(OH)2 + O2 = 2MnO(OH)2
Mn(OH)2 + h3SO4 = MnSO4 + 2h3O
Mn(OH)2 + NaOH = осадок не растворяется, реакция не идет.
Mn(OH)2
O2
2MnO(OH)2
к) Иллюстрационный материал.
Mn(OH)2
h3SO4
MnSO4 + 2h3O
Mn(OH)2
NaOH
Реакция не идет
л) Вывод.
Так как гидроксид магния не растворяется в щелочи и растворяется в кислоте, то он основный.
Опыт 5.
а) Название эксперимента.
Получение гидроксида меди и изучение его свойств.
б) Ход эксперимента.
В ячейки капельного планшета поместим по 1 капле голубого сульфата меди CuSO4. К каждой капле добавим гидроксид натрия NaOH.
в) Наблюдения.
Выпадает голубой осадок.
г) Уравнения реакции.
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
г) Иллюстрационный материал.
д
CuSO4
NaOH
Cu(OH)2 ↓+ Na2SO4
) Вывод.При взаимодействии солей меди с щелочами образуется осадок гидроксида меди.
е) Ход эксперимента.
Добавим еще в одну ячейку 2 капли раствора гидроксида натрия, а в другую 2 капле раствора серной кислоты.
ж) Наблюдения.
В ячейке с кислотой осадок растворился, а в ячейке с щелочью – нет.
з) Уравнения реакции.
Cu(OH)2 + h3SO4 = CuSO4 + 2h3O
Cu(OH)2 + NaOH = осадок не растворяется, реакция не идет.
и) Иллюстрационный материал.
Cu(OH)2
h3SO4
CuSO4 + h3O
Cu(OH)2
NaOH
Реакция не
идет
к) Вывод.
Так как гидроксид меди растворяется в кислоте и не растворяется в щелочи, то он является основным.
Опыт 6.
а) Название эксперимента.
Характерная реакция на ионы Cu+2 .
б) ход эксперимента.
В ячейку капельного планшета поместим 1 каплю раствора сульфата меди CuSO4. Добавим одну каплю аммиака Nh5OH.
в) Наблюдения.
Выпадает синий осадок.
г) Уравнения реакции.
2CuSO4 + 2Nh5OH = Cu2(OH)2SO4 ↓+ (Nh5)2SO4
д) Иллюстрационный материал.
CuSO4
Nh5OH
Cu2(OH)2SO4 ↓+ (Nh5)2SO4
е) Вывод.При взаимодействии сульфата меди CuSO4 с щелочами получается основная соль Cu2(OH)2SO4 меди.
ж) Ход эксперимента.
Добавим еще 2 капли раствора аммиака Nh5OH.
з) Наблюдения.
Осадок растворяется, цвет раствора стал темно – синим.
и) Уравнения реакции.
Cu2(OH)2SO4 + 4Nh5OH = [Cu(Nh4)4]SO4 + 4h3O
Cu2(OH)2SO4
Nh5OH
[Cu(Nh4)4]SO4 + h3O
к) Иллюстрационный материал.л) Вывод.
В результате взаимодействия гидроксосульфата меди Cu2(OH)2SO4 и аммиака Nh5OH образуется комплексное соединение, в состав которого входит комплексный ион [Cu(Nh4)4] +2 .
Опыт 7.
а) Название эксперимента.
Получение и свойства гидроксида цинка.
б) Ход эксперимента.
В 3 ячейки капельного планшета внесем по капле хлорида цинка ZnCl2. К каждой капле добавим по капле гидроксида натрия NaOH.
в) Наблюдения.
Образуется белый нитевидный осадок.
г) Уравнения реакции.
ZnCl2 + 2NaOH = Zn(OH)2 ↓ + 2NaOH
д) Иллюстрационный материал.
е) Вывод.
При взаимодействии солей цинка с щелочами образуется гидроксид цинка Zn(OH)2.
ж) Ход эксперимента.
Добавим еще к одной капле 2 капли раствора серной кислоты h3SO4, к другой – 2 капли раствора гидроксида натрия NaOH, а к третей – 2 капли гидроксида аммония Nh5OH.
з) Наблюдения.
В ячейке с кислотой осадок растворяется, в ячейке гидроксидом аммония и с избытком щелочи осадок растворяется медленно.
и) Уравнения реакции.
Zn(OH)2 + h3SO4 = ZnSO4 + 2h3O
Zn(OH)2 + 2NaOH = Na2Zn(OH)4
Zn(OH)2 + 4Nh5OH = [Zn(Nh4)4](OH)2 + 4h3O
к) Иллюстрационный материал.
Zn(OH)2
Zn(OH)2
NaOH
Na2Zn(OH)4
h3SO4
ZnSO4 + h3O
Zn(OH)2
Nh5OH
[Zn(Nh4)4](OH)2 + h3O
л) Вывод.Так как гидроксид цинка растворяется в кислоте и растворяется в щелочах, образуя комплексную соль, то он является амфотерным.
Контрольные вопросы.
Напишите формулы оксидов и гидроксидов хрома, проявляющих: а) основные свойства; б) амфотерные свойства; в) кислотные свойства;
а) CrO, Cr(OH)2;
б) Cr2O3, Cr(OH)3;
в) CrO2, Cr(OH)4;
Составьте уравнения реакции взаимодействия амфотерного гидроксида хрома (III) с кислотами и щелочами, имея в виду образование комплексных ионов Cr(III).
Сr(OH)3 + NaOH = NaCrO2 + 2h3O
2Сr(OH)3 + 2h3SO4 = Cr2(SO4)3 + 6h3O
В какой степени окисления марганец и хром проявляют только восстановительные свойства?
Марганец и хром проявляют восстановительные свойства только степени 4+.
studfiles.net










