Валентность химических элементов. Степень окисления химических элементов. Валентность и степень окисления хрома
Электроотрицательность. Степень окисления и валентность.
Электроотрицательность
| Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов. |
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
| Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью. |
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы Nh5+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона Nh5+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами Nh5+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
| Валентность — число химических связей, которые образует атом элемента в химическом соединении. |
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
| Резюмируя информацию по валентным возможностям атома углерода: 1) Для углерода возможны валентности II, III, IV 2) Наиболее распространенная валентность углерода в соединениях IV 3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму |
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор(
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
| Резюмируя информацию по валентным возможностям атома азота: 1) Для азота возможны валентности I, II, III и IV 2) Валентности V у азота не бывает! 3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!). 4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р). |
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом азота не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
| Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму. |
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода h3S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VII. Примером соединений с VI-валентной серой являются SO3, h3SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
scienceforyou.ru
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака Nh4 равна трём, а атома серы в молекуле h3S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
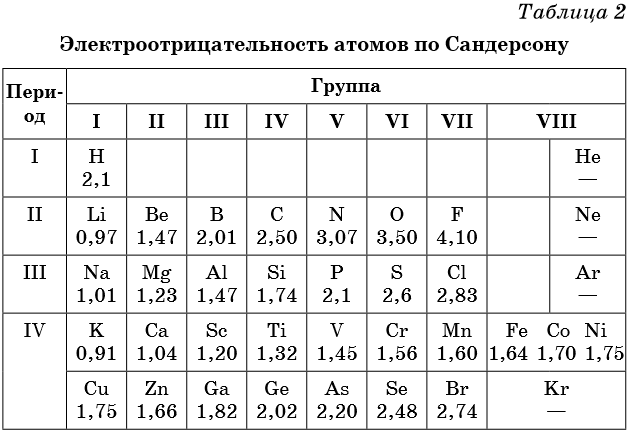
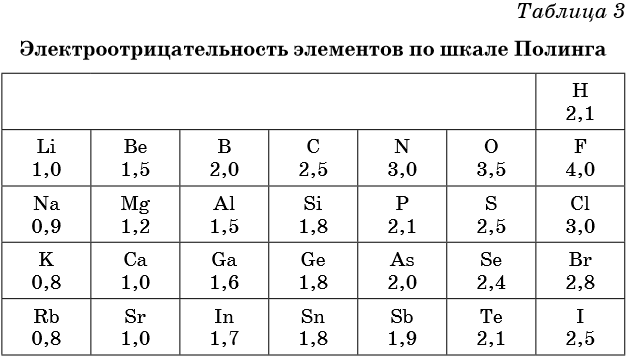
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака Nh4 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например Nh4, Ph4 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
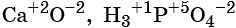
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака Nh4 или в молекуле гидразина N2h5 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO32) h4PO33) Li3P4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO32) h4PO33) Li3PO44) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO22) N2O43) N2O4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) Nh42) N2h53) N2O54) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO32) SO23) SCl24) h3SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO32) SO33) SCl24) h3SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +62) +3, +6, +63) +2, +6, +54) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) числу электронов, недостающих до завершения внешнего электронного слоя4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) номеру группы4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO32) h4PO33) Na3P4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO32) h4PO33) Na3PO44) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +32) –3, +53) +3, –34) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –22) II, –13) I, +44) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +52) II, –13) II, +64) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –32) III, +33) IV, –24) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом2) натрием3) фтором4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций2) железо3) сера4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор2) фосфор и хлор3) углерод и сера4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород2) углерод и фосфор3) углерод и кальций4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор2) железо3) кислород4) фтор
Ответы
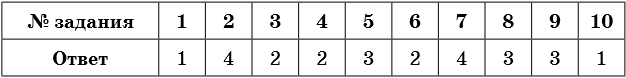
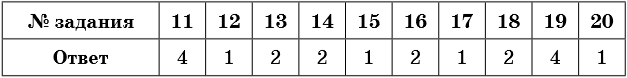
himi4ka.ru
1.8. Химические формулы.
Химическая формула отражает состав вещества. Например, Н2О два атома водорода соединены с атомом кислорода. Химические формулы содержат также некоторые сведения о структуре вещества: например, Fe(OH)3, Al2(SO4)3 в этих формулах указаны некоторые устойчивые группировки (ОН, SO4), которые входят в состав вещества его молекулы или формульной единицы.
Молекулярная формула указывает число атомов каждого элемента в молекуле. Молекулярная формула описывает вещества с молекулярным строением (газы, жидкости и некоторые твердые вещества). Состав вещества с атомной или ионной структурой можно описать только формульной единицамей.
Формульная единица указывает простейшее соотношение между числом атомов разных элементов в веществе. Например, формульная единица бензола СН, молекулярная формула С6Н6.
Структурная (графическая) формула указывает порядок соединения атомов в молекуле и в формульной единице и число связей между атомами.
1.9. Валентность
Правильное написание таких формул основано на представлении о валентности (valentia сила) как о способности атома данного элемента присоединять к себе определенное число других атомов. В современной химии рассматривается три вида валентности: стехиометрическая, электронная и структурная.
Стехиометрическая валентность химического элемента это число эквивалентов, которое может к себе присоединить данный атом, или число эквивалентов в атоме. Эквиваленты определяются по числу присоединённых или замещённых атомов водорода, поэтому стехиометрическая валентность равна числу атомов водорода, с которыми взаимодействует данный атом. Но сводородом взаимодействуют не все элементы, а скислородом – практически все, поэтому стехиометрическую валентность можно определить как удвоенное число присоединённых атомов кислорода.
Например, стехиометрическая валентность серы в сероводороде h3S равна 2, в оксиде SO2 – 4, в оксиде SO3 –6.
При определении стехиометрической валентности элемента по формуле бинарного соединения следует руководствоваться правилом: суммарная валентность всех атомов одного элемента должна быть равна суммарной валентности всех атомов другого элемента.
Зная валентность элементов и это правило, можно составить химическую формулу соединения. При составлении формул следует соблюдать следующий порядок действий.
1. Пишут, в порядке возрастания электроотрицатальности, химические символы элементов, которые входят в состав соединения, например:
KO AlCl AlO
2. Над символами химических элементов проставляют их валентность (её принято обозначать римскими цифрами):
I II III I III II
KO AlCl AlO .
3. Используя вышесформулированное правило, определяют наименьшее общее кратное чисел, выражающих стехиометрическую валентность обоих элементов (2, 3 и 6, соответственно).
4) Делением наименьшего общего кратного на валентность соответствующего элемента находят числа атомов в формуле соединений:
I II III I III II
K2O AlCl3 Al2O3
Пример 15. Составить формулу оксида хлора, зная, что хлор в нем семивалентен, а кислород двухвалентен.
Решение. Находим наименьшее кратное чисел 2 и 7 оно равно 14. Разделив наименьшее общее кратное на стехиометрическую валентность соответствующего элемента, находим числа атомов: хлора 14:7 = 2, кислорода 14:2 =7. Таким образом, формула оксида – Cl2O7.
Степень окисления также характеризует состав вещества и равна стехиометрической валентности со знаком плюс (для металла или более электроположительного элемента в молекуле) или минус.
Рекомендуется использовать следующие правила определения степеней окисления.
1. В простых веществах степень окисления элементов равна нулю.
2. Степень окисления фтора во всех соединениях равна 1. Остальные галогены (хлор, бром, иод) с металлами, водородом и другими более электроположительными элементами тоже имеют степень окисления 1, но всоединениях с более электроотрицательными элементами они имеют положительные значения степеней окисления.
3. Кислород в соединениях имеет степень окисления 2; исключением являются пероксид водорода Н2О2 и его производные (Na2O2, BaO2 и т.п., в которых кислород имеет степень окисления 1, а также фторид кислорода OF2, степень окисления кислорода в котором равна +2.
4. Щелочные элементы (Li, Na, K и др.) и элементы главной подгруппы второй группы Периодической системы (Be, Mg, Ca и др.) всегда имеют степень окисления, равную номеру группы, то есть +1 и +2, соответственно.
5. Все элементы третьей группы, кроме таллия имеют постоянную степень окисления, равную номеру группы, т.е. +3.
6. Высшая степень окисления элемента равна номеру группы Периодической системы, а низшая – разности: № группы 8. Например, высшая степень окисления азота (он расположен в пятой группе) равна +5 (в азотной кислоте и её солях), а низшая равна 3 (в аммиаке и солях аммония).
7. Степени окисления элементов в соединении компенсируют друг друга так, что их сумма для всех атомов в молекуле или нейтральной формульной единице равна нулю, а для иона его заряду.
Эти правила можно использовать для определения неизвестной степени окисления элемента в соединении, если известны степени окисления остальных, и составления формул многоэлементных соединений.
Пример 16. Определить степень окисления хрома в соли K2CrO4 и в ионе Cr2O72.
Решение. Степень окисления калия равна +1 (првило 4) а кислорода 2 (правило 3). Степень окисления хрома обохначаем Х. Для формульной единицы K2CrO4имеем:
2∙(+1) + Х + 4∙(2) = 0,
следовательно, степень окисления хрома Х = +6.
Для иона Cr2O72 имеем: 2∙Х + 7∙(2) = 2, Х = +6.
Видим, что степень окисления хрома в обоих случаях одинакова.
Пример 17. Определить степень окисления фосфора в соединениях P2O3 и Ph4.
Решение. В соединении P2O3 степень окисления кислорода равна 2. Исходя из того, что алгебраическая сумма степеней окисления молекулы должна быть равной нулю, находим степень окисления фосфора: 2∙Х + 3∙(2) = 0, отсюда Х = +3.
В соединении Ph4 степень окисления водорода равна +1, отсюда Х + 3∙(+1) = 0, Х = 3.
Пример 18. Напишите формулы оксидов, которые можно получить при термическом разложении перечисленных ниже гидроксидов (оснований и кислот): Fe(OH)3, Cu(OH)2, h3SiO3, h4AsO4, h3WO4.
Решение. Fe(OH)3 заряд гидроксид-иона равен 1, следовательно, степень окисления железа равна +3 и формула соответствующего оксида Fe2O3.
Cu(OH)2 так как имеется два гидроксид-иона, суммарный заряд которых равен 2, то степень окисления меди равна +2 и формула оксида CuO.
h3SiO3. Степень окисления водорода равна +1, кислорода 2, кремния – Х. Алгебраическое уравнение: 2∙(+1) + Х + 3∙(2) = 0. Х = +4. Формула оксида – SiO2.
h4AsO4 степень окисления мышьяка в кислоте вычисляется по уравнению:
3.(+1) + X + 4·(2) = 0; X = +5.
Таким образом, формула оксида As2O5.
h3WO4. Степень окисления волфрама, вычисленная таким же способом (проверьте!) равна +6. Следовательно, формула соответствующего оксида WO3.
Химические элементы подразделяются на элементы постоянной и переменной валентности; соответственно первые имеют постоянную степень окисления в любых соединениях, а вторые – различную, которая зависит от состава соединения/
Рассмотрим, как с помощью Периодической системы Д.И. Менделеева можно определить степени окисления элементов.
Для устойчивых степеней окисления элементов главных подгрупп наблюдается следующие закономерности.
1. У элементов IIII групп существуют единственные степени окисления положительные, и равные по величине номерам групп, кроме таллия, имеющего степеи окисления +1 и +3.
2. У элементов IVVI групп, кроме максимальной положительной степени окисления, соответствующей номеру группы, и отрицательной, равной разности между числом 8 и номером группы, существуют еще промежуточные степени окисления, обычно отличающиеся между собой на 2 единицы. Для IV группы степени окисления равны +4, +2, 4, 2; для V группы +5, +3, 3, 1; для VI группы +6, +4, 2.
3. У элементов VII группы существуют все степени окисления от +7 до 1, различающиеся на две единицы, т.е. +7,+5, +3, +1 и 1. Но в этой группе (галогены) выделяется фтор, который не имеет положительных степеней окисления и в соединениях с другими элементами существует только в одной степени окисления 1.
Примечание. Известно несколько неустойчивых соединений хлора, брома и иода с четными степенями окисления +2, +4 и +6 (ClO, ClO2, ClO3 и др.).
У элементов побочных подгрупп нет простой связи между устойчивыми степенями окисления и номером группы. Для наиболее распространённых элементов лементов побочных подгрупп устойчивые степени окисления следует просто запомнить. К таким элементам относятся: хром Cr (+3 и +6), марганец Mn (+7, +6, +4 и +2), железо Fe, кобальт Co и никель Ni (+3 и +2), медь Cu (+2 и +1), серебро Ag (+1), золото Au (+3 и +1), цинк Zn и кадмий Cd (+2), ртуть Hg (+2 и +1).
Для составления формул трех- и многоэлементных соединений необходимо знать степени окисления всех элементов. При этом количество атомов элементов в формуле определяется из условия равенства суммы степеней окисления всех атомов нулю (в формульной единице) или заряду (в ионе). Например, если известно, что в формульной единице имеются атомы K, Cr и О со степенями окисления равными +1, +6 и 2, соответственно, то этому условию будут удовлетворять формулы K2CrO4, K2Cr2O7, K2Cr3O10 и многие другие; аналогично этому иону с зарядом 2, содержащему Cr+6 и O2, будут соответствовать формулы CrO42, Cr2O72, Cr3O102, Cr4O132 и т.д.
Электронная валентность элемента равна числу химических cвязей, образуемых атомом этого элемента.
В большинстве соединений электронная валентность элементов равна стехиометрической. Но имется немало исключений. Например, в пероксиде водорода h3O2 стехиометрическая валентность кислорода равна единице (на каждый атом кислорода приходится по одному атому водорода), а электронная – двум, что следует из структурной формулы, которая показывает химические связи атомов: Н–О–О–Н. Несовпадение значений стехиометрической и электронной валентности объясняется в этом случае тем, что атомы кислорода связаны не только с атомами водорода, но и между собой.
Таким образом, имеются химические соединения, в которых стехиометрическая и электронная валентности не совпадают. К ним, например, относятся комплексные соединения.
Структурная (координационная) валентность, или координационное число определяется числом соседних атомов. Например, в молекуле SO3 у серы число соседних атомов кислорода равно 3 и структурная валентность и координационное число равно 3, тогда как стехиометрическая валентность равна 6.
Электронная и координационная валентности более подробно рассматриваются в главах «Химическая связь» и «Комплексные соединения».
studfiles.net
3.1. Степень окисления и валентность
В окислительно-восстановительных реакциях происходит изменение степени окисления некоторых (иногда всех) элементов, входящих в состав реагентов, поэтому вначале рассмотрим понятие степень окисления. Известно три определения этого понятия, которые раскрывают его со всех сторон.
Первое определение. Степенью окисления элемента в веществе называется его стехиометрическая валентность, взятая со знаком плюс или минус в соответствии с общепринятым делением элементов на электроположительные (знак плюс) и электроотрицательные (знак минус). Это определение наиболее точно выражает сущность понятия.
Другое часто встречающееся определение: степенью окисления элемента называется условный заряд его атома, вычисленный из предположения, что вещество состоит из ионов. Это определение имеет тот недостаток, что, несмотря на оговорку об условности, невольно закрепляет неправильное представление об ионном строении веществ. В действительности чисто ионных связей не бывает, а реальные заряды атомов в веществах (эффективные заряды) далеко не равны их степеням окисления.
Ещё одно определение: степенью окисления элемента в веществе называется число электронов, смещенных от атома этого элемента (при положительной степени окисления), или к атому этого элемента (при отрицательной степени окисления), вследствие поляризации химической связи. Для уяснения этого понятия необходимо иметь знания об электронном строении атомов и механизме образования и поляризации химических связей.
Степень окисления элемента формально определяется по правилам, которые являются следствием рассмотренных определений этого понятия.
1. В простых веществах степень окисления элементов равна нулю.
2. Водород в большинстве соединений имеет степень окисления +1, но в соединениях с металлами (гидридах) она равна -1.
3. Кислород в большинстве соединений находится в степени окисления -2, но в пероксидах его степень окисления равна -1.
4. Фтор во всех соединениях имеет степень окисления -1.
5. Металлы в соединениях имеют положительную степень окисления, причем, щелочные металлы всегда +1, металлы второй группы (кроме ртути) всегда +2, алюминий всегда +3.
6. Алгебраическая сумма степеней окисления всех атомов в молекуле или формульной единице вещества равна нулю, а в ионе – заряду иона.
Степень окисления указывается над символом атома арабской цифрой со знаком плюс или минус впереди, например:
.
Степень окисления следует отличать от заряда иона, который указывается вверху справа цифрой со знаком позади (но цифра 1 не ставится), например: Fe2+, Cl–, SO42–, PO43–, Nh5+.
Встречаются соединения, в которых трудно определить знак степени окисления элемента, например, соединения двух неметаллов. В таких случаях сравнивают электроотрицательность элементов, входящих в состав данного соединения. Электроотрицательность характеризует свойство атомов притягивать валентные электроны. Она выражается относительным числом в шкале, где за единицу принята электроотрицательность лития. В соединениях элемент с большей электроотрицательностью имеет отрицательное значение степени окисления, а его партнер по химической связи – положительное.
Электроотрицательность является периодическим свойством. Электроотрицательность элементов главных подгрупп в периодах увеличивается, например: Li(1,0) – Be(1,5) – B(2,0) - C(2,5) – N(3,0) – O(3,5) – F(4,0), а в группах уменьшается, например: F(4,0) – Cl(3,0) – Br(2,8) – I(2,5). У элементов побочных подгрупп (все они являются металлами) электроотрицательность равна 1,5 – 1,8. Электроотрицательность водорода равна 2,1.
Пример 1. Определите степень окисления серы в соединениях SO2, SO3 и h3S.
Вставка
Пример 2. Определите степень окисления марганца в в соединениях MnO2 и KMnO4.
Вставка
Пример 3. Определите степень окисления хрома в в соединениях K2CrO4, K2Cr2O7 и Cr2(SO4)3.
Вставка
Пример 4. Определите степень окисления элементов в соединениях CS2, PCl5, Nh4 и Ph4.
Вставка
Пример 5. Определите степень окисления азота в соединениях Nh5NO3, Nh5NO2, Ash4.
Вставка
studfiles.net
Степень окисления. Валентность. - Химия
Просмотр содержимого документа «Степень окисления. Валентность.»
Степень окисления. Валентность.
1. Степень окисления серы в сернистом газе такая же, как и в
1) 
2) 
3) 
4) 
2. Одну и ту же степень окисления азот имеет в соединениях
1) Nh4 и N2O3
2) NO2 и NaNO2
3) N2O и NO
4) Mg3N2 и Nh5Cl
3. Одну и ту же степень окисления фосфор имеет в соединениях
1) PCl3 и Ph4
2) PCl3 и PCl5
3) P2O2 и h4PO4
4) Ca3P2 и Ph4
4. Степень окисления атома азота в соединении NO2 такая же, как у серы в
1) FeS2
2) NaHSO3
3) КНSO4
4) SO3
5. Степень окисления атома хрома в соединении Na2Cr2O7 такая же, как у серы в
1) FeS2
2) NaHSO3
3) KHSO4
4) SO2
6. Низшую возможную степень окисления углерод имеет в
1) СаСО3
2) СО
3) СН4
4) С2Н4
7. Низшую возможную степень окисления кремний имеет в
1) СаSiО3
2) SiCl4
3) Mg2Si
4) Si2H6
8. Сера проявляет высшую степень окисления в соединении, формула которого
1) FeS2
2) NaHSO3
3) KHSO4
4) SO2
9. Марганец проявляет высшую степень окисления в соединении, формула которого
1) MnS
2) MnSO4
3) K2MnO4
4) KMnO4
10. Такую же степень окисления, как в PCl3, фосфор имеет в
1) РСl5
2) Р2O5
3) Н3РО4
4) Н3РО3
11. Такую же степень окисления, как в СrO3, хром имеет в
1) CrСl2
2) Cr2O3
3) Cr(OH)3
4) K2CrО4
12. Сера проявляет отрицательную степень окисления в
1) 
2) 
3) 
4) 
13. Углерод проявляет отрицательную степень окисления в
1) 
2) 
3) 
4) 
14. В каком соединении азот имеет отрицательную степень окисления?
1) 
2) 
3) 
4) 
15. Высшую степень окисления хром проявляет в
1) 
2) 
3) 
4) 
16. Высшую степень окисления марганец проявляет в
1) 
2) 
3) 
4) 
17. Высшую степень окисления иод имеет в
1) 
2)
3)
4)
18. Высшую степень окисления углерод имеет в
1) 
2)
3)
4)
19. Углерод проявляет отрицательную степень окисления в соединении с
1) хлором
2) кальцием
3) фтором
4) кислородом
20. Степень окисления, равную −2, сера проявляет в каждом из двух соединений:
1) и
2) и
3) и
4) и
21. Постоянную степень окисления в соединениях проявляет
1) фтор
2) медь
3) водород
4) хлор
22. В каком ряду степень окисления серы не изменяется?
1)
2)
3)
4)
23. В каком ряду степень окисления марганца не изменяется?
1)
2)
3)
4)
multiurok.ru
1.7 Валентность и степень окисления элементов. Химическая связь и строение вещества
Похожие главы из других работ:
Виды химических реакций, их использование в промышленности
2.5.2 Валентность
Валентность (от лат. valens -- имеющий силу) -- способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. В соединениях, образованных при помощи ионных связей...
Водород и его свойства
Степени окисления
Атом водорода в соединениях с более электроотрицательными элементами проявляет степень окисления +1, например HF, h3O и др. А в соединениях с металлами-гидридах - степень окисления атома водорода равна -1, например NaH, Cah3 и др...
Кинетика химических реакций
13.1 Константа равновесия, степень превращения
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как согласно закону действующих масс...
Комплексные соединения хрома. Соль Рейнеке
§4. Высшие состояния окисления хрома
...
Моносахариды. Глюкоза
4.4 Реакции окисления
Окисление глюкозы можно осуществить различными по силе окислителями, которые, соответственно этому, дают разные продукты окисления. Глюкоза окисляется до гликоновойкислоты в мягких условиях такими слабыми окислителями...
Получение акролеина газофазным окислением пропилена кислородом воздуха
1.4 Кинетика процесса окисления пропилена
Процесс окисления пропилена проходит в присутствии катализатора и является гетерогенно-каталитическим. В качестве катализатора используется оксиды переходных металлов CuO + Cu2O, V2O5...
Синтез непредельных карбонильных соединений
5. Реакции окисления
...
Степень окисления. Влияние методов получения пленок SiO2 на их свойства
Понятие и описание степень окисления
Степень окисления -- вспомогательная условная величина для записи процессов окисления, восстановления и окислительное - восстановительные реакций...
Химическая связь и строение вещества
1.8 Стеохимическая валентность
Для стеохимических расчетов, а так же для составления химических формул и уравнений необходимо знание количественных соотношений атомов различных элементов, в которых они соединяются или реагируют...
Химические свойства простых циклических эфиров на примере этилоксирана
3.9 Реакции окисления
Окись этилена может быть окислена в зависимости от условий до гликолевой кислоты или до диоксида углерода: 3...
Химические соединения на основе кремния и углерода
2.1.1 Степень окисления +2
Оксид углерода СО (угарный газ): по строению молекулярных орбиталей (табл.4). СО аналогичен молекуле N2. Подобно азоту СО обладает высокой энергией диссоциации (1069 кДж/ моль), имеет низкую Тпл (69 К) и Ткип (81,5 К), плохо растворим в воде...
Химические соединения на основе кремния и углерода
2.1.2 Степень окисления +4
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна. Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции...
Химические элементы, их связи и валентность
5. Валентность химических элементов
Способность атомов присоединять определенное число атомов других элементов называется валентностью элемента. С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента...
Электродные реакции на пленках поли-3,4-этилендиокситиофена с включениями частиц золота
5.2.а Процессы окисления аскорбиновой кислоты и допамина
Для характеристики электрохимических свойств композитных пленок нами проводился поиск тестовых реакций, позволяющих провести оценку свойств этих материалов. Учитывая...
Электролиты, их свойства и применение
1.1 Слабые электролиты. Константа и степень диссоциации
Молекулы слабых электролитов лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциирующими молекулами...
him.bobrodobro.ru
Степень окисления. Валентность. - Химия
Просмотр содержимого документа «Степень окисления. Валентность.»
Степень окисления. Валентность.
1. Степень окисления серы в сернистом газе такая же, как и в
1) 
2) 
3) 
4) 
2. Одну и ту же степень окисления азот имеет в соединениях
1) Nh4 и N2O3
2) NO2 и NaNO2
3) N2O и NO
4) Mg3N2 и Nh5Cl
3. Одну и ту же степень окисления фосфор имеет в соединениях
1) PCl3 и Ph4
2) PCl3 и PCl5
3) P2O2 и h4PO4
4) Ca3P2 и Ph4
4. Степень окисления атома азота в соединении NO2 такая же, как у серы в
1) FeS2
2) NaHSO3
3) КНSO4
4) SO3
5. Степень окисления атома хрома в соединении Na2Cr2O7 такая же, как у серы в
1) FeS2
2) NaHSO3
3) KHSO4
4) SO2
6. Низшую возможную степень окисления углерод имеет в
1) СаСО3
2) СО
3) СН4
4) С2Н4
7. Низшую возможную степень окисления кремний имеет в
1) СаSiО3
2) SiCl4
3) Mg2Si
4) Si2H6
8. Сера проявляет высшую степень окисления в соединении, формула которого
1) FeS2
2) NaHSO3
3) KHSO4
4) SO2
9. Марганец проявляет высшую степень окисления в соединении, формула которого
1) MnS
2) MnSO4
3) K2MnO4
4) KMnO4
10. Такую же степень окисления, как в PCl3, фосфор имеет в
1) РСl5
2) Р2O5
3) Н3РО4
4) Н3РО3
11. Такую же степень окисления, как в СrO3, хром имеет в
1) CrСl2
2) Cr2O3
3) Cr(OH)3
4) K2CrО4
12. Сера проявляет отрицательную степень окисления в
1) 
2) 
3) 
4) 
13. Углерод проявляет отрицательную степень окисления в
1) 
2) 
3) 
4) 
14. В каком соединении азот имеет отрицательную степень окисления?
1) 
2) 
3) 
4) 
15. Высшую степень окисления хром проявляет в
1) 
2) 
3) 
4) 
16. Высшую степень окисления марганец проявляет в
1) 
2) 
3) 
4) 
17. Высшую степень окисления иод имеет в
1) 
2)
3)
4)
18. Высшую степень окисления углерод имеет в
1) 
2)
3)
4)
19. Углерод проявляет отрицательную степень окисления в соединении с
1) хлором
2) кальцием
3) фтором
4) кислородом
20. Степень окисления, равную −2, сера проявляет в каждом из двух соединений:
1) и
2) и
3) и
4) и
21. Постоянную степень окисления в соединениях проявляет
1) фтор
2) медь
3) водород
4) хлор
22. В каком ряду степень окисления серы не изменяется?
1)
2)
3)
4)
23. В каком ряду степень окисления марганца не изменяется?
1)
2)
3)
4)
multiurok.ru