Нормальное и возбужденное состояние атома. Валентность хрома в возбужденном состоянии
Атомная валентная зона. Возможные валентные состояния
Атомная валентная зона (АВЗ) – это часть электронной оболочки, которая может перестраиваться по ходу образования химической связи. АВЗ включает, как правило, внешний s– подуровень (ns) и тот подуровень, который заполняется у данного элемента (таблица 3).
Таблица 3 - АВЗ
| Семейство | АВЗ | Максимально возможная валентность |
| s | ns | 1-2 |
| p | ns np | 1-8 |
| d | (n-1)d ns | 1-8 |
| f | (n-2)f ns | 1-8 |
Оставшаяся часть электронной оболочки в совокупности с ядром называется атомным остовом или химическим ядром.
Пример.
Определите возможные валентные состояния и укажите семейство для элементов с порядковыми номерами 11, 20, 8, 34, 22, 43, 28.
Запишем электронные формулы этих элементов, подчеркнём их АВЗ и для неё построим энергетическую диаграмму:

11Na 1s22s22p63s1 На внешнем энергетическом уровне у натрия находится только один электрон, поэтому он может проявлять только одну валентность, равную единице (В=1).
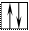 20Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0).
20Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0).
 При получении незначительного количества энергии электроны могут переходить с одного энергетического подуровня на другой, но только в пределах своего уровня. Энергия, затрачиваемая на распаривание электронов, незначительна и окупается энергией, выделяющейся при образовании связи.
При получении незначительного количества энергии электроны могут переходить с одного энергетического подуровня на другой, но только в пределах своего уровня. Энергия, затрачиваемая на распаривание электронов, незначительна и окупается энергией, выделяющейся при образовании связи.
В таком состоянии валентность кальция равна двум (В*=2).
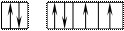
8O 1s22s22p4 Поскольку здесь нет свободного d– подуровня на втором энергетическом уровне, то электроны распаривать некуда и кислород может быть только двухвалентен.
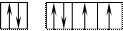
34Se 1s22s22p63s23p63d104s24p4 В=2. Но, не смотря на то, что и селен, и кислород стоят в одной группе, имеют сходное строение электронной оболочки и должны проявлять одинаковую валентность, оказывается, что у селена имеется свободный d– подуровень на четвёртом уровне, куда могут распариваться валентные электроны.

В этом случае В*=4; 6.


 22Ti1s22s22p63s23p63d24s2. На первый взгляд, в атоме титана имеется два неспаренных электрона на предвнешнем d– подуровне, которые могли бы вступить в образование связи. Но, на самом деле, они экранируются внешними спаренными s– электронами, поэтому в стационарном состоянии валентность титана равна нулю. В возбуждённом состоянии внешние s– электроны четвертого уровня распариваются (один из них переходит на р– подуровень того же уровня). Поскольку сразу два электрона получили некоторый избыток энергии, то они оба вступают в химическое взаимодействие, то есть В*=2.
22Ti1s22s22p63s23p63d24s2. На первый взгляд, в атоме титана имеется два неспаренных электрона на предвнешнем d– подуровне, которые могли бы вступить в образование связи. Но, на самом деле, они экранируются внешними спаренными s– электронами, поэтому в стационарном состоянии валентность титана равна нулю. В возбуждённом состоянии внешние s– электроны четвертого уровня распариваются (один из них переходит на р– подуровень того же уровня). Поскольку сразу два электрона получили некоторый избыток энергии, то они оба вступают в химическое взаимодействие, то есть В*=2.
Что касается d– электронов на третьем энергетическом уровне, то они расположены ближе к ядру и поэтому обладают меньшим запасом энергии. Вследствие этого они менее активны и в образование связи могут вступать по одному. То есть В*=3; 4. Но, поскольку не все теоретически определённые валентности для элементов d– семейства обнаруживаются экспериментально, для них целесообразно указывать интервал валентностей. Например, В*=2-4.

43Tc 1s22s22p63s23p63d104s24p64d55s2
В стационарном (невозбуждённом) состояние В = 0.
В возбуждённом состоянии В* = 2-7.
 |

28Ni 1s22s22p63s23p63d84s2 В=0.
Следует учитывать, что хотя у никеля присутствуют и спаренные электроны на 3d– подуровне, и вакантные места на 4р– подуровне, мы не можем переместить эти электроны с 3d– подуровня на 4р– подуровень, поскольку это различные энергетические уровни.

В возбуждённом состоянии В*=2-5.
Первые два элемента (Na и Са) относятся к s– семейству, поскольку у них последним застраивается s- подуровень, вторые два элемента (O и Se) относятся к p– семейству, поскольку у них последним застраивается p– подуровень, последние три элемента (Ti, Tc и Ni) относятся к d– семейству, поскольку у них последним застраивается d– подуровень.
Проскок (провал) электронов
Проскок электрона - отступления от общей для большинства элементов последовательности заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем, что эти "нарушения правил" обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек "по правилам".
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d- подуровня за счёт проскока (или провала) электрона с внешнего s- подуровня на нижележащий (предвнешний) d- подуровень (закономерные проскоки).
Таблица 4 – АВЗ элементов, характеризующихся провалом электрона
| Элемент | Атомная валентная зона | |
| теоретическая | практическая | |
| Cu | 3d9 4s2 | 3d10 4s1 |
| Ag | 4d9 5s2 | 4d10 5s1 |
| Au | 5d9 6s2 | 5d10 6s1 |
| Cr | 3d4 4s2 | 3d5 4s1 |
| Mo | 4d45s2 | 4d5 5s1 |
Теперь для этих элементов определим возможные валентные состояния.
Построим энергетическую диаграмму АВЗ для меди.
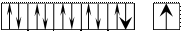
На этой диаграмме изображение s– электронов имеет чуть больший размер, чем d– электронов.
В таком состоянии медь одновалентна, так как присутствует только один неспаренный электрон. А на практике оказывается, что медь проявляет валентность, равную двум. Следовательно, возможно, вопреки правилу, перевести один проскочивший электрон с предвнешнего 3d– подуровня на внешний 4р– подуровень. В этом случае В*=2.

Поскольку остаётся ещё один неспаренный электрон на предвнешнем d– подуровне, то медь может быть, хотя и реже (так как этот электрон менее активен), трехвалентна.
Остальные 3d– электроны перевести на р– подуровень нельзя, поскольку это другой энергетический уровень.
Для золота характерна та же картина: В = 1; 2*; 3*. Отличие заключается в том, что этот элемент стоит в шестом периоде и, следовательно, имеет больший радиус. Поскольку электроны ядром удерживаются слабее, то их оторвать проще. Поэтому золото чаще всего трёхвалентно, так как отдаёт сразу все электроны.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице. Объясняется это строением электронной оболочки палладия- элемента, который стоит перед серебром. Дело в том, что палладий - единственный элемент в таблице, у которого происходит провал не одного электрона, а сразу двух. То есть, электронная формула имеет вид 4d10 5s0, вместо 4d8 5s2. Поэтому номер периода не соответствует количеству уровней, так как нет электронов – нет уровня. Серебро идёт сразу за палладием и у него происходит стабилизация 4d– подуровня (электрон оттуда вернуться уже не может), а следующий электрон попадает уже на 5s– подуровень.
 Что касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:
Что касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:
В данном случае s– электроны выделены более чётко, так как являются более активными. Поэтому при вступлении в связь хром и молибден отдают, как правило, не один, а сразу два электрона. Значит В*=2-6.
Можно привести достаточно большое количество незакономерных проскоков. Например, Ru : 4d75s1 (вместо 4d65s2), Pt: 5d96s1 (вместо 5d86s2) и так далее. Валентность рутения определяется по такому же принципу как и у хрома, а валентность платины – по такому же принципу как и у меди.
2 z:\A327-325-sUsersPTmtKtmbefатом1designimagesFwd_h.gifz:\A327-325-sUsersPTmtKtmbefатом1designimagesBwd_h.gifПериодическая система элементов
Периодический закон
Поскольку химические свойства обусловлены строением электронных оболочек атома, то периодическая система Менделеева – это классификация элементов по электронным структурам их атомов. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным. Поэтому современная формулировка периодического закона гласит: «Свойства элементов, а так же свойства и форма образуемых ими соединений находятся в периодической зависимости (правильно повторяются) от зарядов ядер их атомов».
infopedia.su
Валентность селена (Se), формулы и примеры
Общие сведения о валентности селена
В свободном состоянии селен образует несколько аллотропных видоизменений, из которых наиболее устойчивым является аморфный селен, представляющий собой красно-бурый порошок, и серый селен, образующий хрупкие кристаллы с металлическим блеском. Селен полупроводник.
Валентность селена в соединениях
Селен–тридцать четвертый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIA группе. В ядре атома селена содержится 34 протона и 45 нейтронов (массовое число равно 79). В атоме селена есть четыре энергетических уровня, на которых находятся 34 электрона (рис. 1).
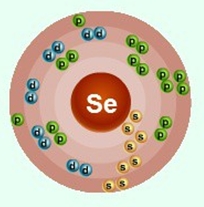
Рис. 1. Строение атома селена.
Электронная формула атома селена в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
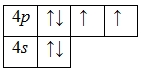
Наличие двух неспаренных электронов свидетельствует о том, что селен способен проявлять валентность II (низшая валентность) в своих соединениях (h3Se).
Для атома селена характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
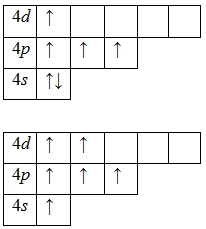
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что селен проявляет в своих соединениях валентности IV (SeO2) и VI (h3SeO4) (высшая валентность).
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Нормальное и возбужденное состояние атома.
Нормальное состояние атома можно еще назвать состоянием покоя; находясь в нем, атом не может излучать до тех пор, пока не будет возбужден внешними причинами. Процесс возбуждения заключается в выбрасывании одного или нескольких электронов тем или иным образом с нормальной орбиты на внешнюю орбиту либо в их полном удалении из атома. Не вое электроны могут быть с одинаковой легкостью смещены с нормальных орбит. Те из них, которые движутся ближе к ядру, связаны притяжением ядра сильнее электронов, вращающихся по большим орбитам. Возбуждение атома, предшествующее излучению обычного линейчатого спектра, состоит в перемещении одного из наименее связанных электронов на еще более удаленную орбиту или в полном освобождении его из атома. В последнем случае атомный остаток, являющийся благодаря потере одного отрицательного электрона положительным ионом, легко захватывает извне другой электрон вместо потерянного; когда он занимает вакантное место во внешнем слое атома, атом испускает свет.
Валентность и степень окисления.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
IV. Периодический закон и таблица Менделеева.
1)Предпосылки открытия Периодического закона Д. И. Менделеевым. Формулировка периодического закона. Современная формулировка.
предпосылки: Накопление фактологического материала
Формулировка, данная Менделеевым: свойства хим.элементов и образованных ими веществ находятся в периодической зависимости от величины атомной массы элементов ( 1869г)
Современная формулировка: Свойства хим.элементов и образованных ими веществ находятся в периодической зависимости от величины ядерных зарядов элемента.
2)
План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1.Название
2.Химический знак
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле N электронов = 2n2, где n – номер энерг.уровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (Rh5, Rh4 и т.д.) – только для элементов 4 -8 групп.
Структура периодической системы
Система элементов Менделеева Д.И. слагается из периодов и групп. Периодов в системе – семь, из них три – малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов:
Не гелий(2) – Ne неон(2,8) – Ar аргон(2,8,8) – Kr криптон(2,8,18,8) – Xe ксенон(2,8,18,18,8) – Rn радон(2,8,18,32,18,8).
Из малых периодов первый содержит только водород и гелий, остальные два – по 8 элементов. Из больших периодов – четвертый и пятый – по 18, шестой – 32 и седьмой незаконченный.
Группы объединяют элементы по признаку химического сродства (сходства). Восьмая – инертные газы, а триады содержат только элементы больших периодов. Элементы малых периодов Менделеев называл «типическими». За «типическими» элементами в группах больших периодов следует две подгруппы элементов – основная и побочная.
Существенным недостатком обычного варианта периодической таблицы являлось то обстоятельство, что в нем не была выявлена связь между «типическими» элементами каждой группы и членами её левой и правой подгрупп. Так, например, в V группе Sb является аналогом As, Nb (ниобий) аналогом V (ванадия), а Р (фосфор) – аналогом N (азота). Оставалось неясным, в каком отношении к фосфору стоят V и As. При решении этого вопроса долгое время руководствовались отдельными свойствами элементов. Так, например, к V группе применяли наличие водородных соединений ЭН3, у P и As, но отсутствующую у ванадия. поэтому подгруппу As рассматривали как «главную», а подгруппу V(ванадия) как «побочную», т.к. она не проявляет свойств характерных для типических элементов. Отсюда было неясным само помещение подгруппы ванадия в пятую группу. То же самое было и в других группах. Многим поэтому хотелось перестроить таблицу, что и было предложено Вернером в 1905 г. (см. Некрасова стр.220). В форме периодической системы представленной Бором за основу строение электронных структур нейтральных атомов. Некрасов (стр.223). Эта система была весьма односторонней. Структура атомов может иметь определяющее значение лишь для свойств простых веществ и тех реакций, которые протекают с их участием.
Но для свойств сложных веществ и реакций между ними необходимо учитывать валентные состояния атомов.
Группы I, II, III включают элементы левой части всех периодов, группы V, VI, VII элементы правой части. Элементы, занимающие среднюю часть называются переходными элементами, занимающие левую часть и центр периодической таблицы являются металлами. Элементы, занимающие правую часть – неметаллы. Особенно металлические свойства выражены у элементов, расположенных в нижнем левом углу периодической системы, а неметаллические в верхнем правом углу периодической таблицы. Ту часть таблицы, которая отделяет металлы от неметаллов, занимают элементы с промежуточными свойствами, т.е. от верхней средней точки таблицы к нижнему правому углу. Эти элементы называются металлоидами (Бор, Si, Германий, As, Sb, Теллур и Полоний).
Так выглядит короткая форма периодической системы. Длиннопериодная форма таблицы впервые предложена Д.И.Менделеевым (1869) и в различных вариантах помещалась им в изданиях «Основ химии». Состоит она также из 7 периодов. Они содержат соответственно 2, 8, 8, 18, 18, 32 и 18 элементов. Начиная с 4го периода символы элементов, в атомах которых имеет место одиночный «проскок» электронов, подчеркнуты одной чертой. Это Cr, Cu, Nb, Mo, Ru (рутений), Rh (родий), Pt, Au, с двойным «проскоком» двумя чертами (Z=46. Это Pd[паладий]).
В системе 32 группы аналогов по вертикали. Каждая группа состоит из элементов, атомы которых имеют подобное строение электронных оболочек. Например, в группе (C – Si – Ge – Sn – Pb) атомы элементов на внешнем энергетическом уровне имеют s2p2 электроны. Подобные электронные структуры повторяются через определенные промежутки, а следовательно, повторяются и подобные химические свойства. На основе этого может быть дана новая формулировка закона:
периодическое изменение свойств элементов и их соединений зависит от периодически повторяющейся подобной структуры электронной оболочки их атомов.
Электронные аналоги являются химическими аналогами и обозначаются А и В.
Буквой А обозначены группы тех элементов, в атомах которых заполняются электронами s и p – подуровни внешнего слоя. Это s и p – элементы. Номер А группы совпадает с числом внешних электронов в атомах. Исключение составляют водород и гелий, имеющие 1 и 2 s – электрона, но по совокупности свойств они помещены в VIIA и VIIIA группы. номер группы совпадает также с валентностью элементов в возбужденном состоянии. (кроме F и O)
Группы d – элементов обозначены римскими цифрами с буквой В: IIIB, IVB, VB, VIB, VIIB, VIIIB, IB и IIB, кроме групп Co и Ni. Номер группы также совпадает с числом валентных электронов в возбужденном состоянии. Исключение составляют элементы группы IB для которых номер показывает число внешних электронов, а max их валентность = 3. (Cu, Ag, Au). Только у элементов группы IIB (Zn – Cd – Hg) валентность осуществляется за счет двух s – электронов внешнего уровня. У остальных групп валентность осуществляется не только внешними s – электронами, но и электронами внешнего d – подуровня. Например, Mn – max валентность = 7 за счет двух внешних s и пяти d – электронов 3d54s2. Лантаноиды и актиноиды находятся в длинной форме таблицы в одном периоде и не снесены вниз. Они объединены в одну группу по строению их электронных оболочек. Элементы s, p, d и f выделены различной штриховкой внизу таблицы.
3)
Энергия ионизации Е1 – минимальная энергия, которую требуется затратить на то, чтобы удалить данный электрон с атомной орбитали невозбужденного атома на бесконечно большое расстояние от ядра без сообщения ему кинетической энергии. Энергия ионизации соответствует следующему процессу: Э + ЕI > Э+ + е, где ЕI - кДж / моль. Энергия ионизации количественно характеризует способность атома удерживать электроны, что является важной характеристикой его химической активности. Энергии ионизации возрастает в периоде по мере увеличения порядкового номера элемента. Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшее значение энергии ионизации характерно для инертных газов, находящихся в конце периода.
В группе элементов энергия ионизации уменьшается с повышением порядкового номера элемента. Это обусловлено увеличением размеров атомов и экранированием внешних электронов внутренними.
Сродство к электрону атома ЕА – энергия, которая выделяется (или затрачивается) при присоединении к нейтральному атому электрона с образованием отрицательного иона: Э + е > Э- + ЕА где ЕА - кДж / моль. Сродство к электрону считают положительным, если присоединение электрона сопровождается выделением энергии (ЕА> 0). Если для присоединения электрона нужно затратить энергию, то сродство к электрону считается отрицательным (ЕА<0). Сродство к электрону зависит от электронной структуры атома. Наибольшим сродством к электрону обладают элементы подгрупп 7А (галогены) у большинства металлов и благородных газов сродство к электрону невелико или даже отрицательно. Наименьшее значение сродства к электрону у атомов с заполненными и наполовину заполненными s и р-подуровнями. В подгруппах сверху вниз сродство к электрону атомов уменьшается, но не всегда монотонно. Вследствие экспериментальных трудностей значение сродства к электрону известны не для всех атомов.
4)
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов.
infopedia.su
Валентность | CHEMEGE.RU
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s22s1. Следовательно, валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s22s2. В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s22s12p1. Таким образом, валентность бериллия также равна номеру группы II.
У атома бора электронная конфигурация в возбужденном состоянии: +5B* 1s22s12p2. Следовательно, бор может образовывать 3 связи по обменному механизму ( за счет неспаренных электронов), и еще 1 связь за счет вакантной орбитали на p-подуровне по донорно-акцепторному механизму. Максимальная валентность бора равна IV. Однако чаще мы встречаем валентность бора III. Таким образом, простейший анализ строения внешнего энергетического уровня позволяет определить валентные возможности атома.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s22s12p3, следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может проявлять валентность III (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s22s22p3. За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность атома азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Поделиться ссылкой:
chemege.ru