СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА. Строение электронной оболочки хрома
СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА
План:
1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома:
- принцип Паули;
- принцип наименьшей энергии;
- правило Клечковского;
- правило Гунда.
3. Определения понятий: электронная оболочка, электронное облако, энергетический уровень, энергетический подуровень, электронный слой.
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного хим. элемента. Согласно квантовой теории, каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число – n. Характеризует энергию и размер орбитали и электронного облака; принимает значения целых чисел от 1 до бесконечности (n = 1,2,3,4,5,6…). Орбитали, имеющие одинаковое значение n, близки между собой по энергии и по размеру и образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1-K, 2-L, 3-M, 4-N, 5-O, 6-P, 7-Q). С увеличением порядкового номера энергия и размер орбиталей увеличиваются.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число – l. Характеризует форму орбиталей и облаков; принимает значения целых чисел от 0 до n-l.
| УРОВЕНЬ | ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО - n | ЗНАЧЕНИЕ ПОБОЧНОГО КВАНТОВОГО ЧИСЛА – l |
| K | 0 (s) | |
| L | 0,1 (s,p) | |
| M | 0,1,2 (s,p,d) | |
| N | 0,1,2,3 (s,p,d,f) |
Орбитали, для которых l=0, имеют форму шара (сферы) и называются s-орбиталями. Они имеются на всех энергетических уровнях, причем на К-уровне имеется только s-орбиталь. Схематично изобразите форму s-орбитали:
Орбитали, для которых l=1, имеют форму вытянутой восьмерки и называются р-орбиталями. Они имеются на всех энергетических уровнях, кроме первого (К). Схематично изобразите форму l-орбитали:
Орбитали, для которых l=2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l=3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Es<Ep<Ed<Ef, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантового числа, но отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число – ml. Характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l=0, ml=0, - 1 орбиталь.
p-подуровень: l=1, ml=-1, 0, +1, -3 орбитали
d-подуровень: l=2, ml=-2, -1, 0, +1, +2, - 5 орбиталей.
Таким образом, число орбиталей на подуровне можно вычислить как 2l+1. Общее число орбиталей на одном энергетическом уровне = n2. Общее число электронов на одном энергетическом уровне = 2n2. Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Схематично изобразите квантовые ячейки для разных подуровней и подпишите для каждой из них значение магнитного квантового числа:
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуется тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число, спин (от англ. to spin – кружить, вращать) – ms. Характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: ¯.
Заполнение электронной оболочки атома подчиняется следующим законам:
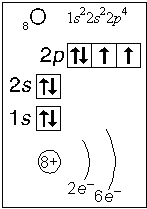
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Составьте наборы квантовых чисел для всех электронов атома кислорода и убедитесь в справедливости принципа Паули:
Принцип наименьшей энергии: Основное (устойчивое) состояние атома – это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Правило Клечковского: Электроны заполняют энергетические подуровни в порядке увеличения их энергии, который определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Правила Гунда: На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Составьте электронно-графические формулы магния, железа и теллура:
Исключения составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10. Составьте электронно-графические формулы атомов хрома и меди:
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы.
Используя вышеперечисленные схемы и формулы, покажите строение атома серы:
ТЕСТ НА ТЕМУ «СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА»
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, - это
| А) магний | Б) углерод | В) сера | Г) цинк |
2. Электронная конфигурация иона Cl+ в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
| А) [Ne] 3s23p5 | Б) [Ne] 3s13p6 | В) [Ne] 3s23p4 | Г) [Ne] 3s23p6 |
3. Элементу второго периода для завершения внешнего уровня не хватает трех электронов. Этот элемент
| А) бор | Б) углерод | В) азот | Г) фосфор |
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
| А) 4d6 | Б) 2s22p4 | В) 3s23p4 | Г) 3s13d5 |
5. Чему равно орбитальное квантовое число 3р электрона?
| А) 1 | Б) 3 | В) 0 | Г) +1/2 |
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
7. Электронную конфигурацию внешнего электронного слоя 3s23p6 имеют соответственно атом и ионы:
| А) Ar, Cl-, S-2 | Б) Kr, K+, Ca+2 | В) Ne, Cl-, Ca+2 | Г) Ar, Cl-, Ca+2 |
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
| А) 2,8,12,2 | Б) 2,8,8,6 | В) 2,8,13,1 | Г) 2,8,14,0 |
10. Ионы О-2 и К+ имеют соответственно следующие электронные формулы:
| А) 1s22s22p4 | Б) 1s22s22p6 | В)1s22s22p63s23p64s0 | Г)1s22s22p63s23p64s1 |
( 1, 7, 10 - по два прав ответа)
Занятие 5:Периодический закон и система химических элементов Д.И.Менделеева. Тест на тему «Периодический закон и система химических элементов Д.И.Менделеева». Задачи на изотопы и упражнения на ядерные реакции.
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
План:
1. История открытия Периодического закона и системы хим. элементов Д.И.Менделеева.
2. Периодический закон в формулировке Д.И.Менделеева.
3. Современная формулировка Периодического закона.
4. Значение Периодического закона и системы хим. элементов Д.И.Менделеева.
5. Периодическая система хим. элементов – графическое отражение Периодического закона. Строение Периодической системы: периоды, группы, подгруппы.
6. Зависимость свойств хим. элементов от строения их атомов.
7. План характеристики химического элемента на основании его положения в ПСХЭ.
1 марта (по новому стилю) 1869 г. считается датой открытия одного из важнейших законов химии – Периодического закона. В середине 19 века было известно уже 63 хим. элемента, возникла потребность в их классификации. Попытки такой классификации предпринимали многие ученые (Одлинг и Ньюлендс, Дюма и Шанкуртуа, Деберейнер и Мейер), но лишь Д.И.Менделееву удалось увидеть определенную закономерность, расположив элементы в порядке возрастания их атомных масс. Эта закономерность носит периодический характер, поэтому Д.И.Менделеев сформулировал открытый им закон следующим образом:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомной массы элемента.
В системе хим. элементов, предложенной Д.И.Менделеевым, был ряд противоречий, которые сам автор Периодического закона устранить не смог. Найдите и запишите 2-3 пары химических элементов, расположение которых в Периодической системе не подчиняется зависимости от величины их атомной массы:
Лишь в начале 20 века после открытия строения атома был объяснен физический смысл Периодического закона и появилась его современная формулировка:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядер их атомов.
Это утверждение подтверждает и наличие изотопов, хим. свойства которых одинаковы, хотя атомные массы различны.
Периодический закон – один из основных законов природы и важнейший закон химии. С открытия этого закона начинается современный этап развития химической науки. Хотя физический смысл Периодического закона стал понятен после создания теории строения атома, сама эта теория развивалась на основе Периодического закона и системы хим. элементов. Закон помогает ученым создавать новые хим. элементы и новые соединения элементов, получать вещества с нужными свойствами. Сам Д.И.Менделеев предсказал существование 12 элементов, которые в то время еще не были открыты, и определил их положение в периодической системе. Свойства трех из этих элементов он подробно описал, и при жизни ученого эти элементы были открыты ("экабор" – галлий, "экаалюминий" – скандий, "экасилиций" – германий). Кроме того, Периодический закон имеет большое философское значение, подтверждая наиболее общие законы развития природы.
Графическим отражением Периодического закона является Периодическая система хим. элементов Д.И.Менделлева. Существует несколько форм Периодической системы (короткая, длинная, лестничная (предложена Н.Бором), спиралеобразная). В России наибольшее распространение получила короткая форма. Современная Периодическая система содержит 110 открытых на сегодняшний день хим. элементов, каждый из которых занимает определенное место и имеет свой порядковый номер. В таблице выделяют горизонтальные ряды – периоды (1-3 – малые, состоят из одного ряда; 4-6 – большие, состоят из двух рядов; 7 период – незавершенный). Кроме периодов выделяют вертикальные ряды – группы, каждая из которых подразделяется на две подгруппы (главную – А и побочную – В). Побочные подгруппы содержат элементы только больших периодов, все они проявляют металлические свойства. Элементы одной подгруппы имеют одинаковое строение внешних электронных оболочек, что обуславливает их схожие хим. свойства.
Дата добавления: 2015-08-26; просмотров: 136 | Нарушение авторских прав
Занятие 1:Основные химические понятия. Тест по теме «Основные химические понятия». Задачи на определение количества вещества по базовым формулам. | Занятие 2: Основные химические законы. Тест по теме «Основные химические законы». Задачи на основные химические законы. | Занятие 6: Химическая связь. Строение вещества. Тест по теме «Химическая связь. Строение вещества». Задачи на газы и газовые смеси. | ГИДРОЛИЗ СОЛЕЙ | РАСТВОРЫ | Диссоциация – обратимый процесс. Параллельно с диссоциацией идет ассоциация – процесс образования молекул из ионов. | С точки зрения ТЭД | Диссоциация воды. Водородный показатель. | Реакции ионного обмена и условия их протекания | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ |mybiblioteka.su - 2015-2018 год. (0.06 сек.)mybiblioteka.su
Строение электронной оболочки атома
Основные положения атомно-молекулярной теории. Основные стехиометрические законы химии. Законы сохранения массы вещества, постоянства состава, объемных отношений, Авогадро, эквивалентов. Молярная масса эквивалента. Способы определения атомных и молекулярных масс.
Все веществ состоят из молекул.
Молекула — это наименьшая частица вещества, сохраняющая свойства тогo вещества. Молекулы разрушаются при химических реакциях.
Между молекулами имеются промежутки: у газов - самые большие, у твердых веществ — самые маленькие.
Молекулы двигаются беспорядочно и непрерывно.
Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от. друга по составу и свойствам.
Молекулы состоят из атомов.
Атом - это электронейтральная частица, состоящая из положительно заряженного ядра и электронов.
Химический элемент - вид атомов с одинаковым положительным зарядом ядра.
Атомы одного элемента образуют молекулы простого вещества (02, Н2, О3, Fe...). Атомы разных элементов образуют молекулы сложного вещества (Н20, Na2S04, FeClg...).
Закон сохранения массы
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
ученым М.В. Ломоносовым.Закон постоянства состава
Всякое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения.
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.Закон эквивалентов
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Закон кратных отношений
Кратных отношений закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Закон объемных отношений
Гей-Люссак, 1808 г.
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1:V2:V3 = ν1:ν2:ν3.
Периодический закон и периодическая система элементов Д.И.Менделеева. Основные представления о строении атома и ядра. Периодически изменяющиеся и периодически неизменяющиеся свойства атомов и ионов. Варианты периодической таблицы.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на:
s- элементы (элементы главной подгруппы I и II групп),
p- элементы (элементы главных подгрупп III - VII групп),
d- элементы (элементы побочных подгрупп),
f- элементы (лантаноиды, актиноиды).
Состав атома.
Атом состоит из атомного ядра и электронной оболочки. Ядро атома состоит из протонов (p+) и нейтронов (n0).
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N.
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A:
Ядра химических элементов обозначают символом 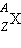 , где X – химический символ элемента. Например,
, где X – химический символ элемента. Например, – водород,
– водород, 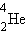 – гелий,
– гелий, 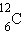 – углерод,
– углерод, 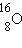 – кислород,
– кислород,  – уран.
– уран.
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.Обозначение отдельного атома или изотопа: 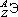 (Э - символ элемента), например:
(Э - символ элемента), например: 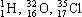 .
.
Строение электронной оболочки атома
Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали -  . Каждой орбитали соответствует электронное облако.Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и fОднотипные орбитали одного уровня группируются в электронные (энергетические) подуровни: s-подуровень (состоит из одной s-орбитали), условное обозначение -
. Каждой орбитали соответствует электронное облако.Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и fОднотипные орбитали одного уровня группируются в электронные (энергетические) подуровни: s-подуровень (состоит из одной s-орбитали), условное обозначение -  .p-подуровень (состоит из трех p-орбиталей), условное обозначение -
.p-подуровень (состоит из трех p-орбиталей), условное обозначение - 

 .d-подуровень (состоит из пяти d-орбиталей), условное обозначение -
.d-подуровень (состоит из пяти d-орбиталей), условное обозначение - 



 .f-подуровень (состоит из семи f-орбиталей), условное обозначение -
.f-подуровень (состоит из семи f-орбиталей), условное обозначение - 





 .Энергии орбиталей одного подуровня одинаковы.При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2. Обозначения:
.Энергии орбиталей одного подуровня одинаковы.При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2. Обозначения:  - свободная орбиталь (без электронов),
- свободная орбиталь (без электронов),  - орбиталь с неспаренным электроном,
- орбиталь с неспаренным электроном, 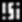 - орбиталь с электронной парой (с двумя электронами).Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей.2. Принцип Паули - на одной орбитали не может быть больше двух электронов.3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.Общее число электронов на электронном уровне (или в электронном слое) равно 2n2.Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
- орбиталь с электронной парой (с двумя электронами).Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей.2. Принцип Паули - на одной орбитали не может быть больше двух электронов.3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.Общее число электронов на электронном уровне (или в электронном слое) равно 2n2.Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ...
Примеры электронного строения атомов:
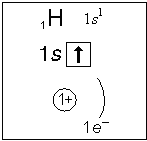

Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних.
Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6.
studopedya.ru
Оболочки электронные, строение - Справочник химика 21
Рассмотрим теперь изменение энергий ионизации во втором периоде. Элементы этого периода имеют следующие величины /4 (эВ) 5,39(Ь1) 9,32(Ве) 8,30(В) ]1.26(С) 14,53(Н) 13,61(0) 17.42(Р) 21,5б(Не). Таким образом, при переходе от Ь к Не происходит возрастание энергии ионизации. Это объясняется увеличением заряда ядра (число электронных слоев при этом остается одним и тем же). Однако, как видно из приведенных данных, возрастание /1 происходит неравномерно у следующих за бериллием и азотом бора и кислорода наблюдается даже некоторое уменьшение / 4. Эта закономерность вытекает из особенностей электронного строения. У бериллия, имеющего конфигурацию 15 252, внешняя 5-оболочка заполнена, поэтому у следующего за ним бора, электрон поступает в / -оболочку /7-электрон менее прочно связан с ядром, чем 5-электрон, поэтому первая энергия ионизации у бора меньше, чем у бериллия. Строение внешнего электронного слоя атома азота в соответствии с правилом Хунда выражается схемой [c.76] Германий, олово и свинец относят к главной подгруппе IV группы периодической системы элементов Менделеева. Строение их внешних электронных оболочек аналогично строению электронных обо- [c.184]Элементы побочной подгруппы III группы скандий 8с, иттрий У, и лантан Ьа относятся к редким и рассеянным металлам. До недавнего времени они не находили широкого применения. По электронному строению они относятся к переходным металлам, поскольку содержат на внешней оболочке один ( -электрон, однако по свойствам напоминают скорее щелочноземельные металлы. Все они сильно электроположительны и практически всегда проявляют одну степень окисления +3. Щелочные свойства гидроксидов этих металлов усиливаются от скандия к лантану (гидроксид лантана — сильное основание). [c.153]
Побочную группу VI группы периодической системы д. И. Менделеева образуют переходные металлы хром Сг, молибден Мо, вольфрам W. Электронное строение атомов этих элементов характеризуется наличием незаполненной -оболочки, причем атомы хрома и молибдена имеют неспарепные s-электроны, а атом вольфрама содержит пару (6s ) электронов [c.210]
Хром Ст значительно отличается от титана и ванадия по электронному строению и свойствам. Это объясняется тем, что предыдущие переходные элементы содержат заполненную внешнюю 3-оболочку, в то время как у атома хрома в основном состоянии всего один 48-электрон. Электронное строение хрома (конфигурация Зd 4s ) обусловлено устойчивостью наполовину заполненной [c.154]
Поляризующее действие ионов тоже зависит от электронного строения, заряда и радиуса. Оно тем значительнее, чем больше заряд, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те [c.119]
Такие свойства элементов, как радиусы атомов, энергии ионизации, сродство к электрону, электроотрицательность, степень окисления зависят в первую очередь от строения наружных электронных оболочек, следовательно, периодическое изменение электронного строения атомов определяет периодичность изменения этих свойств. В этом заключается физический смысл периодического закона Д. И. Менделеева. [c.49]
После заполнения Зd-пoдypoвня (п = 3, / = 2) электроны, в соответствии со вторым правилом Клечковского, занимают подуровень 4р (п = 4, / = 1), возобновляя тем самым построение Л -слоя. Этот процесс начинается у атома галлия (2 = 31) и заканчивается у атома криптона Е = 36), электронное строение которого выражается формулой 1з 2з 2р 38 Зр Зс °4з Ар . Как и атомы предшествующих благородных газов — неона и аргона, атом криптона характеризуется структурой внешней электронной оболочки пз пр , где тг — главное квантовое число (неон — 2з 2р , аргон — 3в23р , криптон — Аз Ар ). [c.68]
Строение внешних электронных оболочек атомов Th 6d 7s и 5f 6d 7s Pu 5/ 7s2. Таким образом, в атоме Ри происходит провал на 5/-оболочку -электрона. [c.608]
Известны соединения меди в степенях окисления +1, +2 и +3. Последние, однако, малочисленны и ограничиваются простми и сложными оксидами и фторидами. Гораздо более распространены соединения меди (I) и меди (II). Соединения одновалентной меди менее устойчивы и похожи на аналогичные соединения серебра и золота (I). Соли двухвалентной меди по свойствам гораздо ближе к солям других двухзарядпых катионов переходных металлов. Эти особенности меди неразрывно связаны с ее электронным строением. Основное состояние атома меди 3химических соединениях проявляются в одинаковой мере оба состояния, дающие начало двум рядам соединений меди (I) и (II). [c.159]
I. Заполнение электронных слоев и оболочек. Рассмотрим связь между электронным строением атомов и положением элементов в периодической системе. Электронное строение атомов представлено в табл. 7. [c.66]
Предлагаемый в данной работе подход относится к феноменологическим, т.к. система, поглощающая излучение, рассматривается как единое целое, а переходы электронов с одного уровня на другой во внимание не принимаются. Такое необычное направление в электронной спектроскопии определено нами, как электронная феноменологическая спектроскопия (ЭФС). Вещество изучается как единое целое, без разделения его спектра на характеристические частоты или длины волн отдельных функциональных групп или компонентов системы. Известно, что электронное строение веществ определяет его физико-химические свойства [5]. В свою очередь, электронные спектры также определяются конфигурацией электронных оболочек. Отсюда следует, что электронные спектры поглощения могут быть применены для определения физико-химических свойств. [c.84]
Другая общая особенность электронного строения i- и р-элементов состоит в том. что после отделения электронов внешнего слоя остается ион, имеющий конфигурацию атома благородного газа li или ns np -, для р-злементов четвертого и следующих периодов образуется ион, имеющий 18-ти электронную оболочку У таких ионов не проявляются специфи- [c.316]
Используемое ныне в научной литературе выражение "превращение химических элементов" некорректно. Оно подменяет конкретный объект превращения (атом), неопределенным понятием (химический эле.мент). Недостатком формулировки закона радиоактивных смещений (правильнее превращений ) является то, что она не выделяет подвиды атомов как объект превращения. Она, по-прежнему, "вяжет" их к смещениям в Периодической системе. Возникает принципиальное несоответствие между законом и наглядной его иллюстрацией. Периодическая система химических элементов имеет в основе своей структуры устройство электронной оболочки атомов. Строение ядра имеет здесь лишь опосредованное значение через равенство Ерц. = 1 . Закон же радиоактивных превращений касается исключительно ядерных преобразований и индифферентен (в рамках данных рассмотрений ) к структуре электронной оболочки. И в этом аспекте рассмотрения система атомов идентична системе ядер. Мы как бы на время, игнорируем присутствие электронной оболочки. [c.102]
Однако между металлами главных и побочных подгрупп есть и существенные различия. Они также связаны с особенностями электронного строения переходных элементов, а именно с тем, что во второй снаружи электронной оболочке имеется занятый электронами -подуровень. Для образования химических связей атомы переходных элементов могут использовать не только внешние электроны (как это имеет место у элементов главных подгрупп), но также -электроны и свободные -орбитали предшествующей оболочки. Поэтому для переходных элементов значительно более характерна переменная валентность, чем для металлов главных подгрупп. Возможность создания химических связей с участием -электронов и свободных -орбиталей обусловливает и ярко выраженную способность переходных элементов к образованию устойчивых комплексных соединений. С этим же связана характерная окраска многих соединений переходных элементов, тогда как соединения металлов главных подгрупп в большинстве случаев бесцветны. [c.496]
Заполнение электронных слоев и оболочек. Рассмотрим связь между электронным строением атомов в основном состоянии и положением элементов в периодической системе. [c.42]
В данной главе будет рассмотрен простой метод описания ковалентных связей с использованием структурных схем Льюиса. Мы занищем льюисовы структуры для известных молекул и ионов и дадим им объяснение, пользуясь представлениями об обобществлении электронных пар и построении замкнутых валентных оболочек такого типа, как у атомов благородных газов. Затем мы объясним степени окисления атомов в соединениях на основе соображений о неравномерности обобществления электронных пар атомами, обладающими разной электроотрицательностью, после чего перейдем к установлению взаимосвязи между кислотностью некоторых молекул и электронным строением их центрального атома. В последней части главы будет показано, как для предсказания формы молекул используется метод отталкивания валентных электронных пар (ОВЭП). [c.465]
Группа галогенов с электронным строением ns -np проявляет степени окисления (в порядке уменьшения важности) —I, +V, +VII, +1 и +III. Так как атому фтора не достает только одного электрона для формирования оболочки атома инертного газа и, кроме того, его размер мал, то фтор проявляет исключительно степень окисления —1. Тенденцию к формированию оболочки атома инертного газа проявляют все галогены, поэтому для них всех характерна степень окисления —I. [c.130]
Сделать общий вывод о влиянии радиуса, заряда и электронного строения внешней оболочки ионов на характер диссоциации гидроксидов. [c.57]
Электронное строение изолированного атома (наружные электрон ные оболочки) [c.112]
Для натрия характерно образование устойчивого иона Ыа , обладающего электронным строением предшествующего ему благородного газа неона. У иона же хлора строение внешней оболочки соответствует конфигурации благородного газа аргона. [c.72]
Сопоставление рис. ХП.2 и ХП.З показывает, что электронное строение внешней оболочки атомов элементов следующих за неоном в точности повторяет строение атомов, предшествующих ему, т. е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
Другим важным свойством, также определяемым электронным строением наружных оболочек, является сродство к электрону (СЭ). Атомы могут не только отдавать электрон, но и присоединять, что может быть представлено уравнением [c.52]
Учебник состоит из двух частей. В первой части рассмотрены теоретические основы неорганической химии, начиная с законов и понятий стехиометрии, что позволяет уже на первых занятиях производить количественные расчеты. Строение веществ описывается поэтапно — от ядер атомов и электронных оболочек до строения молекул, кристаллов и комплексных соединений. Превращения веществ при протекании различных процессов растворения, диссо- циации, реакций ионного обмена и окислительно-восстановительных — объяснены с позиций термодинамики. [c.3]
Составьте таблицу строения электронных оболочек атомов элементов первых трех рядов Периодической системы элементов Д. И. Менделеева. Какова связь между электронным строением и положением элемента в Периодической системе [c.8]
Строение внешних электронных оболочек атомов большинства Ln 4f"6s . Таким образом, у большинства лантаноидов происходит провал имеюпгегося у La -электрона на оболочку 4/. Этого провала нет только у Gd (конфигурация 4f 5d 6s ) и у Lu (конфигурация 4f 5d 6s ) формирование 4/оболочки заканчивается на Yb. Наличие конфигурации Р и f у пар элементов соответственно Ей, Gd и Yb, Lu обусловлено устойчивостью этих конфигураций, отвечающих укомплектованию 4/ -оболочки электронами наполовину и полностью. [c.604]
Решение. При одинаковых зарядах и размерах ионов Na и Си+ различие в их поляризующем действии определяется особенностями нх электронного строения. Ион Си+ имеет 18-элск-тронную внешнюю оболочку н более сильно поляризует анион С1 , чем ион N3+, обладающий благородногазовой электронной структурой. Поэтому в хлориде меди(1) в результате поляриза- [c.68]
Если в -оболочке могут быть только два электрона (с нротИ воположными спинами), то уже в р-оболочке их число может достигнуть шести. Поэтому возникает вопрос, каким образом ори- ентированы сп4]ны электронов. Так, для атома азота конфигурации )525 2р (2 электрона в первом слое, 5 — во втором) отвечают два возможных варианта электронного строения [c.29]
Заполнение электронных слоев и оболочек. Рассмотрим связь между электронным строением атомов в нормальном состоянии и положением элементов в пернодической системе. Электронное строение атомов представлено в таблице, напечатанной на форзаце. Приведенные данные об электронном строении атомов получены в результате исследования атомных спектров. [c.39]
Для идентификации многокомпонентных органических систем обычно используется сочетание нескольких методов, например, фракционирование методов ЯМР-, УФ-, ИК -спектроскопии и хроматографии, масспектрометрии [11,12] Существенным недостатком известных методик является трудоемкость, длительность и неоднозначность результатов анализа. До последнего времени применению методов электронной абсорбционной спектроскопии препятствовало отсутствие теории электронных спектров таких систем, главным образом из- за их сложности ( рис 4 1). Для исследования таких объектов требуются новые методы. Предлагаемый в данной работе подход относится к ( ю-номенологическим методам, т к. система, поглощающая излучение, рассматривается как единое целое, а максимумы спектров и электронные переходы во внимание не принимаются. Такое необычное направление в электронной спектроскопии определено нами, как электронная феноменологическая спектроскопия (ЭФС). Вещество изучаегся как единое це юе, без разделения его спектра на характеристические частоты или длины волн отдельных функциональных групп или компонентов системы. Известно, что электронное строение веществ определяет его физико-химические свойства [13]. В свою очередь, электронные спектры также определяются конфигурацией электронных оболочек [14]. [c.64]
Такие понятия, как конфигурация и терм, являются характеристиками электронного строения молекулы, они неприменимы в строгом смысле к описанию состояния отдельных атомов в составе молекулы. Тем не менее с использованием соображений симметрии удается для некоторых молекул установить примерное строение электронной оболочки атома в составе молекулы. Хорошо известным примером в этом отношении может служить молекула метана, в которой, как это впервые показал Л. Полинг, эффективная конфигурация атома углерода есть Этот вопрос обсуждается, как правило, в литературе весьма подробно, см. [17], [8], [12], [20]. Рассмотрим подобную задачу на примере более сложной системы — комплекса №Уг, где в качестве У может быть взят атом кислорода. Симметрия комплекса предполагается Сзу Атомы переходных элементов имеют малую энергию возбуждения. Для атома N1 (см. гл. 3, 6) разность полных энергий АЕ = Е Зс 4х) — ( F, 3 4х ) составляет всего лишь 205 см" = 0,03 зВ. При столь незначительной величине АЕ орбитальные энергии 4s и Зй -злект-ронов претерпевают тем не менее существенные изменения. Например, для основного в конфигурации с F-тepмa = -0,70693, 45 = = -0,27624, в то время как для терма -0,45730 и = -0,23576. [c.218]
ВАЛЕНТНОСТЬ (лат. Уа1епз — I моющий силу) — способность атомов химических элементов образовывать химические связи с атомами других элементов. С точки зрения электронного строения атомов В. — это способность атомов или атомных группировок отдавать или присоединять в каждом отдельном случае определенное количество электронов с образованием эквивалентного количества химических связей. В соединениях с ионной связью В. определяется числом присоединенных (отрицательная В.) или отданных (положительная В.) электронов. В соединениях с ковалентной связью В. атомов определяется числом электронов, принимающих участие в образовании общих электронных пар. В. элемента зависит от строения внешних электронных оболочек атомов. [c.51]
Свойства и получение. Внешняя электронная оболочка атома углерода в основном и возбужденном состоянии имеет строение 2s 2p и s2pxPfPi. Таким образом, в валентном состоянии атом углерода имеет четыре неспарениых электрона и во внешнем электронном слое отсутствуют как свободные атомные орбитали, так и неподеленные электронные пары (только для одного элемента, кроме углерода, - водорода характерно подобное состояние атома). Такое электронное строение атома углерода обусловливает две характерных его особенности возможность образовывать четыре ковалентные связи и неспособность к донорно-акцепторному взаимодействию. [c.363]
Строение внешних электронных оболочек атомов большинства Ln 4/"6г . Таким образом, у этих элементов происходит провал имеющегося у La (/-электрона на о лочку 4/. Этого провала нет только у Gd (конфигурация 4/ 5rf 6i ) и у Lu (конфигурация 4/ 5rf 6i ) ( юрмирование 4/-оболочки заканчивается на Yb. Конфигурации и / у пар элементов соответственно Ей, d и Yb, Lu, отвечающих укомплектованию 4/-оболочки электронами наполовину и полностью, обеспечивает устойчивость атомных (Л руктур. [c.571]
Таким образом, важнейшим фактором, играюш,им роль в формировании того или иного типа решетки кристалла, является взаимодействие атомов, обусловленное электронным строением их внешних оболочек. Чем меньше координационное число, тем больше доля пустот между атомами решетки, тем меньше степень компактности их упаковки. Коэффициент упаковки атомов одинакового химического сорта, имитированных равновеликими шарами, вычисляют по формуле [c.169]
С другой стороны, радиусы атомов и ионов определяются строением электронных оболочек. Поэтому геометрия кристалла и его поверхностп определяется также электронными факторами. Поняте интерес к исследованиям электронных свойств катализаторов и установлению связи между электронным строением и каталитической способностью твердых тел. [c.146]
chem21.info











