1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов. Положение хрома в периодической системе
1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной.
Cr24 1s22s22p63s23p64s13d5
Для атома хрома электроно-графическая формула выглядит так:
Это явление называется проскок (провал) электрона.
В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Cu29 1s22s22p63s23p64s13d10
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений.
d-элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды
2Сr + 3Н2O Сr2О3 + 3Н2
и с галогенами, образуя галогениды состава СrГ3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти кислоты растворяют хром:
2Сr + 6Н2SО4(конц) = Сr2(SО4)3 + 3SО2↑ + 6Н2О,
Сr + 6НNО3(конц) = Сr(NО3)3 + 3NO2↑ + 3Н2О.
При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя соли Сr2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II):
СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
Сr2(SО4)3 + 6 NaОН = 2 Сr(ОН)3↓ + 3 Na2SО4,
обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III)
2 Сr(ОН)3 + 3 Н2SО4 = Сr2(SО4)3 + 6 Н2О,
так и в щелочах с образованием комплексной соли
Сr(ОН)3 + 3КОН = К3[Cr(ОН)6].
Наиболее важными соединениями хрома в высшей степени окисления +6 хромат калия К2СrО4 и дихромат калия К2Сr2О7.
Железо
На воздухе в присутствии влаги ржавеет:
4Fе + 3O2 + 6Н2О = 4Fе(ОН)3.
С галогенами оно образует галогениды железа (III)
2Fе + 3Вr2 = 2FеВr3,
а взаимодействуя с соляной и разбавленной серной кислотами соли железа(II), так как катион водорода Н+ является слабым окислителем:
Fе + Н2SО4 = FеSО4 + Н2↑.
Концентрированные (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании:
2Fе + 6Н2SО4(конц) = Fе2(SО4)3 + 3SО2↑ + 6Н2О,
Fе + 6НNО3(конц) = Fе(NО3)3 + 3NО2↑ + 3Н2О.
Медь – довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют ее из растворов солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах – окислителях:
Сu + 2 Н2SО4(конц) = СuSО4 + SО2↑ + 2 Н2О,
Сu + 4 НNO3(конц) = Сu(NО3)2 + 2 NО2↑ + 2 Н2О,
3 Cu + 8 НNО3(разб) = 3 Сu(NO3)2 + 2 NO↑ + 4 Н2О.
Известны соединения меди со степенями окисления +1 и +2, из которых +2 более устойчива.
Ионы Сu2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Сu(Н2О)6]2+, придающих раствору сине-голубую окраску.
Основная соль меди – медный купорос CuSO4.5h3O голубого цвета, но при прокаливании теряет воду и становится белого цвета, т.е. окраску раствору придает комплексный ион. Более точное строение медного купороса [Cu(h3O)4]SO4 h3O.
Цинк амфотерный металл. Валентные электроны атома цинка 4s23d10. Так как все d-орбитали у цинка заполнены электронами, все его соли бесцветны. Это объясняется теорией кристаллического поля лигандов. В соединениях проявляет только одну степень окисления +2.
Взаимодействует с кислотами:
Zn + 2HCl = ZnCl2 + h3
Zn + h3SO4(разб) = ZnSO4 + h3
Zn + 2h3SO4(конц) = ZnSO4 + SO2 + 2h3O
4Zn+10HNO3(разб)=4Zn(NO3)2+Nh5NO3+3h3O.
Zn + 4HNO3(конц) = Zn(NO3)2 + 2NO2 + 2h3O
Взаимодействует со щелочами: реагирует с растворами щелочей с образованием гидроксокомплексов, при сплавлении образует цинкаты:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3
Zn + 2KOH = K2ZnO2 + h3
studfiles.net
1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Отличительной особенностью металлов, находящихся в I-III группах главных подгруппах является дефицит валентных электронов.
В IА группе находятся щелочные металлы, они имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями.
Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Согласно положению этих элементов в Периодической системе изменение их свойств представлено на рисунке.
По группе сверху вниз увеличиваются радиусы атомов за счет увеличения число электронных слоев. Уменьшается энергия ионизации (легкость отрыва электрона от атома), что соответствует увеличению восстановительных, а значит и металлических свойств.
Химические свойства щелочных металлов кратко можно представить в таблице.
Щелочные металлы активно реагируют с кислородом с образованием оксидов, пероксидов и надпероксидов. С серой при нагревании образуют сульфиды, с водородом – гидриды, с галогенами – галогениды.
Очень активно взаимодействуют с водой, часто с воспламенением выделяющегося водорода.
Атомы элементов IIА группе имеют на внешнем электронном уровне два s‑электрона: ns2.
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
Металлы этой подгруппы менее активны, чем металлы IА группы. Бериллий является амфотерным металлом, магний образует основание – слабый электролит, а кальций, стронций и барий образуют щелочи.
Это активные металлы являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
Амфотерность бериллия проявляется в том, что он взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2h3O = Na2[Be(OH)4] + h3.
Остальные металлы II группы со щелочами не реагируют.
В IIIА группе находятся бор (В), алюминий (Al), галлий (Ga), индий (In), таллий (Tl).
В этой подгруппе особенной ярко проявляется изменение кислотно-основных свойств по подгруппе сверху вниз от кислотных до основных. Если соединения бора обладают кислотными свойствами, алюминий, галлий и индий – амфотерными, то соединения таллия – основными.
На внешнем энергетическом уровне алюминия имеются свободные р‑орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.
Общим для элементов этих групп является то, что они характеризуются небольшим (1-3) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства.
studfiles.net
Медь
^ В сухом воздухе медь практически не окисляется, с водой не взаимодействует и является довольно инертным металлом.
Способы получения меди1) Гидрометаллургические методы получения меди основаны на селективном растворении медных минералов в разбавленных растворах серной кислоты или аммиака, из полученных растворов медь вытесняют металлическим железом: CuSO4 + Fe = Cu + FeSO4.2) Электролизом получают чистую медь: 2CuSO4 + 2h3O-(эл.ток)2Cu + O2 + 2h3SO4. Оксид и гидроксид меди (II)
Цинк
^ Амфотерный металл.
^ пирометаллургический метод.1) Обжиг сульфида цинка: 2ZnS + 3O2 = 2ZnO + 2SO2 2) Восстановление коксом: ZnO + C –(t)à Zn + CO. Оксид цинка (II) ZnO – белые кристаллы. Амфотерный оксид.
Получение: 1) при горении металлического цинка: 2Zn + O2 = 2ZnO; 2) при термическом разложении солей: ZnCO3–(t)àZnO + CO2.Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Амфотерный гидроксид.
ZnCl2 + 2NaOH(недост) = Zn(OH)2 + 2NaCl. Хром
Химические свойства хрома
Способы получения хрома.
Соединения хрома. Соединения хрома (II) проявляют преимущественно основные свойства, хрома (III) – амфотерные, соединения хрома (VI) – кислотные.
Соединения хрома (II)
Cоединения хрома (III). У хрома степень окисления +3 является наиболее устойчивой.
Соединения хрома (VI)
Железо.
^
Соединения железа (II). Соединения железа со степень окисления железа +2 малоустойчивы и легко окисляются до производных железа (III).
Соединения железа (III). Степень окисления +3 – устойчивая и наиболее характерна для железа.
осадок синего цвета Качественная реакция на катион Fe3+ – взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl осадок синего цвета | ||
dopoln.ru
Периодическая хрома - Справочник химика 21
Характер взаимодействия титана и его аналогов с металлами зависит от положения последних в периодической системе. Так, с близкими к нему по свойствам хромом и ванадием титан образует непрерывный ряд твердых растворов замещения [c.532]Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним Q периодической системе (подгрупп железа, титан,1 и хрома), образуют металлические твердые растворы. По мере /величения различий в электронно.м строении взаимодействую- [c.541]
В табл. П-13 приведено расчетное равновесие между -бутаном, м-бутенами и 1,3-бутадиеном при различных температурах и 1,0 и 0,167 атмосферах давления. Из-за сопровождающих дегидрирование реакций крекинга образуется некоторое количество углерода, которое необходимо периодически удалять с катализатора. Это производится при помощи выжигания воздухом. Сообщают, что образование кокса увеличивается с молекулярным весом исходных олефинов, но данные табл. П-14 наводят на мысль, что и время контакта играет важную роль. Эти цифры были получены в опытах нри давлении 0,25 ати над катализатором, содержащим 4% хрома на алюминии. [c.101]В роли металлорганической компоненты катализатора вместо органических производных элементов I—IV групп периодической системы могут также быть использованы я-аллильные комплексы переходных металлов (циркония, хрома, никеля) [53]. [c.214]
На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы Почему нх помещают в разных подгруппах [c.45]
Обосновать размещение хрома, молибдена и вольфрама в VI группе периодической системы. В чем проявляется сходство этих элементов с элементами главной подгруппы [c.248]
Промышленные катализаторы гидрирования представляют собой высокодисперсные металлы, обычно нанесенные на пористые носители. Высокой гидрирующей активностью отличаются металлы УП1 и I групп периодической системы элементов (никель, кобальт, платина, палладий, родий, медь и др.). В качестве носителей этих металлов наиболее часто используются окиси алюминия, кремния, цинка, хрома, активный уголь, диатомиты. Находят применение в промышленности и сплавные катализаторы [46, 55]. Готовят катализаторы пропиткой носителя растворами легкоразлагающихся соединений активного металла или же методом их совместного осаждения с носителем [56]. Как правило, перед использованием в процессе катализаторы предварительно восстанавливают. [c.411]
Пиролиз бутана. Реакции дегидрогенизации нормального бутана могут идти до бутадиена, а могут быть оборваны на оптимальном продукте — бутенах. Реакции эндотермичны, хорошо активируются окислами хрома и поддерживаются окисью алюминия при температурах, превышающих 540 °С, и манометрическом давлении 7—140 кПа. Пар требуется для минимизации образования углерода. Процесс периодический. В паровой фазе бутан и пар проходят над катализатором, температура снижается, а углерод [c.38]
В литературе опубликованы также данные о конверсии н-гептана в толуол [18]. Процесс проводили при 490° и атмосферном давлении с объемной скоростью около 0,3 час. . Катализатор состоял из окиси хрома, нанесенной в количестве 10% на окись алюминия, и содержал промоторы — небольшие примеси двуокиси церия и едкого кали [19]. Конверсия в толуол могла за некоторый промежуток времени достигать 80%. Однако в среднем количество превращенного н-гептана за один проход равнялось 40%. Выход толуола составлял 80—90%, считая на прореагировавший н-гептан. Из продуктов реакции толуол мог быть выделен любым из физических методов, описанных выше в этой главе. В результате образования углеродистых отложений катализатор медленно терял свою активность и требовал периодической регенерации. На большую легкость ароматизации нафтенов по сравнению с парафинами указывают два обстоятельства. Во-первых, следы сульфат-иона отравляют реакцию ароматизации парафинов, но не влияют на ароматизацию нафтенов. Во-вторых, отношение рабочего времени ко времени, затраченному на регенерацию, при ароматизации нафтенов равно 20 1, а в случае парафинов — только 6 1. [c.252]
Фирмой Филлипс (США) предложен новый катализатор ионной полимеризации этил( на, в присутствии которого процесс можно осуществлять также при низких давлениях. В качестве катализатора применена 01>ись хрома, нанесенная на алюмосиликат. При 132° и давлении 30 ат. полимеризация закапчивается за 4 часа. Периодически катализатор регенерируют путем продувки воздухом при 450--500°. Молекулярный вес полимера можно регулировать, изменяя температуру полимеризации. При 110° средний молекулярный вес полимера составляет 100 000 при 170°—снижается до 23 ООО. С повышением давления средний молекулярный вес полиэтилена возрастает. [c.196]
Титан и его сплавы хорошо обрабатываются давлением всеми известными способами ковкой, прокаткой, штамповкой и др. Титан обладает высокой температурой плавления 1670°С, что определяет возможность разработки жаропрочных сплавов на его основе. Малый коэффициент линейного расширения обеспечивает надежность использования титана в условиях периодического изменения теплового состояния. Однако он неудовлетворительно работает при трении из-за его склонности к задиранию и заеданию. Значительного повышения износостойкости титана и его сплавов удалось достигнуть комплексным насыщением хромом и кремнием парофазным методом [11]. При этом повысилась износостойкость титана более чем в 3—5 раза, а коэффициент трения [c.66]
Кроме бериллия, электролизом расплавленных солей можно получать и другие тугоплавкие металлы (скандий, иттрий, титан, цирконий, гафний, торий, ванадий, ниобий, тантал, хром, молибден, вольфрам и рений). Все они являются элементами переходных групп периодической системы, для которых характерно образование катионов нескольких валентностей. [c.530]
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним в периодической системе (подгрупп железа, титана и хрома), образуют металлические твердые растворы. По мере увеличения различий в электронном строении взаимодействующих металлов возможность образования твердых растворов уменьшается [c.438]
В соответствии с положением в Периодической системе напишите формулы высших окислов следующих элементов бора, хрома, вольфрама, марганца, ванадия, урана. [c.140]
Один из окислов хрома содержит 30,38% кислорода. Соответствует ли валентность хрома в этом соединении его положению в периодической системе [c.149]
Координационное число металла при образовании ОЦК решетки равно восьми. Такая решетка, как уже говорилось, свойственна, например, металлическому натрию, железу при температуре до 911 °С. Атом натрия имеет один электрон на внешней электронной оболочке, с помощью которого он образует металлическую связь с другими атомами. В то же время остальные его валентные орбитали являются вакантными. Избыток числа орбиталей над числом электронов приводит к образованию такой структуры, когда каждый атом натрия создает у себя устойчивую восьми-электронную оболочку благородных газов, отстоящих как слева (N6), так и справа (Аг) от натрия в периодической системе. Это достигается при количестве ближайших атомов в кристаллической решетке (координационном числе) равном восьми. Аналогично, атом хрома в основном [c.320]
У следующих за хромом элементов (см. периодическую систему) на — 5-подуровнях в соответствии с принципом Паули размещается по второму электрону. У 2п — -подуровни заполнены полностью (Зс( 45 ) [c.65]
В побочную подгруппу шестой группы периодической системы входят хром Сг, молибден Мо и вольфрам У. У атомов хрома и молибдена вследствие особой устойчивости наполовину заполненного -подуровня (й ) валентные электроны (л—1)с1 п5 [c.376]
Железо находится в третьем периоде побочной подгруппы Vni группы периодической системы и, как хром, относится к -элементам. [c.277]
Настоящая книга представляет собой учебник по второй, специализированной, части курса для студентов строительных институтов и факультетов. Примерно половина ее (главы И, П1, IV) посвящена неорганической химии, причем в соответствии с программой внимание сосредоточено здесь на элементах и соединениях, представляющих интерес для строительного дела. Выделены для более подробного рассмотрения лишь следующие элементы ( и их соединения) магний, кальций, алюминий, углерод, кремний и менее подробно хром, марганец железо и никель. Остальные элементы рассматриваются лишь в общих обзорах по группам периодической системы. [c.3]
Катализатор содержит 15—30 мас.% закиси никеля, каолинито-вую глину, портланд-цемент, цемент (гидравлический, циркониевый или магнезиальный), 12—30 мае. % окиси магния и окиси других металлов второй группы периодической системы, 1—5 мас.% промотирующих окислов хрома или алюминия. Прочность катализатора повышается добавкой материала с игольчатой микроструктурой, а пористость — добавкой древесного угля, крахмала, ме-тилцеллюлозы, газовой сажи, смолистых веществ. Второй способ позволяет получить более прочный катализатор. Применяют при разложении углеводородов с целью получения водорода [c.59]
НИИ и температуре свыше 300° С. Обычно применяются температуры порядка 450—550° С. В качестве катализаторов используются металлы и окиси металлов IV, V и VI групп периодической таблицы, чаще всего базирующиеся на алюминии. Наиболее эффективны окиси хрома и ванадия, окись церия несколько уступает им, а окись тория хотя и проводит дегидрирование, но ароматизирует уже слабо [278, 283]. Были опробованы также никель на алюминии [275], нлатинизированный углерод [284, 285], окиси цинка, титана и молибдена, сульфид молибдена, активированный древесный уголь [279] и хлорид алюминия (металлический алюминий плюс хлористый водород) [286]. [c.103]
Феррофосфор, собирающийся под шлаком и периодически выпускаемый из печи, представляет собой сплав фосф Идов железа РегР и РеР с незначительной примесью фосфидо1в других металлов (марганца, хрома и др.). Он содержит 15—28% фосфора, 67—83% железа и -небольшие примеси кремния и углерода. -Рго используют главным образом в -металлургической промышленности как присадку в литейном ироизводстве, как раскислитель и для других целей. Разрабатывается -процесс электрохимического разложения феррофосфора с последующим спеканием с сульфатом натрия для получения солей фосфора. [c.226]
Таким образом, электроны в атомах располагаются в определенной последовательности. В некоторых случаях эта последовательность нарушается происходит перемещение электрона с более высокого уровня на еще незаполненный подуровень более низкого уровня (так называемый провал электрона). Так, например, в атоме хрома вместо казалось бы нормального размещения электронов по формуле фактическое размещение электронов выражается формулой 15 25 2р 3. 3р 3с1 45. Подоб1гыг отступления наблюдаются также и у атомов меди, ниобия и некоторых других э./гементов. Встречаются также и отступления от правила Клечковского (атомы лантапа, гадолиния, актиния, тория). Тем не менее правило Клечковского является серьезным теоретическим обоснованием периодической системы элементов. [c.31]
В данном разделе приводится экспериментальное подтвержде-Ш1С основных теоретических предпосылок, лежащих в основе осуществления процессов при периодическом изменении входной температуры. В качестве модельных реакций были выбраны окисление бутана п пропан-бутановой смеси на катализаторе хромит меди, нанесенный на оксид алюминия [13]. [c.138]
В процессах гидроочистки различных нефтепродуктов могут быть использованы любые сероустойчивые гидрирующие катализаторы, но лучшие результаты дают металлы, окислы и сульфиды элементов VI или VIII групп периодической системы элементов (никель, кобальт, железо, молибден, вольфрам, хром) и различные их сочетания друг с другом [40, 83—99]. [c.74]
Большинство каталитически активных металлов, как указывалось выще, представляет собой элементы VI и VIII групп Периодической системы элементов Д. И. Менделеева (хром, молибден, вольфрам, железо, кобальт, никель, платина и палладий). В некоторых случаях сульфиды и окислы этих металлов в свободном состоянии (без носителей) обнаруживают кислотные свойства. Примером может служить дисульфид вольфрама, обладающий каталитической активностью в реакциях гидроизомеризации, гидрокрекин" га и насыщения кратных связей. Так как серосодержащие соединения присутствуют практически в любом сырье, следует применять серостойкие катализаторы — сульфиды металлов. В большин-, стве современных процессов в качестве катализаторов используют кобальт или никель, смешанные в различных соотношениях с молибденом, на пористом носителе (окиси алюминия). Иногда применяют сульфидный никельвольфрамовый катализатор. [c.215]
DowType B [ agNi(P04)g] - катализатор дегидрогенизации, стабилизированный окисью хрома /8/. Отличительная способность - высокая селективность по отношению к бутадиену (80-90%) при превращении за проход 40-50% (на разложенный бутилен). Высокая селективность, вероятно, достигается за счет большой величины отношения концентрации водяного пара к сырью в исходной смеси (18 1), а также благодаря периодической регенерации катализатора смесью водяного пара и воздуха /14,22/. [c.76]
В качестве катализаторов для гидрогенизационных процессов переработки сернистых нефтепродуктов наиболее отвечающими указанным требованиям являются оксиды и сульфиды элементов VI группы Периодической системы — хрома, молибдена, вольфрама. Их применяют на носителях и без них (например, сернистый вольфрам). Кроме того, широко используют более сложные композиции, включающие элементы VI и VIII групп Периодической системы, — хроматы и хромиты никеля, кобальта, железа молибдаты кобальта, никеля и железа вольфраматы никеля, кобальта, железа или же их соответствующие сульфопроизвод-ные[136, 137, 144 . [c.249]
Этим требованиям полнее всего соответствуют металлы, окислы и сульфиды элементов VI и VI11 групп Периодической системы элементов (никель, кобальт, железо, молибден, вольфрам, хром). Состав катализаторов оказывает существенное влияние на избирательность реакций, поэтому соответствующим подбором компонентов катализаторов и их соотнощений удается осуществлять управление процессом гидроочистки моторных топлив в широких пределах. [c.201]
Наблюдается сходство марганца и его левого соседа в периодической системе — хрома. В подгруппе марганца также происходит повышение устойчивости высших степеней окисления при увеличении порядкового номера элемента. Так, например, пер-ренаты (ККе04) — менее сильные окислители, чем перманганаты (ШПО4) [c.628]
Амфотерные свойства прояш1яют оксиды металлов, металлические свойства которых выражены неярко (в Периодической таблице эти элементы находятся между металлами и неметаллами). Например, AljOj, ZnO. Кроме того, амфотерньЕе свойства проявляют оксиды некоторых металлов в высоких положительных степенях окисления. Например, Fe Oj, r Oj. Вообще, если металл проявляет несколько возможных степеней окисления, то характер его оксида будет меняться от кислотного к основному. Например, оксид марганца (VII) Мп О, и оксид хрома (VI) СЮ проявляют кислотные свойства, оксид хрома (III) r Oj- амфотерные, а о ксид хрома (И) СгО и оксид марганца (И) МпО - основные. [c.152]
Большинство элементов главных подгрупп IV — УП групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп — металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисления, их аналогичные соединения проявляют существенное сходство. Так, хром, расположенный в побочной подгруппе VI группы, образует кислотный оксид СгОз, близкий по свойствам к триоксиду серы ЗОз-Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава Н2ЭО4. Точно так же оксиды марганца и хлора, соответствующие высшей степени окисления этих элементов, [c.496]
Из таблицы видно, что аналитические группы ионов занимают определенные участки в периодической системе элементов. Наибольшее совпадение между группами периодической системы и аналитическими группами отмечается у I и II аналитических групп первая аналитическая группа (без Mg +) соответствует группе IA щелочных металлов, а вторая — подгруппе щелочно-земельных металлов, входящих в группу ИА. Наиболее многочисленная III аналитическая группа включает в себя катионы элементов групп IIIА и IIIB, а также лантаноидов, актиноидов и ряда других переходных металлов, например хрома, марганца, железа, кобальта, никеля, цинка. При этом часть ионов III аналитической группы — Zn +, [c.230]
ХРОМ ( hromium, греч. hroma — цвет) — химический элемент VI группы 4-го периода периодической системы элементов Д. И. Менделеева, п. н. 24, ат. м. 51,996. X. состоит из чегырех стабильных изотопов, известны шесть радиоактивных изотопов. X. открыт в 1797 г. Л. Вокеленом. X. весьма распространенный элемент, его содержание в земной —2 [c.279]
К существенным противоречиям короткой формы периодической системы относили, пребывание элементов побочных подгрупп — марганца, технеция, рения в одной группе с галогенами хрома, молибдена, вольфрама в группе с халькогенами ванадия, ниобия, тантала в группе с пниктогенами меди, серебра, золота — со щелочными металлами цинка, кадмия, ртути — со щелочноземельными металлами и т. д., — а также и осложнения, вносимые элементами побочных подгрупп в порядок изменения свойств элементов в вертикальных группах. Однако на самом деле эта особенность короткопериодной формы может рассматриваться для элементов, начиная со второй и и кончая седьмой группой, скорее как преимущество по сравнению с другими формами — в одной группе находятся вместе как полные, [c.26]
chem21.info
СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ СИСТЕМА химических ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
Периодичность свойств элементов и
Их соединений.
Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе.
Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z.Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента –Z.
Номер периода показывает число энергетических электронных уровней в атоме.
Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне.
Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное –буквой(s-, p-, d-, f-),а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота 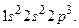 Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного
Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного 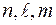 . Например, для атома азота электронно-графическая формула имеет вид:
. Например, для атома азота электронно-графическая формула имеет вид:
| ↓↑ | ↓ | ↓ | ↓ | |||||||||||||||
| ↓↑ | 2s | 2p |
1s
Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
| Основное состояние | Возбуждённое состояние | ||||||||||||||
| 1s2 2s2 | ↓↑ |  | 1s2 2s1 2p1 | ↓ | ↓ | ||||||||||
| ↓↑ | 2s | 2p | ↓↑ | 2s | 2p | ||||||||||
| 1s | 1s | ||||||||||||||
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу 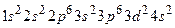 ,это d – элемент.
,это d – элемент.
Ti имеет всего четыре валентных электрона, поэтому высшая степень окисления +4.
Оксид, отвечающий этой степени окисления – TiO2, имеет амфотерный характер (с преобладанием основных свойств), поэтому соответствующий ему гидроксид может быть записан в двух формах: Ti(OH)4 или h3TiO3, соответственно он образует соли при взаимодействии и с кислотами и со щелочами:
Ti(OH)4 + 2Н2SO4  Ti (SO4)2 + 4h3O и h3TiO3 + 2NaOH
Ti (SO4)2 + 4h3O и h3TiO3 + 2NaOH  Na2TiO3 + 2h3O
Na2TiO3 + 2h3O
Ti(OH)4 + 2НCl  Ti Сl2 + 4h3O и h3TiO3 + K2O
Ti Сl2 + 4h3O и h3TiO3 + K2O 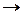 K2TiO3 + h3O
K2TiO3 + h3O
Низшая степень окисления Ti (как у большинства d–элементов) +2. Оксид TiО имеет основный характер, гидроксид Ti(OH)2 образует соли только с кислотами, например, TiSO4 или TiCl2.
Для характеристики любого элемента необходимо выполнить следующие действия:
1. Определить состав атома, т.е. указать число протонов, нейтронов и электронов.
2. Дать электронную формулу атома и распределение электронов внешних энергетических уровней по атомным орбиталям.
3. Определить высшую и низшую степень окисления и привести формулы и названия соединений, отвечающих данным степеням окисления.
Например, элемент № 34 Se.
Состав атома: (34 p, 46 n) 34 e.
Электронная формула: 1s22s22р63s23p63d104s24p4 – это p–элемент.
Электронно-графическая формула:
| ↓↑ | ↓ | ↓ | ↓↑ | |||||||||||||||
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | 4s | 4p | ||||||||
| 3s | 3p | 3d | ||||||||||||||||
Высшая степень окисления +6, оксид селена (VI) SeO3 – кислотный, гидроксид h3SeO4 - селеновая кислота, соли: Na2SeO4 - cеленат натрия, K2SeO4 - селенат калия.
Низшая степень окисления -2, h3S - селеноводород, K2Se - селенид калия, Na2Se - селенид натрия.
Свойства элементов, определяемые строением внешних электронных слоев атомов, закономерно изменяются по периодам и группам периодической системы. При этом сходство электронных структур порождает сходство свойств элементов–аналогов, но не тождественность этих свойств. Поэтому при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее ярко выраженное закономерное изменение. В частности, химическое поведение атомов элементов проявляется в их способности терять и приобретать электроны, т.е. в их способности к окислению и восстановлению. Количественной мерой способности атома терять электроны является потенциал ионизации(Еи), а мерой способности их приобретать – сродство к электрону (Ес). Характер изменения этих величин при переходе от одного периода к другому повторяется, причем в основе этих изменений лежит изменение электронной конфигурации атома. Так, завершенные электронные слои, соответствующие атомам инертных газов, обнаруживают повышенную устойчивость и повышенное значение потенциалов ионизации в пределах периода. В то же время наименьшими значениями потенциала ионизации обладают s–элементы первой группы (Li, Na, K, Rb, Cs).
Электроотрицательность является мерой способности атома данного элемента оттягивать на себя электроны по сравнению с атомами других элементов в соединении. Согласно одному из определений (Малликен), электроотрицательность атома 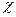 может быть выражена как полусумма его энергии ионизации и сродства к электрону:
может быть выражена как полусумма его энергии ионизации и сродства к электрону: 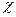 =
= 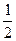 (Еи + Ес).
(Еи + Ес).
В периодах наблюдается общая тенденция роста электроотрицательности элемента, а в подгруппах – ее снижение. Наименьшими значениями электроотрицательности обладают s–элементы I группы, а наибольшими – р–элементы VII группы.
Электроотрицательность одного и того же элемента может меняться в зависимости от валентного состояния, гибридизации, степени окисления и пр. Электроотрицательность существенно влияет на характер изменения свойств соединений элементов. Так, например, серная кислота проявляет более сильные кислотные свойства, чем ее химический аналог – селеновая кислота, поскольку в последней центральный атом селена из-за меньшей по сравнению с атомом серы электроотрицательности не так сильно поляризует связи Н–О в кислоте, что и означает ослабление кислотности.
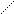
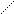
 Н–О O
Н–О O


 Se
Se
Н–О O
Другой пример: гидроксид хрома (II) и гидроксид хрома (VI). Гидроксид хрома (II), Cr(OH)2, проявляет основные свойства в отличие от гидроксида хрома (VI), Н2CrO4, поскольку степень окисления хрома +2 обусловливает слабость кулоновского взаимодействия Cr2+ с гидроксид-ионом и легкость отщепления этого иона, т.е. проявление основных свойств. В то же время высокая степень окисления хрома +6 в гидроксиде хрома (VI) обусловливает сильное кулоновское притяжение между гидроксид-ионом и центральным атомом хрома и невозможность диссоциации по связи 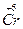 – OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
– OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
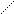
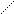
 Н–О +6 O
Н–О +6 O


 Cr
Cr
Н–О O
Следующей важной характеристикой атомов является их радиусы. В периодах радиусы атомов металлов с ростом порядкового номера элемента уменьшаются, т.к. с ростом порядкового номера элемента в пределах периода возрастает заряд ядра, а следовательно и уравновешивающий его общий заряд электронов; как следствие, возрастает и кулоновское притяжение электронов, что приводит в конечном счете к уменьшению расстояния между ними и ядром. Наиболее рельефно снижение радиуса наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня.
В больших периодах у d- и f-элементов наблюдается более плавное снижение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов радиусы атомов, как правило, увеличиваются сверху вниз, так как такое смещение означает переход на более высокий энергетический уровень.
Влияние радиусов ионов элементов на свойства образуемых ими соединений можно проиллюстрировать на примере возрастания кислотности галогенводородных кислот в газовой фазе: HI > HBr > HCl > HF.
В этих соединениях сила кулоновского притяжения зависит от кулоновского радиуса, представляющего собой сумму радиусов ионов галогена и водорода. Очевидно, что с ростом радиуса галогена сила кулоновского притяжения снижается, что делает отщепление протона более выгодным.
Похожие статьи:
poznayka.org
1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
Одним из важнейших законов природы является периодический закон, открытый в 1869 г. Менделеевым, который он сформулировал так: "Свойства простых веществ, также формы и свойства соединений находятся в периодической зависимости от атомных весов элементов".
С развитием квантовой химии периодический закон получил строгое теоретическое обоснование, а с ним и новую формулировку: "Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов".
До Менделеева многие пытались систематизировать элементы, наиболее близко подошел Майер (Германия). В 1864 г. в своей книге он привел таблицу, в которой элементы были также расположены в порядке возрастания их атомных масс, но в эту таблицу Майер поместил всего 27 элементов, меньше половины, известных в то время. Заслуга Менделеева, что в его таблице нашлось место не только всем известным элементам, но были оставлены пустые места для еще не открытых элементов (экабор – Sc, экаалюминий – Ga, экасилиций – Ge).
С точки зрения электронного строения атома:
Периодом называют горизонтальную последовательность элементов, начинающуюся со щелочного металла и заканчивающуюся благородным газом с тем же максимальным значением главного квантового числа, равного номеру периода.
Число элементов в периоде определяется емкостью подуровней.
| 1s2 | 2s22p6 | 3s23p6 | 4s23d104p6 | 5s24d105p6 | 6s24f145d106p6 | 7s25f146d107p6 |
| I | II | III | IV | V | VI | VII периоды |
| 2 | 8 | 8 | 18 | 18 | 32 | 32 элемента. |
Группой элементов называют вертикальную совокупность элементов, обладающую однотипной электронной конфигурацией и определенным химическим сходством. Номер группы (за исключением I, II, VIII побочных подгрупп) равен сумме валентных электронов.
Кроме деления по периодам (определяемое главным квантовым числом) существует деление на семейства, определяемое орбитальным квантовым числом. Если у элемента заполняется s-подуровень, то s-семейство или s-элемент; p-подуровень – p‑элемент; d-подуровень – d-элемент; f-подуровень – f-элемент.
В короткопериодной форме периодической системы 8 групп, каждая из которых делится на главную и побочную подгруппы. I и II главные подгруппы заполняются s-элементами; III‑VIII главные подгруппы – р-элементами. d-элементы находятся в побочных подгруппах. f-элементы вынесены в отдельные группы.
Таким образом, каждый элемент в периодической системе элементов занимает строго определенное место, которое отмечается порядковым номером и связано со строением электронных оболочек атома.
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в периодической системе.
Энергией ионизации называется энергия, которую надо затратить для отрыва и удаления электрона от атома, иона или молекулы. Она выражается в Дж или эВ (1эВ=1,6.10-19 Дж).
Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электрон, превращаются в положительно заряженные ионы.
Сродство к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу.
Энергия сродства к электрону атомов закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены отличаются самым высоким сродством к электрону, т.к. присоединяя один электрон к нейтральному атому, она приобретает законченную электронную конфигурацию благородного газа.
Характеристика о том, какой из атомов легче отдает или присоединяет электрон, называется электроотрицательностью которая равна полусумме энергии ионизации и сродства к электрону.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Атомные и ионные радиусы
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах.
Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов.
В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т.к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента.
Пример. Как изменяются размеры атомов внутри периода, при переходе от одного периода к другому и в пределах одной группы? Какие элементы имеют минимальное и максимальное значения размера атома?
Решение.
Внутри периода (слева направо) размеры атомов уменьшаются, т.к. увеличивается заряд ядра и электроны сильнее притягиваются к ядру. В главных подгруппах размеры атомов увеличиваются, т.к. увеличивается число электронных слоев. В побочных подгруппах такие изменения меньше заметны, за счет d -сжатия, а при переходе из V в VI период происходит даже уменьшение уменьшение размеров атомов за счет f -сжатия.
Согласно этим правилам минимальное значение размера атома имеет гелий, а максимальное – цезий. Франций не имеет долгоживущих изотопов (природный изотоп радиоактивен, период полураспада 21 минута).
Металлы и неметаллы. Деление элементов и простых веществ на металлы и неметаллы в известной степени условно.
По физическим свойствам металлы характеризуются высокой теплопроводностью и электрической проводимостью, отрицательным температурным коэффициентом проводимости, специфическим металлическим блеском, ковкостью, пластичностью и т.п.
По химическим свойствам металлы характеризуются основными свойствами оксидов и гидроксидов и восстановительными свойствами.
Подобные различия в свойствах простых веществ связаны с характером химической связи при их образовании. Металлическая связь в металлах образуется при дефиците валентных электронов, а ковалентная в неметаллах при их достаточном количестве. Исходя из этого, можно провести вертикальную границу между элементами IIIA и IV групп. Слева – элементы с дефицитом валентных электронов, справа – с избытком. Это граница Цинтля.
Пример. Чем отличаются типичные металлы от неметаллов? Почему и как изменяются металлические свойства с увеличением порядкового номера элементов?
Решение.
В периодической системе элементов в основном находятся металлы, неметаллов немного (всего 22). К металлам относятся все s -элементы. Это связано с наличием у них малого числа валентных электронов (1 или 2), в результате этого дефицита электронов образуется металлическая связь.
Все d - и f -элементы тоже являются металлами. При образовании химических связей в качестве валентных электронов у атомов d -элементов выступают s -электроны внешнего энергетического уровня и часть или все d -электроны предпоследнего уровня, причем d -электроны участвуют в образовании химических связей лишь после того, как будут связаны все внешние s -электроны. Кроме того, легкости удаления s -электронов способствует эффект экранирования заряда ядра. Он состоит в уменьшении воздействия на электрон положительного заряда ядра из-за наличия между рассматриваемым электроном и ядром других электронов (это d - или f -электроны).
У р-элементов происходит конкуренция между увеличением числа валентных электронов (неметаллические свойства) и экранированием заряда ядра (усиливаются металлические свойства). В связи с этим у р-элементов по подгруппе сверху вниз увеличивается устойчивость низших степеней окисления.
По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром.
Свойства соединений подразделяются на кислотно-основные и окислительно-восстановительные. Периодическая система элементов хорошо объясняет эти закономерности. Рассмотрим это на примере гидроксидов.
Если элемент имеет степень окисления маленькую (+1 или +2), например, Na—O—H, то связь Na—O менее прочная, чем O—H и разрыв связи происходит по менее прочной связи.
Na—O—H Na+ + OH-. Соединение обладает основными свойствами.
Если степень окисления элемента большая (от +5 до +7), то связь элемент – кислород прочнее, чем связь О—Н и соединение обладает кислотными свойствами. В азотной кислоте степень окисления азота большая (+5).
H+ + NO3-
| Степень окисления элемента | +1 и +2 | +3 и +4 | +5, +6, +7 |
| Кислотно- основные свойства | Основания | Амфотерные соединения | Кислоты |
| Исключения | La3+, Bi3+, Tl3+ | Zn+2, Be+2, Sn+2, Pb+2, Ge+2 | Гидроксиды неметаллов в любой степени окисления образуют только кислоты |
Соединения в степени окисления +3 и +4 проявляют амфотерные свойства, т.е. в зависимости от партнера по реакции могут проявлять как кислотные, так и основные свойства. Но есть исключения Zn+2, Be+2, Sn+2, Pb+2, Ge+2 имеют степень окисления +2, но являются амфотерными соединениями.
По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства.
По подгруппе сверху вниз увеличиваются металлические и основные свойства, т.к. увеличивается размер атома и связь с соседним атомом ослабляется.
Таким образом, периодическая система позволяет проанализировать положение простых веществ в связи с особенностями их свойств (металлы, неметаллы).
Периодический закон Менделеева дает возможность определять и свойства простых веществ в химических соединениях. Впервые предсказание свойств было осуществлено самим Менделеевым. Он рассчитал свойства и тех элементов, которые еще не были открыты.
studfiles.net
Металлы побочных подгрупп характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
МЕТАЛЛЫ ПОБОЧНЫХ ПОДГРУППХарактеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к обра зованию комплексных ионов; образование окрашенных соединений.
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
^ .
Электроотрицательность металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
^
Хром — твердый, голубовато-белый металл.ρ = 7,2г/см3, tплавл= 18570С
СО: +1,+2,+3,+4,+5,+6
Химические свойства.
- Взаимодействие с простыми веществами.
- При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
2Cr + 3Cl2 2CrCl3
2Cr + N2 2CrN
2Cr + 3S Cr2S3
- Взаимодействие со сложными веществами.
- В раскалённом состоянии реагирует с парами воды:
- Хром растворяется в разбавленных сильных кислотах (HCl, h3SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2+ h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
- Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение.
- Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
- Восстановлением оксидов хрома оксидом углерода (II), водородом: CrO + Н2 Cr + h3O
^
Соединения двухвалентного хрома
Оксид хрома (II) CrO
Физические свойства: твердое нерастворимое в воде вещество ярко-красного или коричнево-
красного цвета.
^ CrO – основной оксид.
- Взаимодействует с кислотами: CrO + 2HCl → CrCl2 + 2h3O
- Легко окисляется на воздухе при нагревании до оксида хрома (III): 4CrO + O2 2 Cr2O3
- Восстанавливается водородом до хрома: CrO + Н2 Cr + h3O
- При окислении амальгамы хрома на воздухе: 2Cr + O2 2 CrO
- При прокаливании Сr(ОН)2 в отсутствие кислорода: Сr(ОН)2 CrO + h3O
^ 2
Физические свойства: твердое нерастворимое в воде вещество желтого цвета.
Химические свойства. Сr(ОН)2 – слабое основание.
- Взаимодействует с кислотами: Cr(OH)2 + 2HCl → CrCl2 + 2h3O
- Легко окисляется в присутствии влаги кислородом воздуха в Сr(ОН)3:
- При прокаливании разлагается:
б) в присутствии кислорода: 4Сr(ОН)2 2 Cr2O3 + 4h3O
Получение.
- Действием щелочи на растворы солей Cr(II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
^
Оксид хрома (III) Cr2O3
Физические свойства: темно-зеленое тугоплавкое вещество, нерастворимое в воде.
^ Cr2O3 - амфотерный оксид.
- Взаимодействует с кислотами, как основной оксид: Cr2O3 + 6HCl 2 CrCl3 + 3h3O
- Взаимодействует со щелочами, как кислотный оксид: Cr2O3 + 2NaOH 2NaCrO2 + h3O
- При высокой температуре восстанавливается водородом, кальцием, углеродом до хрома:
Получение.
- При окислении хрома: 4Cr + 3O2 2Cr2O3
- При разложении гидроксида хрома (III): 2Сr(ОН)3 Cr2O3 + 3h3O
^ 3
Физические свойства: нерастворимое в воде вещество зелёного цвета.
Химические свойства. Сr(ОН)3 – амфотерный гидроксид
- Взаимодействует с кислотами, как нерастворимое основание:
- Взаимодействует со щелочами, как нерастворимая кислота:
(хромит калия)
- При нагревании легко разлагается: 2Сr(ОН)3 Cr2O3 + 3h3O
- При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
^
Оксид хрома (VI) CrO3
Физические свойства: твердое вещество темно-красного цвета, хорошо растворимое в воде. Ядовит!
^ CrO3 – кислотный оксид.
- Взаимодействует со щелочами, образуя соли желтого цвета-хроматы:
- Взаимодействует с водой, образуя кислоты: CrO3 + h3O → h3CrO4 хромовая кислота
- Термически неустойчив: 4 CrO3 → 2Cr2O3 + 3O2 ↑
- Получают из хромата (или дихромата) калия действием h3SO4(конц.).
K2Cr2O7 + h3SO4 → 2CrO3 + K2SO4 + h3O
^ 2CrO4- хромовая кислота, h3Cr2O7- дихромовая кислота
Обе кислоты неустойчивы, при попытке их выделения в чистом виде распадаются на воду и оксид хрома (VI). Однако соли их вполне устойчивы. Соли хромовой кислоты называют хроматами, они окрашены в желтый цвет, а соли дихромовой кислоты – дихроматами, они окрашены в оранжевый цвет.
^
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Химические свойства.
- Взаимодействие с простыми веществами.
- Горит в кислороде, образуя окалину - оксид железа (II,III): 3Fe + 2O2 → Fe3O4
- Железо реагирует с неметаллами при нагревании:
Fe + S FeS
- Взаимодействие со сложными веществами.
- При высокой температуре (700–900C) железо реагирует с парами воды:
- На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
- Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + h3SO4(разб.) → FeSO4 + h3↑
- В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
Fe + 6HNO3(конц.) Fe(NO3)3 + 3NO2 + 3h3O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
- Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Получение.
- Восстановлением из оксидов углём или оксидом углерода (II)
Fe2O3 + 3CO 2Fe + 3CO2^ Физические свойства: твердое вещество черного цвета, нерастворимое в воде.
^ FeО – основной оксид
- Взаимодействует с кислотами: FeО + Н2SO4 →
- При сильном нагревании окисляется водой: 3FeО + h3O Fe3О4 + h3↑
- Окисляется кислородом до оксидов с более высокой СО: 4FeО + O2 Fe2О3
- Восстанавливается водородом, углеродом, оксидом углерода(II) до железа:
Получение.
- При разложении гидроксида железа(II): Fe(ОН)2 FeО + h3O
- При частичном восстановлении оксидов Fe3О4 и Fe2О3: Fe2О3 + h3 2 FeО + h3O
Химические свойства: Fe(OH)2 – слабое основание.
- Взаимодействует с сильными кислотами: Fe(OH)2 + h3SO4→FeSO4 + 2h3O
- При нагревании разлагается: Fe(OH)2 FeO + h3O
- На воздухе окисляется до Fe(OH)3: 4Fe(OH)2 + O2 + 2h3O → 4Fe(OH)3
- Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
3FeSO4 + 2K3[Fe(CN)6] Fe3[Fe(CN)6]2 + 3K2SO4^ Физические свойства: твердое вещество красно-коричневого цвета.
Химические свойства: Fe2O3 – амфотерный оксид.
- Взаимодействует с кислотами, как основной оксид: Fe2O3 + 6HCl → 2 FeCl3 + 3h3O
- Взаимодействует со щелочами, как кислотный оксид: Fe2O3 + 2NaOH 2NaFeO2 + h3O
- Восстанавливается водородом, углеродом, оксидом углерода(II): Fe2О3 + h3 2 FeО + h3O
Получение.
- При разложении гидроксида железа(III): 2 Fe(OH)3 Fe2O3 + 3h3O
- При обжиге пирита: 4FeS2 + 11O22Fe2O3 + 8SO2
^ Физические свойства: твердое вещество красно-бурого цвета.
Химические свойства: Fe(OH)3 – амфотерный гидроксид.
- Взаимодействует с кислотами, как нерастворимое основание:
- Взаимодействует со щелочами, как нерастворимая кислота:
Fе(ОН)3 + 3КОН(конц) → К3[Fе(ОН)6]
- При нагревании легко разлагается: 2Fe(ОН)3 Fe2O3 + 3h3O
- Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка:
^
- При действии гексацианоферрата (II) калия K4[Fe(CN)6] (жёлтой кровяной соли) на растворы солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
- При добавлении к раствору, содержащему ионы Fe3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
^
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло- и электропроводностью. Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
^
- Взаимодействие с простыми веществами.
- При высокой температуре взаимодействует с кислородом: 2Cu + O2 2CuO
- Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 CuCl2
- ^
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 2h3O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑+ 2h3O
Cu + 2h3SO4(конц.) → CuSO4 + SO2↑+2h3O
Получение.
- Восстановлением из оксидов углём или оксидом углерода (II): CuO + C Cu + CO
- При электролизе солей меди: 2CuSO4 + 2h3O → 2Cu + O2 + 2h3SO4
Соединения одновалентной меди
Оксид меди(I) Сu2O
Физические свойства: твердое вещество красного цвета, нерастворимое в воде.
Химические свойства: Сu2O – основной оксид.
- Взаимодействует с кислотами: Сu2O + h3SO4 → CuSO4 + h3O + Cu↓
- При нагревании с восстановителями восстанавливается до металла: Сu2O + Н22Сu + h3O
- При сильном нагревании на воздухе превращается в СuO: Сu2O + О22СuO
- При более сильном нагревании разлагается на простые вещества: Сu2O 2Cu + O2↑
- Получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
^
Физические свойства: неустойчивое, плохо растворимое в воде вещество желтого цвета, в свободном состоянии не выделен.
Химические свойства: CuOH – слабое основание.
- Взаимодействует с кислотами: CuOH + HCl → CuCl + h3O
- На воздухе легко окисляется до Cu(OH)2 : 4CuOH + О2 + 2h3O → 4 Cu(OH)2
- При разложении гидроксида меди(I): 2CuOHСu2O + h3O
- Действием щелочи на соли меди(I): CuCl + NaOH → CuOH↓ + NaCl
Соединения двухвалентной меди
Оксид меди (II) СuO
Физические свойства: твердое вещество черного цвета, нерастворимое в воде.
^ СuO – основной оксид.
- Взаимодействует с кислотами при нагревании: CuO + h3SO4 CuSO4 + h3O
- Легко восстанавливается водородом и другими восстановителями до меди:
- При нагревании разлагается с образованием оксида меди(I): 4СuO 2Сu2O + О2↑
- Окислитель. Окисляет спирты до альдегидов: С2Н5ОН + СuO СН3СОН + Сu↓ + h3O
- При окислении меди: 2Cu + O2 2CuO
- При разложении гидроксида меди(II): Cu(OH)2 CuO + h3O
- При разложении некоторых солей: Cu2(OH)2CO3 2CuO + CO2 + h3O
^ 2
Физические свойства: твердое вещество синего цвета, нерастворимое в воде.
Химические свойства: Cu(OH)2 – слабое основание.
- Взаимодействует с кислотами: Cu(OH)2 + 2HCl → CuCl2 + 2h3O
- При нагревании разлагается: Cu(OH)2 CuO + h3O
- Растворяется в растворе аммиака с образованием комплексного соединения:
- Слабый окислитель. Окисляет альдегиды до карбоновых кислот:
Получение.
- Образуется при действии щелочей на соли меди (II): CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
do.gendocs.ru