Дихромат калия. Калий 2 хром 2 о7
Формула Дихромата калия структурная химическая
Структурная формула
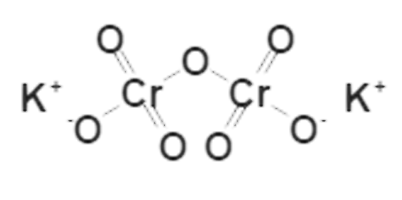 |
 |
Истинная, эмпирическая, или брутто-формула: K2Cr2O7
Химический состав Дихромата калия
| Cr | Хром | 51.996 | 2 | 35,3% |
| K | Калий | 39.102 | 2 | 26,6% |
| O | Кислород | 15.999 | 7 | 38,1% |
Молекулярная масса: 294,189
Дихрома́т ка́лия (двухромовокислый калий, бихромат калия, техн.: хро́мпик) — K2Cr2O7.
Хорошо растворим в воде. В кислой среде проявляет сильные окислительные свойства, восстанавливаясь до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов. Кристаллический дихромат калия также обладает окислительными свойствами. Например, сера и углерод восстанавливают его до оксида хрома (III).
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
Высокотоксичен, канцерогенен, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. ПДК 0,01 мг/м³ (в пересчете на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Получают действием хлорида калия на дихромат натрия.
formula-info.ru
Дихромат калия — WiKi
У этого термина существуют и другие значения, см. хромпик.Дихрома́т ка́лия (двухромовокислый калий, бихромат калия, техн. хро́мпик) — неорганическое соединение, калиевая соль дихромовой кислоты с химической формулой K2Cr2O7, имеет вид оранжевых кристаллов. Обладает сильными окислительными свойствами, в связи с чем широко применяется в химии, фотографии, пиротехнике и различных областях промышленности. Высокотоксичен и канцерогенен.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7).
Физические и химические свойства
Оранжевые кристаллы с температурой плавления 396 °C. Разлагается при нагреве выше 500 °C. Растворим в воде (г / 100 г): 4,6 (0 °C), 15,1 (25 °C), 37,7 (50 °C), незначительно растворим в этаноле. Сильный окислитель[1].
В кислой среде восстанавливается до солей хрома (III)[1]. Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
K2Cr2O7+14HCl→2CrCl3+3Cl2+2KCl+7h3O{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+14HCl\rightarrow 2CrCl_{3}+3Cl_{2}+2KCl+7H_{2}O}}}Кристаллический дихромат калия при нагревании с серой и углеродом восстанавливается до оксида хрома (III)[1]:
K2Cr2O7+S→Cr2O3+K2SO4{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+S\rightarrow Cr_{2}O_{3}+K_{2}SO_{4}}}} 2K2Cr2O7+3C→2Cr2O3+2K2CO3+CO2{\displaystyle {\mathsf {2K_{2}Cr_{2}O_{7}+3C\rightarrow 2Cr_{2}O_{3}+2K_{2}CO_{3}+CO_{2}}}}Водные растворы дихромата калия обладают дубящими свойствами, в частности, задубливают желатину[2].
Получение
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
В чёрно-белой фотографии применяется в качестве отбеливателя для удаления металлического серебра из эмульсии. Не применяется в цветной фотографии, так как для отбеливания требует кислой среды, а при pH ≤ 4 красители, образовавшиеся в эмульсии при цветном проявлении, обесцвечиваются. Вместо этого в цветной фотографии для отбеливания используются составы на основе гексацианоферрата(III) калия и железной соли трилона Б[2].
Безопасность
Токсичен[1], канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. ПДК составляет 0,01 мг/м³ (в пересчёте на CrO3)[1]. При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Примечания
Литература
- Егоров А.С. Химия: современный курс для подготовки к ЕГЭ. — Ростов-на-Дону: Феникс, 2013. — 699 с. — ISBN 978-5-222-21137-3.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Степин Б. Д. Калия дихромат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 287—288. — 671 с. — ISBN 5-85270-035-5.
ru-wiki.org
Калий двухромовокислый
Калий двухромовокислый ГОСТ 4220-75
K2Cr2O7
Дихромат калия (двухромовокислый калий, бихромат калия, техн.: хромпик) — K2Cr2O7.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7 · 2h3O).
|
Дихромат калия |
|
Бихромат калия, двухромовокислый калий, техн.: хромпик |
|
K2Cr2O7 |
|
оранжевое вещество |
|
294,19 г/моль |
|
2,676 г/см³ |
|
398 °C |
|
500 °C |
|
-2033 кДж/моль |
|
4.9 г/100 мл |
Физические и химические свойства
Хорошо растворим в воде. В кислой среде проявляет сильные окислительные свойства, восстанавливаясь до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
Кристаллический дихромат калия также обладает окислительными свойствами. Например, сера и углерод восстанавливают его до оксида хрома (III):
Получение
Получают действием хлорида калия на дихромат натрия.
Токсичность
Высокотоксичен, канцерогенен, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. ПДК0,01 мг/м³ (в пересчёте на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
himmax.ru
Дихромат калия
Вещество дихромат калия имеет несколько наименований, которые, в большей или меньшей степени частоты, употребляются в зависимости от сферы использования самого вещества. Традиционно, в химической теории чаще всего используются названия двухромовокислый калий или же калиевый хромпик. Когда речь идет о промышленном использовании, тогда это соединение обозначают термином хромпик. При этом очень важно понимать, о каком именно соединении идет речь, потому что в обиходном употреблении хромпиком еще именуют дихромат натрия с формулой Na2Cr2O7 * 2h3O. Химическая формула калиевого хромпика — K2Cr2O7.
Физические свойства калиевого хромпика следующие. Внешне это вещество представляет собой кристаллы оранжевого цвета, кристаллическая решетка которых изменчива под воздействием температуры. При ее величине до 257° С решетка имеет форму триклинных монокристаллов, а при повышении температуры выше 257° С она изменяет вид на моноклинную.
Вещество дихромат калия имеет температуру плавления 396° С, при ее повышении более 500° С вещество распадается на К2CrO4, Cr2О3 и кислород. Удельная плотность хромпика калиевого составляет 2,69 г/см3. Двухромовокислый калий хорошо растворяется в водных растворах:
- при температуре 0 °С, в 100 граммах воды полностью растворяется 4,6 грамма калиевого хромпика;
- при температуре в 25 °С, в таком же количестве воды можно полностью растворить уже 15,1 грамма, а при повышении температуры до 50 °С – уже 37,7 грамма.
В спиртах, например, в этаноле, дихромат калия растворяется слабо.
Двухромовокислый калий образует эвтектику – композиционный жидкий раствор, который кристаллизуется при самой малой температуре для данной группы веществ, структурно-композиционная формула которого - Н2О - К2Cr2О7 при содержании хромпика 4,30% по массе. Температура плавления этого соединения всего 0,63 °С, а закипает оно при 104,8 °С (содержание хромпика калия в растворе - 52% по массе).
С участием такого вещества, как дихромат калия, реакции протекают в кислых средах, если он представлен водным раствором. Само вещество также является сильнейшим окислителем, например, в ходе реакции хромпика калиевого и серы получаются соль K2SO4 и оксид хрома.
При взаимодействии с серной и азотной кислотами двухромовокислый калий образует полихроматы. При подогреве смесей, содержащих это соединение и перекись водорода, получаются легко взрывающиеся кристаллы пероксида, который, в свою очередь, является важным компонентом взрывчатых веществ.
Промышленно получение хромпика калиевого осуществляется посредством реакции обмена Na2Cr2O7 с KCl, при которой раствор разогревается до огромных температур – порядка 1000 - 1300° С.
Используется дихромат калия, химические свойства которого описаны выше, в производстве различных красителей, в текстильной и кожевенной отраслях промышленности его применяют при дублении кож. Распространено применение в деревообработке и производстве спичек, изготовлении пиротехнических смесей, фотографии. Если растворить калиевый хромпик в серной кислоте, получается очень эффективный раствор для мытья стеклянных приборов в лабораториях. Как компонент калиевый хромпик используется в сухих электролитах, а также в металлургии как ингибитор процесса ржавления металлов и их сплавов.
Хромпик калиевый - крайне токсичное соединение. Капли его раствора, попадая на открытые участки тела человека, разрушают кожные покровы. Даже небольшие концентрации этого вещества могут нанести серьезный вред дыхательным путям и повреждать хрящевые связки тканей. Известны случаи поражения почек, печени и желудочно-кишечного тракта. Поэтому при производстве работ с дихроматом калия следует строго выполнять меры предосторожности. Особенно следует позаботиться о защите органов дыхания и кожи.
fb.ru
Формула Хромата калия структурная химическая
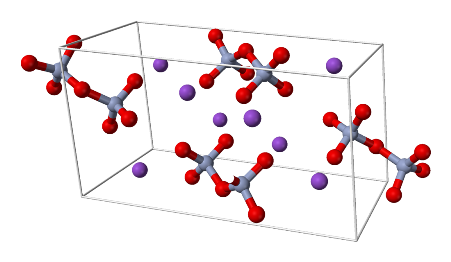
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: CrK2O4
Химический состав Хромата калия
| Cr | Хром | 51,996 | 1 | 26,8% |
| K | Калий | 39,102 | 2 | 40,3% |
| O | Кислород | 15,999 | 4 | 33% |
Молекулярная масса: 194,196
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор в желтый цвет.
Получение
- В природе встречается редкий минерал тарапакаит — хромат калия с примесями.
- Окисление оксида хрома(III) хлоратом калия: Cr2O3 + KClO3 + 2K2CO3 → 500-700oC 2K2CrO4 + KCl + 2CO2
- Растворение оксида хрома(VI) в гидроксиде калия: CrO3 + 2KOH → K2CrO4 + h3O
- Разложение бихромата калия при нагревании: 4K2Cr2O7 → 500-600oC 4K2CrO4 + 2Cr2O3 + 3O2
- Действие концентрированного раствора едкого калия на дихромат калия: K2Cr2O7 + 2KOH → 2K2CrO4 + h3O
Физические свойства
Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4. При 668°С переходит в гексагональную красную фазу. Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле. Парамагнетик.
Химические свойства
- В разбавленных кислотах переходит в дихромат калия: 2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + h3O
- С концентрированными кислотами реакция идёт иначе: K2CrO4 + 2HCl → K[Cr(Cl)O3] + KCl + h3O
- С концентрированными горячими кислотами проявляются окислительные свойства: 2K2CrO4 + 16HCl → 90oC 2CrCl3 + 3Cl2↑ + 4KCl + 8h3O
- Вступает в обменные реакции: K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3 K2CrO4 + Hg2(NO3)2 → Hg2CrO4↓ + 2KNO3
Применение
- В качестве поглотителя УФ излучения лампы накачки в твердотельных лазерах для предотвращения деградации активной среды.
- Как протрава при крашении тканей.
- Окрашивание стекла в жёлтый цвет.
- Дубитель в кожевенной промышленности.
- Отбеливатель для масла и воска.
- Окислитель в органическом синтезе.
- Хромат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
formula-info.ru
Хром - HimHelp.ru
Хром — твердый голубовато-белый металл. При высоких температурах хром горит в кислороде с образованием Сr2О3, реагирует с парами воды
2Сr + 3Н2O 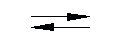 Сr2О3 + 3Н2 ,
Сr2О3 + 3Н2 ,
и с галогенами, образуя галогениды состава СrНаl3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти кислоты растворяют хром:
2Сr + 6Н2SО4(конц) = Сr2(SО4)3 + 3SО2↑ + 6Н2О,
Сr + 6НNО3(конц) = Сr(NО3)3 + 3NO2↑ + 3Н2О.
При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя соли Сr2+. По своим свойствам соли Сr2+ похожи на соли Fе2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II):
СrСl2 + 2NaОН = Сr(ОН)2↓ + 2NaСl.
При прокаливании Сr(ОН)2 в отсутствие кислорода образуется оксид хрома (II) СrО.
Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
Сr2(SО4)3 + 6NaОН = 2Сr(ОН)3↓ + 3Na2SО4,
обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III)
2Сr(ОН)3 + 3Н2SО4 = Сr2(SО4)3 + 6Н2О,
так и в щелочах с образованием тетрагидроксихромитов, т.е. солей, в которых Сr3+ входит в состав аниона:
Сr(ОН)3 + КОН = К[Cr(ОН)4].
В результате прокаливания Сr(ОН)3 получают оксид Сr2О3 — зеленые кристаллы, нерастворимые в воде. Этот оксид получают также прокаливанием дихроматов калия и аммония:
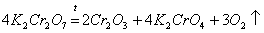 .
.
При сплавлении Сr2О3 со щелочами, содой и кислыми солями получаются соединения Сr+3, растворимые в воде:
Сr2О3 + 2NaОН = 2NaСrО2 + Н2О↑,
Сr2О3 + Nа2СО3 = 2NaСrО2 + СО2↑,
Сr2О3 + 6КНSО4 = Сr2(SО4)3 + 3К2SО4 + 3Н2О.
Наиболее важными соединениями хрома в высшей степени окисления +6 являются оксид хрома (VI) СrО3, хромат (VI) калия К2СrО4 и дихромат (VI) калия К2Сr2О7.
Оксид хрома (VI) — ангидрид хромовой Н2СrО4 и дихромовой Н2Сr2О7 кислот, представляет собой ярко-красные кристаллы, растворимые в воде. Он также реагирует со щелочами, образуя желтые хроматы СrО42-:
СrО3 + 2КОН = К2СrО4 + Н2О.
В кислой среде ион CrO42- превращается в ион Сr2О72- . В щелочной среде эта реакция протекает в обратном направлении:
| Кислая среда | ||
| 2СrO2-4 + 2H+ | 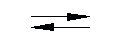 | Cr2O2-7 + h3O |
| Щелочная среда |
www.himhelp.ru
Калий двухромовокислый применение - Справочник химика 21
К процессам этой группы очистки газа от сероводорода относятся такие, при которых невозможна регенерация ни поглотителя, ни сероводорода. Для удаления следов сероводорода из промыщленных газов применяют водные растворы перманганата калия, двухромовокислого калия или натрия с соответствующими буферными добавками. Поскольку процессы, основанные на применении таких поглотительных растворов, нерегенеративны и требуют значительных затрат на химикалии, они применяются лишь в тех случаях, когда требуется полная очистка газа от небольших количеств сероводорода [318]. Для очистки газов с более высоким содержанием сероводорода значительно экономичнее применять другие процессы. [c.347] Особого внимания заслуживает применение хромовой смеси. Хромовокислые соли в кислоте являются очень сильными окислителями. Поэтому хромовую смесь часто применяют, когда никакие способы мытья не помогают. Смесь готовят добавлением в концентрированную серную кислоту измельченного двухромовокислого калия (5 % от массы кислоты). Перед мытьем хромовой смесью посуду вначале ополаскивают водой, а затем заполняют подогретой смесью. Иногда, если требуется наиболее тщательная очистка, хромовую смесь оставляют в посуде на продолжительное время (например, на ночь). После использования хромовую смесь сливают в специальный сосуд и хранят. Уменьшение активности смеси контролируют визуально свежеприготовленная хромовая смесь имеет темно-оранжевый цвет, а в процессе использования она меняет окраску до темно-зеленого. Вымытую хромовой смесью посуду в дальнейшем моют, как обычно. [c.23]При установлении окислительно-восстановительного равновесия между ионами разной валентности, например и Ре " , потенциал инертного электрода имеет определенную величину. Если при титровании такого раствора двухромовокислым калием ионы Ре полностью окисляются до Ре , то потенциал электрода резко изменит свою величину и, таким образом, может быть определен конец реакции. Подобные способы, получившие широкое применение в аналитической химии, получили название потенциометрического титрования. [c.187]
На этих реакциях базируется важное применение двухромовокислого калия в объемном анализе. [c.139]
Применение. Соли алюминия, ванадия, железа, кобальта, никеля и хрома применяют в качестве катализаторов или они служат исходным сырьем для их приготовления. Соли высших валентностей, а именно марганцовокислый калий и двухромовокислый калий или натрий используют как сильные окислители, а соли титана, никеля и двухвалентного железа — в качестве восстановителей. [c.31]
На заводах Юга нашла применение в качестве индикатора кремнемолибденовая кислота, которая под действием избытка хлористого олова окрашивается в голубой цвет. Избыток хлористого олова окисляют двухромовокислым калием до появления травянисто-зеленой окраски. [c.95]
Прежде, калиевый хромпик получали аналогично натриевому с применением поташа вместо соды. В настоящее время его получают почти исключительно из двухромовокислого натрия обменным разложением с хлористым калием [c.420]
Для окраски дерева применяют красящие вещества, растворы которых обладают способностью проникать в ткани окрашиваемого материала и придавать ему желаемую окраску. Крашение древесины может производиться также с помощью протрав, не являющихся красителями, которые, вступая в химическую реакцию с дубильными веществами древесины, окрашивают последнюю за счет образования окрашенных солей, отлагающихся в волокнах древесины. Протравами служат хлорное и сернокислое железо, хлорная и сернокислая медь, хромовокислый и двухромовокислый калий (хромпик) и др. Недостатками протрав является то, что они дают очень незначительную гамму тонов, которая к тому же зависит от химического состава древесины, вследствие чего протравы имеют ограниченное применение. [c.11]
Прежде чем приступить к измерению объемов, необходимо тщательно вымыть измерительную посуду. Стеклянная посуда моется водой с применением ершей, кусочков бумаги, мыла или соды. Если при этом стекло не очищается, его отмывают хромовой смесью, представляющей собой смесь двухромовокислого калия и концентрированной серной кислоты. Обращаться с хромовой смесью надо очень осторожно [c.44]
Для повыщения стойкости изделий против коррозии наибольшее применение нашел способ хроматного наполнения пленок. Он заключается в обработке оксидированных изделий в течение 10—15 мин. в нагретом до 90—95° 5—10-процентном растворе двухромовокислого калия КгСггО . При этом оксидная пленка приобретает лимонно-желтый цвет. [c.26]
Наибольшее применение в промышленности нашел способ уплотнения с помощью хроматов. Оксидированные изделия обрабатывают в течение 20—30 мин в нагретом до 80—90° С 4—5-процентном растворе двухромовокислого калия или натрия. При этом оксидная пленка на алюминии приобретает лимонно-желтый цвет. В растворе для хроматного уплотнения не допускается присутствие примесей более 4 г/л 50.1 и 1,5 г/л С1. [c.31]
Аппарат обычно назначается для работы с желтым светом, соответствующим натриевой линии О. Свет этой длины волны очень легко получается в нагреваемой электричеством натриевой лампе, которая дает яркий желтый накал. Можно также пользоваться натриевым пламенем газовой горелки, но оно не такое яркое. Белый свет с применением светофильтра из указанного ниже раствора в фильтрующей камере длиной 3> см дает хорошие результаты для веществ, обладающих слабым вращением. Раствор для светофильтра приготовляют из 8,9 г медного купороса, 9,4 г двухромовокислого калия и 300 г воды. Затем раствор фильтруют и оставляют стоять для оседания взвешенных частиц. [c.52]
Были описаны методы окисления с применением перманганата калия [58, 59], хромовой кислоты [60] и двухромовокислых солей [61—72]. Для определения многоатомных спиртов, в которых п крайней мере два гидроксила являются соседними, в качестве реактивов широко применялись йодная кислота [73—78] и тетра-ацетат свинца [79, 80]. [c.271]
Для решения вопроса о положении гидроксильной группы в исследуемых спиртах был применен один из химических методов исследования строения органических соединений — метод окисления спиртов двухромовокислым калием в среде разбавленно серной кислоты [10]. При окислении первичных спиртов этим реагентом получаются карбоновые кислоты с тем же числом атомов углерода, что и в исходном спирте. При окислении же вторичных спиртов происходит разрыв углерод-углеродных связей по месту положения гидроксильной группы, в результате чего образуются карбоновые кислоты с меньшим числом углеродных атомов в молекуле. [c.165]
Если азотная кислота считается нежелательной, возможно использование серной кислоты, содержащей окислитель. В Японии при обработке сталей с высоким содержанием хрома успешные результаты дает соляная кислота, содержащая двухромовокислый калий, хотя опасность применения бихромата в связи с тем, что он является катодным стимулятором и анодным ингибитором, вполне осознана [29]. [c.374]
Определение общего количества железа производят объемным бихроматным методом после восстановления окисного железа в закисное с помощью раствора хлористого олова. Избыток хлористого олова окисляют раствором двухромовокислого калия с применением в качестве индикатора кремнемолибденовой кислоты (С. Ю. Файнберг, 1946). В присутствии избытка хлористого олова кремнемолибденовая кислота восстанавливается с образованием молибденовой сини. При обратном титровании бихроматом избытка хлористого олова синяя окраска исчезает, как только заканчивается окисление двухлористого олова, но раньще, чем начнет окисляться закисное железо. [c.47]
Наиболее сильным окислителем в кислой среде является марганцево-кислый калий. Тем не менее опыт показывает, что нельзя ограничиться применением только одного этого рабочего раствора. Высокий окислительный потенциал системы Мп07/Мп "" (в кислой среде) является иногда недостатком, так как способствует образованию активных промежуточных продуктов в результате возникают сопряженные реакции окисления. Поэтому в ряде случаев вместо марганцевокислого калия удобнее пользоваться двухромовокислым калием (с дифениламином или фенилантраниловой кислотой в качестве индикатора) или ванадиевокислым аммонием. В других случаях реакция между определяемым веществом и ионом перманганата идет не стехиометрически. Так, в реакции со многими органическими веществами перманганат может, при длительном взаимодействии, окислить их полностью, например до СО и Н О. Однако реакция идет довольно медленно, а образование промежуточных стадий не имеет резкого ступенчатого характера. Поэтому при определении некоторых органических соединений вместо марганцевокислого калия применяют бромноваго-кислый калий, йод или другие окислители. Эти окислители имеют более низкий потенциал и окисление не идет так далеко, как при действии перманганата. Однако бром илн йод взаимодействуют с молекулами мног их органических веществ довольно быстро и в точных стехиометрических отношениях. Таким образом, ряд обстоятельств обусловливает необходимость применения различных окислителей в зависимости от конкретных условий. [c.365]
Тимохинон может быть получен непосредственно из тИхМола сульфированием и окислением сульфомассы перекисью марганца или двухромовокислым калием тот же способ был успешно применен к карвакролу. Окисление солей аминотимола двухромовокислым калием , хлорным железом или бромом в момент выделения также дает удовлетворительные выходы тимохинона. Хороший выход получается также при длительном кипячении нитрозо-тимола с обратным холодильником . Описанный здесь метод основан на том, что соль диазония, полученная из аминотимола, почти количественно превращается в тимохинон при нагревании в присутствии избытка азотистой кислоты , [c.380]
Практическое значение имеет фильтр Линпиха, предназначенный для света натриевой горелки он состоит из двух частей из кюветки длиной 10 см или трубки длиной 10 см с 6-нроц. раствором двухромовокислого калия и из кюветки длиной 1,5 см или трубки такой же длины со следующим раствором 5 г сернокислого урана растворяют в 100 мл дестиллированной воды и прибавляют 2 г чистого цинкового порошка. Затем добав-,ляют три раза по 1 мл концентрированной серной кислоты, дожидаются прекращения выделения водорода, закрывают и оставляют на 6 час. после этого быстро отфильтровывают в кюветку, герметично закрывают последнюю и до применения оставляют па 24 часа. Хорошо закрытый раствор сохраняется в течение [c.161]
В Институте физической химии им. Л. В. Писаржевского АН УССР был разработан и тщательно проверен [75, 91] метод химической дозиметрии, основанный на применении разбавленных водных растворов двухромовокислого калия, содержащих серную кислоту. Этот метод, назван- [c.51]
Хромовому ангидриду соответствуют две кислоты — хромовая Н2СГО4 и двухромовая НаСггО,. Известны только соли этих кислот. Соли хромовой кислоты называют хромовокислыми, или хроматами, например хромовокислый калий, или хромат калия, К2СЮ4. Соли двухромовой кислоты называют двухромовокислыми, или бихроматами, например двухромовокислый калий или бихромат калия, К2СГ2О, (называемый нередко хромпиком). Это кристаллическое оранжевое вещество, имеющее большое применение в кожевенной промышленности для дубления кожи, в. спичечном производстве, в химических лабораториях в качестве сильного окислителя. При смешивании 10%-ного раствора двухромовокислого калия с концентрированной серной кислотой получают хромовую смесь. Используют эту смесь в химических лабораториях для мытья сильно загрязненной стеклянной посуды, требующей особой чистоты, и в реакциях как окислитель. [c.213]
Применение производных шестивалентного хрома. Уже давно известно, что вместо медленно реагирующих гидратированных солей трехвалентного хрома в некоторых реакциях можно с успехом использовать двухромовокислые соли. Довольно распространенным является синтез калиевой соли бисоксалатобисаквохрома, (П1) из бихромата калия и щавелевой кислоты [92]. В этом случае восстановление шестивалентного хрома в трехвалентный происходит под действием избытка щавелевой кислоты. Этот метод был использован для получения хромовых комплексов азокраси- [c.1978]
Закономерности, наблюдавшиеся при испытании полученных катализаторов, аналогичны найденным в случае промотирова-ния окиси цинка окислами железа. Однако промотирующий эффект оказался меньшим и максимумы активности и селективности не совпадали (рис. 4). Наибольшей активностью обладает окись цинка, обработанная 1%- Ными растворами упомянутых выше веществ. Обработка окиси цинка двухромовокислым аммонием повышает активность окиси цинка в меньшей степени, чем обработка марганцовокислым калием. Обработка 0,1%-ными растворами промоторов резко снижает активность катализатора (особенно в случае применения КМПО4). [c.247]
Достоинства, недостатки и возможности применения химических и инструментальных методов определения азота в различных объектах приведены в обзорах [1454, 1473]. N0 окисляют до N02 воздухе р- и УФ-излучениями, высокочастотным электрическим разрядом [1444], 3%-ным раствором двухромовокислого калия в 2,5%-ном растворе Н2804 [1444], озоном [1463]. N031 определяют на фотоколориметре [1438], с помощью нитратного ионосе-лективного электрода [1466]. Содержание N02 измеряют в виде нитрит-иона реакция с 8%-ным раствором иодида калия) [1442] в кулонометрической гальванической ячейке [1463], хемилюминесценцией (10 —10 %) [1471]. Учитывая способность озона окислять N0, необходимо обратить особое внимание на методику отбора пробы при совместном присутствии этих компонентов и, в частности, на время нахождения этих газов в пробоотборнике [1455]. [c.161]
Если вводить в пленки поливинилалкоголя двухромовокислый калий или аммоний, пленки становятся светочувствительными. Такие пленки используются при фототравлении металлов и фотолитографской печати. Участки светочувствительной пленки, подвергшиеся действию света, теряют растворимость в воде, а не подвергавшиеся действию света растворяк>тся и легко смываются водой. Нерастворимая часть оставляет отпечаток на металле. На этом основании было предложено повышать водостойкость поливинилалкоголя и его соединений погружением их в раствор соединений металлов VI и VIII групп менделеевской системы при комнатной или повышенной температуре с одновременным облучением светом. Поливинилалкоголь повышает прочность бумаги во влажном состоянии и поэтому он применяется в производстве салфеток и полотенец из бумаги. Прочность бумаги во влажном состоянии сохраняется 40—50 секунд, что достаточно для времени пользования полотенцем. Поливинилалкоголь делает также бумагу прозрачной, смягчает ее и применяется для производства глазурованной бумаги. О применении поливинилалкоголя как клея см. книгу автора Синтетические клеи . Поливинилалкоголь является прекрасным эмульгатором и может применяться с этой целью и в слабокислой, и в нейтральной среде. Он используется как эмульгатор и загуститель для косметических паст и мыльных палочек для бритья. [c.124]
Даже простое сопоставление полученных данных (табл. 27, показывает, что в целом использование всех трех методов анализа приводит к весьма близким результатам. Поэтому, несмотря на определенные достоинства других методов, предпочтение было отдано методу Байбаевой и Орловой как более доступному. Следует, правда, оговориться, что избранный метод модифицировался применением в качестве дополнительного окислителя двухромовокислого калия. [c.91]
С. Ю. Файнберг и Т. В. Заглодина рекомендуют избыток двухлористого олова при восстановлении Ее (III) окислять раствором бихромата калия в присутствии кремиемолибденовой кпслоты как индикатора. Последняя восстанавливается двухлористым оловом с образованием молибденовой сини, синяя окраска которой исчезает, как только закончится окисление бихроматом калия избытка двухлористого олова. Применение ири восстановлении Ее(III) двухлористым оловом кремиемолибденовой кислоты в качестве индикатора, а при титровании восстановленного железа (Ее2+) двухромовокислым калием — фенилантраниловой кислоты, исключает употребление сулемы и фосфорной кислоты. [c.43]
Сонгина и Ходасевич [4] исследовали вопрос о роли смеси Циммермана — Рейнгардта при потенциометрическом определении железа. Попов [5] с целью замены ртути предложил восстанавливать основную массу ионов Ре + хлористым оловом, а оставшуюся часть — хлористым хромом, избыток которого окисляется кислородом воздуха. Метод не нашел широкого применения. Файн-берг и Заглодина [6] описали вариант бихроматного метода, по которому ионы Ре + восстанавливают хлористым оловом, избыток которого окисляют раствором двухромовокислого калия в присутствии силикомолиб-деновой кислоты до перехода синей окраски раствора в зеленую. После этого титруют ионы Ре + двухромовокислым калием в присутствии индикатора фенилантра-ниловой кислоты до перехода зеленой окраски в малиновую. Метод не применяется из-за неясной точки перехода при титровании избытка хлористого олова. Нами был использован бихроматный метод с применением в качестве восстановителя хлористого олова или металлического алюминия. При применении хлористого олова избыток его окисляли хлорной ртутью. В качестве индикатора в обоих случаях применяли дифениламино-сульфонат натрия. В книге Сырокомского [7] подробно описаны бихроматный и перманганатометрический методы определения содержания Реобщ в железных рудах и титаномагнетитах. [c.12]
Представляют интерес объемные оксидиметрические методы определения Реобщ с применением в качестве индикатора фенилантраниловой кислоты, предложенной для этой цели Кирсановым и Черкасовым [17]. Фе-нилантраниловая кислота имеет более высокий редокси-потенциал, чем дифениламин или дифениламиносуль-фокислота. Поэтому титрование раствором двухромовокислого калия в присутствии фенилантраниловой кислоты можно осуществлять без введения в раствор ортофосфорной кислоты, необходимой для связывания ионов Ре + в комплексное соединение при титровании с дифениламином или дифениламиносульфонатом натрия. [c.13]
К стр. 13). Согласно дуалистическим взглядам Берделиуол, ооли представляют собой соединение кислотного (электрохимически отрицательного) и основного (электрохимически положительного) окислов. Кали и натр — это электрохимически положительные окиси калия и натрия углекислым кали называлось соединение СОг -Ь КО (С = 6 и О = 8) рутениево- и осмиевокислым кали — соединение соответствующих окислов с окисью калия. Поэтому существовали названия двухромовокислое кали, уксуснокислая окись свинца (ацетат свинца по современной терминологии), азотно-Ешслая окись серебра (нитрат серебра), углекислый барит (иными словами, углекислая окись бария) и т. п. Бутлеров не всегда последователен в применении этой терминологии и иногда говорит щавелевокислый свинец (kleesaiires Blei) вместо щавелевокислая окись свинца . Соли аммония называются у Бутлерова углекислый, сернокислый, щавелевокислый аммиак и т. д., так как предполагалось, что оии представляют собой соединение кислотного окисла с аммиаком СОг + NHa и т. п. [c.551]
В частности М. В. может образоваться при обработке щелоков серной кислотой, при производстве соды, хлора по методу Дикона, гипохлората кальция, треххлористого фос( ора, хлористого и сернокислого цинка, хлористого метила, диметилсульфата, сернокислого железа (из старого железа), при изготовлении мастики, при всех электролитических реакциях, протекающих в воде в гальванических элементах, содержащих двухромовокислый калий, при зарядке аккумуляторов в производстве анилиновых красителей (при восстановлении нитробензола или нитротолуола в анилин или, соответственно, толуидин водородом в момент выделения при получении из нитробензола бензидина с применением мышьяковистой кислоты) в производстве глюкозы (обработка крахмала с серной кислотой) при получении ацетилена [c.155]
Если определение содержания ускорителей созревания в желатине не представляет особых затруднений, — их количество находят или физикохимическим анализом по высоте первой ступени аналитической кривой, или же методом раздельного определения с применением окисления двухромовокислым калием, то определение содержания тормозителей может быть более трудоемким. Поэтому удобнее воспользоваться косвенным методом, а именно вычислением этого количества по формуле В = А (т/тц). Как указано выше, величину То можно считать заранее определенной для какого-либо стандартного рецепта синтеза эмульсии, тогда для нахождения В необходимо экспериментально определить т — время достижения максимальной светочувствительности с данной желатиной и при той же методике синтеза. [c.216]
Для изыскания способов снижения скорости коррозии в ЭНИМСе исследовали процесс электрохимической обработки в водном растворе хлористого натрия с добавками различных ингибиторов. Одновременно проводили коррозионные испытания чугуна, легированных сталей, нержавеющей стали и латуни в проточном растворе хлористого натрия с концентрацией 200 г л и добавками ингибиторов. Добавление ингибиторов к раствору хлористого натрия значительно уменьшает коррозию металла. Так, введение в раствор электролита добавки двухромовокислого калия практически полностью предотвращает коррозию исследованных металлов. Добавка триэтанола-мина эффективна для чугуна и сталей Ст. 3 и 40Х, но менее эффективна для латуни. Прибавление бензойнокислого натрия оказывает благоприятное действие на стали 40Х и Ст.З, вызывая незначительную коррозию чугуна. Все три ингибитора удобны в употреблении, так как хорошо растворяются в электролите. Другие добавки, например, фосфаты МэгРаО, ЫадРдОд Ыа РеО в мало растворимы в воде, что делает их применение менее удобным, хотя ингибирующий эффект их удовлетворителен. [c.87]
chem21.info