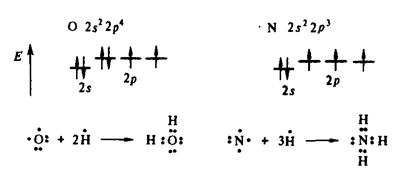Справочник химика 21. Заряд ядра атома хрома равен
Ł АТОМНОЕ ЯДРО Заряд ядра Нейтрон Состав атомных ядер Изотопы Ядерные силы
КАБАРДИН О.Ф.ФИЗИКА (справочные материалы), 1991

СОДЕРЖАНИЕ ДАННОЙ СТАТЬИ
Достаточно одному атому хрома совершить спонтанный переход с метастабильного уровня на основной с испусканием фотона, как возникает лавина фотонов, вызванная индуцированным излучением атомов хрома, находящихся в метастабильном состоянии. Если направление движения первичного фотона строго перпендикулярно плоскости зеркала на торце рубинового цилиндра, то первичные и вторичные фотоны отражаются от первого зеркала и летят через кристалл до второго зеркала. На своем пути они вызывают вынужденное излучение у новых атомов хрома, и процесс продолжается. Процесс высвечивания всех возбужденных атомов хрома завершается за 10-8 - 10-10 с. Мощность светового излучения лазера при этом может быть более 109 Вт, т.е. превышать мощность крупной электростанции.
В настоящее время, кроме лазеров на кристаллах, разработаны газовые лазеры и лазеры на жидкостях.
Основными особенностями лазерного излучения являются его когерентность, возможность получения световых пучков с очень малой расходимостью, возможность получения потоков излучения с очень большой мощностью.
Луч лазера может прожечь отверстие в самом твердом материале, расплавить любую металлическую броню, и он же помогает хирургам при выполнении самых тонких операций внутри человеческого глаза. По лучу лазера осуществляется телефонная связь и прокладка трасс, лазер применяется для измерения расстояний и для получения объемных изображений предметов - голограмм.
В ряде стран ведутся разработки лазерного оружия для применения его в космическом пространстве. Советский Союз и другие социалистические страны выступают за прекращение разработки любых новых видов оружия массового уничтожения, против использования космического пространства в военных целях.
86. АТОМНОЕ ЯДРО
Заряд ядра. Точные измерения электрического заряда атомных ядер были выполнены в 1913 г. английским физиком Генри Мозли (1887-1915). Заряды ядер атомов различных химических элементов он определил по спектрам рентгеновского излучения, испускаемого атомами при облучении вещества потоком электронов высокой энергии. Мозли установил, что электрический заряд ядра атома равен произведению элементарного электрического заряда 
 химического элемента в таблице Менделеева:
химического элемента в таблице Менделеева:  .
.
Таким образом, порядковый номер химического элемента в таблице Менделеева определяется числом положительных элементарных зарядов в ядре любого атома химического элемента или числом электронов в оболочке нейтрального атома.
Нейтрон. Так как ядро атома химического элемента с порядковым номером 
 элементарных положительных зарядов, то естественно было предположить, что ядро любого из атомов этого химического элемента составлено из
элементарных положительных зарядов, то естественно было предположить, что ядро любого из атомов этого химического элемента составлено из  одинаковых частиц, каждая из которых обладает элементарным положительным зарядом. Такой частицей мог быть протон - ядро самого легкого из атомов - атома водорода. Протон обладает положительным элементарным зарядом, масса
одинаковых частиц, каждая из которых обладает элементарным положительным зарядом. Такой частицей мог быть протон - ядро самого легкого из атомов - атома водорода. Протон обладает положительным элементарным зарядом, масса  протона равна 1,6726·10-27 кг. Если бы атомные ядра состояли только из протонов, то ядро атома химического элемента с порядковым номером
протона равна 1,6726·10-27 кг. Если бы атомные ядра состояли только из протонов, то ядро атома химического элемента с порядковым номером 
 и массой
и массой  . Но в действительности масса, например, ядра атома кислорода не в 8 раз больше массы ядра атома водорода, а примерно в 16 раз.
. Но в действительности масса, например, ядра атома кислорода не в 8 раз больше массы ядра атома водорода, а примерно в 16 раз. Проблема состава атомного ядра была решена только после открытия английским физиком Джеймсом Чедвиком (1891-1974) в 1932 г. частицы, не имеющей электрического заряда и обладающей массой, примерно равной массе протона. Эту частицу назвали нейтроном.
Состав атомных ядер. После открытия нейтрона советский физик Дмитрий Дмитриевич Иваненко и немецкий физик Вернер Гейзенберг (1901-1976) выдвинули гипотезу о протонно-нейтронном строении ядра. Согласно, этой гипотезе все ядра состоят из протонов и нейтронов. Число протонов в ядре равно порядковому номеру элемента в таблице Менделеева и обозначается знаком 
 . Общее число протонов и нейтронов в ядре обозначается знаком
. Общее число протонов и нейтронов в ядре обозначается знаком  и называется массовым числом.
и называется массовым числом.  .
.
Изотопы. Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами различных изотопов одного химического элемента. Из-за разного числа нейтронов ядра различных изотопов одного химического элемента обладают разными массами и могут отличаться по физическим свойствам, например по способности к радиоактивному распаду. Из-за одинакового заряда ядра атомы разных изотопов одного химического элемента имеют одинаковое строение электронных оболочек и поэтому обладают одинаковыми химическими свойствами.
Обозначается изотоп символом химического элемента 
 и слева внизу числа протонов
и слева внизу числа протонов  в атомном ядре:
в атомном ядре:  .
.
Например, самый легкий изотоп водорода, ядром которого является один протон, обозначается символом  . Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом
. Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом  .
.
Ядерные силы. Так как размеры атомных ядер малы, силы кулоновского отталкивания между двумя половинами, например, атомного ядра свинца, содержащего 82 протона, достигают нескольких тысяч ньютонов. Но ядро свинца не разваливается на части под действием кулоновских сил отталкивания, поэтому следует сделать вывод о существовании сил притяжения между протонами и нейтронами, превосходящих силы кулоновского отталкивания между протонами.
Силы притяжения, связывающие протоны и нейтроны в атомном ядре, назвали ядерными силами. Другое название этого взаимодействия - сильное взаимодействие.
Протон и нейтрон по способности к сильному взаимодействию не отличаются друг от друга, поэтому в ядерной физике их часто рассматривают как одну частицу - нуклон - в двух различных состояниях. Нуклон в состоянии без электрического заряда называется нейтроном, нуклон в состоянии с электрическим зарядом называется протоном.
Основные свойства ядерных сил можно объяснить тем, что нуклоны обмениваются между собой частицами, масса которых больше массы электрона примерно в 200 раз. Такие частицы были обнаружены экспериментально в 1947 г. Они получили название пи-мезонов.
Ядерные силы являются короткодействующими силами. На расстояниях не больших ·10-15 м сильное взаимодействие нуклонов значительно превосходит электромагнитное и гравитационное, но с увеличением расстояния между нуклонами очень быстро убывает.
Пользуйтесь поиском вверху страницы! Все, что будет найдено со значком Ł - относится к данному сайту
cartalana.org
Заряд ядра атома, теория и примеры
Атомы любых веществ являются электрически нейтральными частицами. Атом состоит из ядра и совокупности электронов. Ядро несет положительный заряд, суммарный заряд которого равен сумме зарядов всех электронов атома.
Общие сведения о заряде ядра атома
Заряд ядра атома определяет местоположение элемента в периодической системе Д.И. Менделеева и соответственно химические свойства вещества, состоящего их этих атомов и соединений этих веществ. Величина заряда ядра равна:
![Rendered by QuickLaTeX.com \[q=Ze \qquad (1)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1c4acd50b57e7d9bce590340a8eb38af_l3.png)
где Z – номер элемента в таблице Менделеева, e – величина заряда электрона или 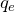 .
.
Элементы с одинаковыми числами Z, но разными атомными массами называют изотопами. Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Ядра атомов имеют положительный заряд, так как состоят из протонов и нейтронов. Протоном называют стабильную частицу, принадлежащую классу адронов, являющуюся ядром атома водорода. Протон – это положительно заряженная частица. Ее заряд равен по модулю элементарному заряду, то есть величине заряда электрона. Заряд протона часто обозначают как 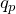
![Rendered by QuickLaTeX.com \[q_p=\left|e\right|=1,6\cdot {10}^{-19}Kl\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e9707b9d58b8c8b8b86848a3f9df5e42_l3.png)
Масса покоя протона (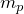 ) примерно равна:
) примерно равна:
![Rendered by QuickLaTeX.com \[m_p=1,6\cdot {10}^{-27}\ kg\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-23ac42b3ea6ff820c58e9ff380ff4aca_l3.png)
Подробнее о протоне можно узнать, прочитав раздел «Заряд протона».
Эксперименты по измерению заряда ядра
Первым заряды ядер измерил Мозли в 1913 г. Измерения были косвенными. Ученый определил связь между частотой рентгеновского излучения (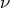 ) и зарядом ядра Z.
) и зарядом ядра Z.
![Rendered by QuickLaTeX.com \[\sqrt{\nu}=CZ-B \qquad (2)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cabc5202be136217e983016449d1f15f_l3.png)
где C и B – постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра измерил Чедвик в 1920 г. Он проводил рассеивание  – частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
– частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
В этих экспериментах  – частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что
– частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что  – частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем
– частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем  – частицы. Иногда, довольно редко
– частицы. Иногда, довольно редко  – частицы отклонялись на углы превышающие 90o. Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у
– частицы отклонялись на углы превышающие 90o. Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у  – частицы.
– частицы.
Для математического описания результатов своих экспериментов Резерфорд вывел формулу, которая определяет угловое распределение  – частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса
– частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса  – частицы. Формулу Резерфорда можно записать как:
– частицы. Формулу Резерфорда можно записать как:
![Rendered by QuickLaTeX.com \[\frac{dN}{N}=n{\left(\frac{Ze^2}{m_{\alpha}v^2}\right)}^2\frac{d\Omega}{{\sin}^4\frac{\theta}{2}} \qquad (3)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b1afba06b20f669cdab3663473c053ce_l3.png)
где n – количество рассеивающих ядер на единицу площади фольги; N – число 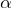 – частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока
– частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока 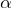 – частиц;
– частиц; 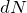 – количество частиц, которые рассеиваются внутри телесного угла
– количество частиц, которые рассеиваются внутри телесного угла 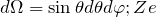 – заряд центра рассеяния;
– заряд центра рассеяния; 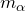 – масса
– масса 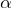 – частицы;
– частицы; 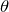 – угол отклонения
– угол отклонения 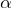 – частиц; v – скорость
– частиц; v – скорость 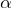 – частицы.
– частицы.
Формулу Резерфорда (3) можно использовать для того, чтобы найти заряд ядра атома (Z), если провести сравнение числа падающих 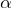 – частиц (N) с числом (dN) частиц рассеянных под углом
– частиц (N) с числом (dN) частиц рассеянных под углом 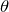 , то функция
, то функция 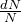 будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
Примеры решения задач
ru.solverbook.com
Как определить заряд ядра атома
Заряд ядра атома

Многие могут утверждать, что химия — сложная наука, которая понятна далеко не всем. Но если серьезно засесть за учебники и начать с самых азов, то все окажется далеко не таким мрачным. Первое, с чего стоит начать — атом и его основные характеристики.
Атом — это та наименьшая частица всего, что нас окружает, которая несет в себе всю необходимую информацию,частица, определяющая характеристики и заряды.
Долгое время ученые думали, что она неделима, едина, однако в течение долгих часов, дней, месяцев и годов проводились изучения, исследования и опыты, которые доказали, что атом также имеет свою структуру.
Другими словами, этот микроскопический шарик состоит из еще меньших составляющих, которые влияют на величину его ядра, свойства и заряд. Структура же этих частиц такова:
Последнее также можно разделить на совсем элементарные части, которые в науке именуют протонами и нейронами, которых насчитывается четкое количество в каждом конкретном случае.
Число протонов, которые есть в ядре, указывает на структуру оболочки, которая состоит из электронов. Эта оболочка же, в свою очередь, вмещает в себя все необходимые свойства определенного материала, вещества либо предмета.
Вычислить сумму протонов очень просто — достаточно знать порядковый номер наименьшей части вещества (атома) во всем известной таблице Менделеева. Это значение еще называют атомным числом и обозначают латинской буквой «Z».
Важно помнить, что протоны владеют позитивным зарядом, а на письме это значение определяется как +1.
Нейроны — второе составляющее ядра атома. Это элементарная субатомная частица, которая не несет никакого заряда в отличие от электронов или протонов. Нейроны были открыты в 1932 году Дж. Чедвиком, за что он, спустя 3 года, получил Нобелевскую премию. В учебниках и научных трудах их обозначают как латинский символ «n».
Третья составляющая атома — электрон, который находится в монотонном движении вокруг ядра, создавая таким образом облако. Именно эта частица самая легкая из всех известных современной науке, а это значит, что и заряд ее также наименьший.Обозначаетсяэлектрон на письме от −1.
Именно соединение положительных и негативных частиц в структуре, делает атом незаряженной или нейтрально заряженной частицей. Ядро, в сравнении с общим размеров всего атома, очень маленькое, но именно в нем сосредоточен весь вес, что говорит о его высокой плотности.
Как определить заряд ядра атома?
Чтобы определить заряд ядра атома, нужно хорошо разбираться в строении, структуре самого атома и его ядра, понимать основные законы физики и химии, а также иметь на вооружении периодическую таблицу Менделеева для определения атомного числа химического элемента.
Для того чтобы найти и рассчитать заряд ядра атома, нужно:
- Знание того, что микроскопическая частица любого вещества имеет в своей структуре ядро и электроны, которые создают возле него оболочку в виде облака. В состав ядра, в свою очередь, входят два вида элементарных неделимых частиц: протоны и нейроны, каждый из которых имеет свои свойства и характеристики. Нейроны не располагают в своем арсенале электронным зарядом. Это означает, что их заряд не равен и не больше или меньше ноля. Протоны, в отличие от своих собратьев, несут положительный заряд. Иными словами, их электрический заряд можно обозначить как +1.
- Электроны, которые являются неотъемлемой частью каждого атома, также несут в себе определенный вид электрического заряда. Они являются негативно заряженными элементарными частицами, а на письме они определяются как −1.
- Чтобы вычислить заряд атома, нужны знания о его структуре (мы только что вспомнили необходимые сведения), количестве элементарных частиц в составе. А для того, чтобы узнать суму заряда атома, нужно математическим способом добавить количество одних частиц (протонов) к другим (электронам). Обычно, характеристика атома говорит о том, что он электрон нейтрален. Другими словами значение электронов приравнивается количеству протонов. Итог таков — значение заряда такого атома равен нулю.
- Важный нюанс: бывают ситуации, когда число позитивно и негативно заряженных элементарных частиц в ядре может не быть равным. Это говорит о том, что атом становиться ионом с положительным или отрицательным зарядом.
Это были основные советы и рекомендации для тех, кто пытается разобраться в основах естественных наук. Ну и еще немного формул.
Обозначениеядра атома в научной сфере выглядит как Ze. Расшифровать это достаточно просто: Z — это тот номер, который присвоен элементу во всем известной таблице Менделеева, еще его называют порядковым или зарядным числом. И указывает оно на количество протонов в ядре атома, а e — это всего лишь заряд протона.
В современной науке существуют ядра с разным значением зарядов: от 1 до 118.
Еще одно важное понятие, которое нужно знать юным химикам — массовое число. Это понятие указывает на общую суму заряда нуклонов (это те самые мелкие составляющие части ядра атома химического элемента). И найти это число можно, если воспользоваться формулой: A = Z + N где А — искомое массовое число, Z — количество протонов, а N — значение нейтронов в ядре.
Чему равен заряд ядра атома брома?
Чтобы на практике продемонстрировать, как найти заряд атома необходимого элемента (в нашем случае, брома), стоит обратиться к периодической таблице химических элементов и найти там бром.
Его порядковыйномер 35. Это означает, что и заряд ядра его равен 35, поскольку он зависит от числа протонов в ядре.
А на число протонов указывает номер, под которым стоит химический элемент в великом труде Менделеева.
Приведем еще несколько примеров, чтобы в будущем юным химикам и было проще рассчитать необходимые данные:
- заряд ядра атома натрия (na)равен 11, поскольку именно под этим номером его можно найти в таблице химических элементов.
- заряд ядра фосфора (символическое обозначение которого P) имеет значение 15, ведь именно столько в его ядре протонов;
- сера (с графическим обозначениемS) — соседка по таблице предыдущегоэлемента, поэтому и заряд ядра у нее 16;
- железо (а найти мы его можем в обозначенииFe) стоит под номером 26, что говорит о таком же количестве протонов в его ядре, а значит и заряде атома;
- углерод (он же C) находится под 6 номером периодической таблицы, что и указывает на нужную нам информацию;
- магний имеет атомный номер 12, а в международной символике его знают как Mg;
- хлор в периодической таблице, где он пишетсякак Cl, стоит под 17 номером, поэтому и его атомное число (а именно оно нам нужно) такое же — 17;
- кальций (Ca), который так полезен для юных организмов, находим под номером 20;
- заряд ядра атома азота (с письменным обозначениемN) равняется 7, именно в такой очереди он представлен в таблице Менделеева;
- барий стоит под 56 номером, что и равно его атомной массе;
- химический элемент селен (Se) имеет в своем ядре 34 протона, а это показывает, что именно таким будет заряд ядра его атома;
- серебро (или в письменном обозначенииAg) имеет порядковыйномер и атомную массу 47;
- если же нужно узнать заряд ядра атома лития (Li), то нужно обратиться к началу великого труда Менделеева, где он находится под номером 3;
- аурум или всеми нами любимое золото (Au) имеет атомную массу 79;
- у аргона же это значение равно 18;
- рубидий имеет атомную массу в размере 37, а у стронция она равна 38.
Перечислять все составляющие периодической таблицы Менделеева можно еще очень долго, ведь их (этих составляющих) очень много.
Главное, что суть этого явления понятна, а если нужно будет вычислить атомное число калия, кислорода, кремния, цинка, алюминия, водорода, бериллия, бора, фтора, меди, фтора, мышьяка, ртути, неона, марганца, титана, то стоит только обратиться к таблице химических элементов и узнать порядковый номер того или иного вещества.
Источник: https://1000sovetov.ru/article_zaryad-yadra-atoma
Заряд ядра атома, теория и примеры

Атомы любых веществ являются электрически нейтральными частицами. Атом состоит из ядра и совокупности электронов. Ядро несет положительный заряд, суммарный заряд которого равен сумме зарядов всех электронов атома.
Общие сведения о заряде ядра атома
Заряд ядра атома определяет местоположение элемента в периодической системе Д.И. Менделеева и соответственно химические свойства вещества, состоящего их этих атомов и соединений этих веществ. Величина заряда ядра равна:
где Z – номер элемента в таблице Менделеева, e – величина заряда электрона или.
Элементы с одинаковыми числами Z, но разными атомными массами называют изотопами. Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Ядра атомов имеют положительный заряд, так как состоят из протонов и нейтронов. Протоном называют стабильную частицу, принадлежащую классу адронов, являющуюся ядром атома водорода. Протон – это положительно заряженная частица. Ее заряд равен по модулю элементарному заряду, то есть величине заряда электрона. Заряд протона часто обозначают как, тогда можно записать, что:
Масса покоя протона () примерно равна:
Подробнее о протоне можно узнать, прочитав раздел «Заряд протона».
Эксперименты по измерению заряда ядра
Первым заряды ядер измерил Мозли в 1913 г. Измерения были косвенными. Ученый определил связь между частотой рентгеновского излучения () и зарядом ядра Z.
где C и B – постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра измерил Чедвик в 1920 г. Он проводил рассеивание – частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
В этих экспериментах – частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения.
Это объясняется тем, что – частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем – частицы. Иногда, довольно редко – частицы отклонялись на углы превышающие 90o.
Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у – частицы.
Для математического описания результатов своих экспериментов Резерфорд вывел формулу, которая определяет угловое распределение – частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса – частицы. Формулу Резерфорда можно записать как:
где n – количество рассеивающих ядер на единицу площади фольги; N – число – частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока – частиц;– количество частиц, которые рассеиваются внутри телесного угла– заряд центра рассеяния;– масса – частицы; – угол отклонения – частиц; v – скорость – частицы.
Формулу Резерфорда (3) можно использовать для того, чтобы найти заряд ядра атома (Z), если провести сравнение числа падающих – частиц (N) с числом (dN) частиц рассеянных под углом , то функциябудет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/fizika/zaryad-yadra-atoma/
Атомное ядро: заряд ядра
| На этом сайте вы найдете репетитора!Nado5.ru — профессиональный инструмент для поиска репетитора.Здесь вы найдете подходящего репетитора быстро, удобно и бесплатно.Оставьте заявку или позвоните нам. Мы подберем репетитора, учитывая все пожелания.Или найдите репетитора в нашей базе самостоятельно, используя фильтр слева. |
| Получите консультацию по телефону.Мы всегда рады проконсультировать Вас по вопросам образования. Задайте свои вопросы профессионалам.Больше не надо ломать голову, к кому обратиться за помощью — для этого есть Nado5.ru! |
| Наши репетиторы помогут вам.Прислушайтесь к нашим советам, чтобы найти репетитора быстрее:Совет 1. Чтобы значительно упростить процесс поиска, достаточно лишь позвонить нам, и оператор найдет репетитора, который максимально подходит под ваши требования. |
| Мы подберем репетитора бесплатно!Прислушайтесь к нашим советам, чтобы найти репетитора быстрее:Совет 2. Если вы оставляете заявку на подбор репетитора, то в поле «ваши пожелания» укажите как можно больше подробностей и требований, чтобы мы могли найти самого подходящего вам репетитора. |
| Мы найдем репетитора в течение дня!Прислушайтесь к нашим советам, чтобы найти репетитора быстрее:Совет 3. Вопреки сложившемуся мнению, студент-репетитор очень хорошо справляется со своей задачей. Он более мобилен, цена ниже, и он с легкостью найдет общий язык с учеником. |
Источник: http://www.nado5.ru/e-book/atomnoe-yadro-zaryad-yadra
Совет 1: Как определить заряд ядра атома

В таблице Д.И.Менделеева, как в многоэтажном многоквартирном доме «живут» химические элементы, каждый из которых занимает свою собственную квартиру. Таким образом, каждый из элементов имеет определенный порядковый номер, указанный в таблице.
Нумерация химических элементов начинается слева направо, причем сверху. В таблице горизонтальные ряды называются периодами, а вертикальные столбцы – группами.
Это немаловажно, потому что по номеру группы или периода можно также дать характеристику некоторым параметрам атома .
Атом представляет собой химически неделимую частицу, но при этом состоящую из более мелких составных частей, к которым можно отнести протоны (положительно заряженные частицы), электроны (заряжены отрицательно) и нейтроны (нейтральные частицы).
Основная масса атома сосредоточена в ядре (за счет протонов и нейтронов), вокруг которого вращаются электроны. В целом атом электронейтрален, то есть в нем количество положительных зарядов совпадает с количеством отрицательных, следовательно, число протонов и электронов одинаково.
Положительный заряд ядраатома имеет место быть как раз за счет протонов.
Необходимо запомнить, что порядковый номер химического элемента количественно совпадает с зарядом ядраатома. Поэтому, чтобы определить заряд ядраатома необходимо посмотреть, под каким номером находится данный химический элемент.
Пример № 1. Определить заряд ядраатома углерода (С). Начинаем анализировать химический элемент углерод, ориентируясь на таблицу Д.И.Менделеева. Углерод находится в «квартире» № 6. Следовательно, он имеет заряд ядра +6 за счет 6 протонов (положительно заряженных частиц), которые располагаются в ядре. Учитывая, что атом электронейтрален, значит, электронов тоже будет 6.
Пример № 2. Определить заряд ядраатома алюминия (Al). Алюминий имеет порядковый номер — № 13. Следовательно, заряд ядраатома алюминия +13 (за счет 13 протонов). Электронов также будет 13.
Пример № 3. Определить заряд ядраатома серебра (Ag). Серебро имеет порядковый номер — № 47. Значит, заряд ядраатома серебра + 47 (за счет 47 протонов). Электронов также 47.
Совет 2: Как определить заряд ядра
Источник: https://how.qip.ru/others/sovet-1-kak-opredelit-zaryad-yadra-atoma
Атом

Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов.
Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер данного элемента в периодической системе химических элементов, е — величина элементарного электрического заряда.
Электрон — это мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К — оболочка, ближайшая к ядру.
Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов.
Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика.
Протоны — это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента — водорода. Число протонов в ядре равно Z.
Нейтрон — это нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа (см.
Периодическая система химических элементов). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
В атомном ядре имеется огромный запас энергии, которая высвобождается при ядерных реакциях. Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Переход в ядре протона в нейтрон может осуществляться двумя путями: либо из ядра испускается частица с массой, равной массе электрона, но с положительным зарядом, называемая позитроном (позитронный распад), либо ядро захватывает один из электронов с ближайшей к нему К-оболочки (К-захват).
Иногда образовавшееся ядро обладает избытком энергии (находится в возбужденном состоянии) и, переходя в нормальное состояние, выделяет лишнюю энергию в виде электромагнитного излучения с очень малой длиной волны — гамма-излучение. Энергия, выделяющаяся при ядерных реакциях, практически используется в различных отраслях промышленности.
Атом (греч. atomos — неделимый) наименьшая частица химического элемента, обладающая его химическими свойствами. Каждый элемент состоит из атомов определенного вида. В состав атома входят ядро, несущее положительный электрический заряд, и отрицательно заряженные электроны (см.), образующие его электронные оболочки.
Величина электрического заряда ядра равна Z-e, где е — элементарный электрический заряд, равный по величине заряду электрона (4,8·10-10 эл.-ст. ед.), и Z — атомный номер данного элемента в периодической системе химических элементов (см.). Так как неионизированный атом нейтрален, то число электронов, входящих в него, также равно Z. В состав ядра (см.
Ядро атомное) входят нуклоны, элементарные частицы с массой, примерно в 1840 раз большей массы электрона (равной 9,1·10-28 г), протоны (см.), заряженные положительно, и не имеющие заряда нейтроны (см.). Число нуклонов в ядре называется массовым числом и обозначается буквой А.
Количество протонов в ядре, равное Z, определяет число входящих в атом электронов, строение электронных оболочек и химические свойства атома. Количество нейтронов в ядре равно А—Z. Изотопами называются разновидности одного и того же элемента, атомы которых отличаются друг от друга массовым числом А, но имеют одинаковые Z.
Таким образом, в ядрах атомов различных изотопов одного элемента имеется разное число нейтронов при одинаковом числе протонов. При обозначении изотопов массовое число А записывается сверху от символа элемента, а атомный номер внизу; например, изотопы кислорода обозначаются:
Размеры атома определяются размерами электронных оболочек и составляют для всех Z величину порядка 10-8 см. Поскольку масса всех электронов атома в несколько тысяч раз меньше массы ядра, масса атома пропорциональна массовому числу.
Относительная масса атома данного изотопа определяется по отношению к массе атома изотопа углерода С12, принятой за 12 единиц, и называется изотопной массой. Она оказывается близкой к массовому числу соответствующего изотопа.
Относительный вес атома химического элемента представляет собой среднее (с учетом относительной распространенности изотопов данного элемента) значение изотопного веса и называется атомным весом (массой).
Атом является микроскопической системой, и его строение и свойства могут быть объяснены лишь при помощи квантовой теории, созданной в основном в 20-е годы 20 века и предназначенной для описания явлений атомного масштаба. Опыты показали, что микрочастицы — электроны, протоны, атомы и т. д.
,— кроме корпускулярных, обладают волновыми свойствами, проявляющимися в дифракции и интерференции. В квантовой теории для описания состояния микрообъектов используется некоторое волновое поле, характеризуемое волновой функцией (Ψ-функция). Эта функция определяет вероятности возможных состояний микрообъекта, т. е.
характеризует потенциальные возможности проявления тех или иных его свойств. Закон изменения функции Ψ в пространстве и времени (уравнение Шредингера), позволяющий найти эту функцию, играет в квантовой теории ту же роль, что в классической механике законы движения Ньютона.
Решение уравнения Шредингера во многих случаях приводит к дискретным возможным состояниям системы. Так, например, в случае атома получается ряд волновых функций для электронов, соответствующих различным (квантованным) значениям энергии.
Система энергетических уровней атома, рассчитанная методами квантовой теории, получила блестящее подтверждение в спектроскопии. Переход атома из основного состояния, соответствующего низшему энергетическому уровню Е0, в какое-либо из возбужденных состояний Ei происходит при поглощении определенной порции энергии Еi — Е0.
Возбужденный атом переходит в менее возбужденное или основное состояние обычно с испусканием фотона. При этом энергия фотона hv равна разности энергий атома в двух состояниях: hv= Ei— Еk где h — постоянная Планка (6,62·10-27 эрг·сек), v — частота света.
Кроме атомных спектров, квантовая теория позволила объяснить и другие свойства атомов. В частности, были объяснены валентность, природа химической связи и строение молекул, создана теория периодической системы элементов.
Источник: http://www.medical-enc.ru/1/atom.shtml
Как определить заряд ядра?
Как вы помните, такие вещи, как ядра атомов, обычно изучает химия, но и физика в том числе. Ведь есть ядерная физика, которая изучает ядро атома, ведь именно изучению ядра физикой было установлено, что ядро имеет способность делиться, и, таким образом, можно будет получить ядерную энергию. Когда был открыт атом, то считалось, что эта частица является неделимой.
Как установили, молекула состоит из атомов. Вот и решили, что атом уже не является неделимым, и всё состоит из атомов. Отсюда и название частицы «атом», ибо с греческого языка переводится, как «неделимый». Но потом уже доказали, позже, что атом в свою очередь тоже имеет в себе частицы. Это, электроны, протоны и нейтроны, которые в сущности и составляют заряд ядра, то есть.
частицами, которые и составляют это ядро.
Эрнест Резерфорд доказал, что можно заставить одно вещество превращаться в другое, когда поставил опыт, при котором из кислорода получил азот. Это был один из первых шагов, который произвёл триумф в науке.
Ну, не это ли философский камень, спрашивали в то время.
Вот с этого момента и пошли поиски в направлении того, чтобы найти способы получения новой энергии, которая на сегодняшний день составляет самую наиважнейшим звеном в цепи цивилизации.
Как я уже сказал вам выше, есть такое понятие, как заряд ядра, и уже сказал о частицах, из которых состоит атом.
так вот, что же касается определения заряда ядра химического элемента, то предлагаю вам открыть таблицу Менделеева. Дело в том, что порядковый номер указывает на заряд ядра.
Желаю успеха!
Ответил Валентин 1 месяц назад
Источник: http://qalib.ru/a/kak-opredelit-zaryad-yadra
Большая Энциклопедия Нефти и Газа

Cтраница 1
Положительный заряд ядра атома, а также число электронов атома численно равны порядковому ( атомному) номеру элемента. По мере увеличения атомного номера химические свойства элементов периодически повторяются. [1]
Положительные заряды ядра атома и отрицательные заряды электронов, взаимно уравновешивая друг друга, составляют атом. [2]
Положительный заряд ядра атома этого элемента, естественно, также равен 101 единице. [3]
Положительный заряд ядра атома численно равен его порядковому номеру в периодической системе. Таким образом, число электронов, равное числу положительных зарядов ядра атома, численно равно также порядковому номеру элемента. [4]
Положительные заряды ядер атомов аргона ( 18), калия ( 19), кобальта ( 27), никеля ( 28), теллура ( 52) и иода ( 53) точно совпали с порядковыми номерами этих элементов в таблице Менделеева. [5]
Величинуположительного заряда ядра атома элемента определяют опытным путем. Наименьшее ее значение, равное единице, получено для водорода. Следовательно, вокруг ядра атома водорода вращается один электрон.
Определены заряды ядер атомов и других элементов. Так, величина положительного заряда ядра атома магния 12; следовательно, вокруг его ядра вращается 12 электронов.
Величина положительного заряда ядра атома фосфора 15; следовательно, вокруг его ядра вращается 15 электронов. [6]
Величинуположительного заряда ядра атома элемента определяют опытным путем. Наименьшее ее значение, равное единице, получено для водорода. Следовательно, вокруг ядра атома водорода вращается один электрон.
Определены заряды ядер атомов и других элементов. Так, величина положительного заряда ядра атома магния 12; следовательно, вокруг его ядра вращается 12 электронов.
[7]
Чему равенположительный заряд ядра атома. [8]
С ростомположительного заряда ядра атомов в периоде растет способность их к присоединению электронов. [9]
| Сравнительные размеры [ IMAGE ] Схема образования по. [10] |
Вертикальной чертой отделенположительный заряд ядра атома, а скобками условно обозначены отдельные электронные слои. Цифра перед скобкой указывает на количество электронов в данном слое. [11]
Вмалых периодахс ростомположительного заряда ядер атомов возрастает число электронов на внешнем уровне ( от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода ( кроме первого периода) находится щелочной металл, затем металл и — ческие свойства постепенно ослабевают и усиливаются свойства неметаллические. [12]
Таким образом, числоположительных зарядов ядра каок-дого атома, а также число вращающихся вокруг ядра электро — нов равны порядковому номеру элемента. [13]
Смещенные электроны образуют сположительными зарядами ядер атомов пары связанных друг с другом электрических зарядов, которые называются упругими диполями. Также мгновенно упругие диполи исчезают, если диэлектрик — ( конденсатор) выключить из-под напряжения. Процесс образования упругих диполей называется электронной поляризацией. Этот вид поляризации происходит у всех диэлектриков. [15]
Страницы: 1 2 3 4
Источник: http://www.ngpedia.ru/id33136p1.html
__________________________________________novpedkolledg2.ru
Заряд ядра как показатель уровня сложности (развития) атома
Согласно современным научным представлениям все вещества состоят из атомов.Что же является основной, определяющей характеристикой атома, от которой зависят его химические свойства? Дмитрий Менделеев предположил, что это атомная масса. Расставив карточки с химическими элементами в порядке возрастания атомной массы, он увидел некую закономерность, которую оформил в виде периодической таблицы химических элементов, носящую по сей день его имя.
Увидев, что в отдельных случаях более тяжелый элемент предшествует более легкому - таковы, например, кобальт и никель, Менделеев переформулировал периодический закон так: "Свойства простых тел находятся в периодической зависимости от атомного номера элемента". При этом физический смысл атомного номера был не ясен. С этим разобрался Мозли, изучая рентгеновские характеристические спектры. Оказалось, что атомный номер численно равен заряду ядра. С тех пор периодический закон формулируют так: "Свойства простых тел находятся в периодической зависимости от зарядов ядер".
Что такое заряд ядра? Это количество протонов в ядре атома. Чем больше в ядре протонов, тем сложнее структура атома.
Каждый атом представляет собой некую «индивидуальность», так же как, например, люди в человеческом обществе. Так же как люди с похожими свойствами и уровнем развития образуют некие социальные группы, так и атомы со близкими числовыми характеристиками (количеством протонов) образуют химические вещества с одинаковыми свойствами. И мы присваиваем такой группе какое-нибудь название, например, хром. Причем в эту группу может входить множество изотопов, т.е. разновидностей атомов с разной атомной массой. Например, у хрома известно 28 изотопов, масса которых варьируется от 42,00643 до 66,97955 а.е.м. Тогда как у соседних элементов атомные массы таковы: у ванадия – 50,942, у марганца – 54,938.
Таким образом, мы видим, что свойства химических элементов зависят именно от количества протонов, а не от атомной массы.
Что же мы видим? Атом состоит из отрицательных электронов, нейтральных нейтронов и положительных протонов. Атом всегда стремится к состоянию нейтральности, поэтому увеличение количества электронов сопровождается увеличением количества протонов в ядре. Если же этого не происходит, то атом становится химически более активным, т.е. стремится вступать в такие химические связи, которые образовывали бы электрически нейтральные сложные молекулы.
Т.е. у атома есть выбор – либо усложнять свою внутреннюю структуру, чтобы добиться гармонии, равновесия с внешним миром, либо образовывать сложные химические элементы, объединяясь с другими неуравновешенными атомами.
Усложнение внутренней структуры означает увеличение количества протонов и продвижение вверх по периодической таблице Менделеева. Т.е. атом становится уже другим химическим элементом. Именно этого превращения атомов мечтали добиться древние алхимики, называя его трансмутацией.
Таким образом, количество протонов можно считать показателем «уровня развития» атома, его положение в иерархии химических элементов.
А что же такое атомная масса? На какие свойства химического элемента она влияет?
Масса - это гравитационная характеристика элемента. Здесь хороша аналогия с гравитационным ускорением планеты. У каждого небесного тела есть своя гравитационная характеристика, которая и задает её свойства (размер, плотность, массу, температуру, положение в пространстве относительно других тел и т.д.). У Земли это число g = 9,80665 м/с.
Чем больше масса, тем более «материализован», плотен объект. И наоборот – чем меньше масса, тем более воздушен, эфемерен объект.
Будем считать, что атом обладает неким минимальным сознанием, т.е. возможностью выбора – быть в большей степени волной или материальной частицей. Чем больший выбор в пользу материального мира она делает, тем большей массой обладает.
Распределение массы тоже зависит от уровня сложности атома. Большая плотность означает простую структуру, а больший объем - сложную структуру вещества.
maxpark.com
Строение атома
Существованием атомов удалось объяснить не только поведение металлов, но и вообще все наблюдаемые в окружающем нас мире физические и химические процессы.
Но что такое сам атом? Каково строение его? Какие силы действуют внутри атома?
Этих вопросов никто не ставил, пока не было открыто, что атом может распадаться. Тогда ученым поневоле пришлось задуматься над его строением.
Физики создали несколько «моделей» атома. Лучшей из них, позволившей истолковать множество явлений, была модель английского физика Резерфорда.
Резерфорд считал, что атом — подобие планетной системы; в центре его находится тяжелое положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг ядра обращаются отрицательно заряженные легкие частицы — электроны.
Заряд ядра по величине равен заряду всех электронов, удерживаемых его притяжением. Электроны очень быстро обращаются вокруг ядра, не падая, на него по той же причине, по которой удерживаются на своих орбитах планеты, обращающиеся вокруг Солнца.
На этом, однако, и кончалось сходство мёжду атомом и солнечной системой. Оказалось, что электроны, в отличие от планет, могут находиться только на определенных расстояниях от ядра. Они образуют так называемые электронные «оболочки». В каждой из оболочек может находиться не более определенного для нее количества электронов.
Эти законы, управляющие миром атомов, непонятны с точки зрения обычной, или классической, механики. Но все-таки ученым удалось воспроизвести явление, подобное образованию электронных оболочек.
На воду в широкой чашке было пущено несколько поплавков с магнитиками, обращенными вверх одним и тем же полюсом. Отталкиваясь друг от друга, магнитики рассеялись по поверхности воды. Они изображали в опыте электроны.
Затем невысоко над водой был помещен сильный магнит, обращенный вниз другим полюсом. Он играл роль атомного ядра. Под влиянием его притяжения магнитики-электроны выстроились под ним кольцом.
Когда был пущен еще один магнитик, он занял место в этом же кольце. То же произошло и с другими. Но затем новые поплавки с магнитиками, как бы не «поместившись» в кольце, начали строиться вне его, образуя новую кольцеобразную «оболочку».
Нечто подобное происходит и в мире атомов.
Электроны, притягиваемые положительно заряженным ядром, обращаются вокруг него. На ближайшей орбите «помещаются» только два электрона. Если ядро несет на себе более двух зарядов, то электроны размещаются и на второй орбите, где может «поместиться» не более 8 электронов. У атомов, ядро которых несет более 10 зарядов, электроны начинают заполнять третью орбиту, могущую «вместить» не более 18 электронов, и так далее (число электронов, заполняющее любую возможную орбиту, может быть найдено по формуле 2·n2, где n — номер орбиты).
Атом оказался сложной системой, но его ядро, как доказало дальнейшее изучение, — не просто сплошной шарик. В этом ученые убедились, сравнивая заряды и массы атомных ядер различных веществ.
Ядро атома водорода — протон — несет на себе один положительный заряд. Можно было бы думать, что атомные ядра остальных веществ также состоят только из этих частиц. Например, атомное ядро углерода, несущее на себе 6 положительных зарядов, должно состоять из 6 протонов, однако оно в 12 раз тяжелее атомного ядра водорода. У других же веществ несоответствие еще больше: атомное ядро хрома обладает 24 зарядами, но в 52 раза тяжелее протона.
Это несоответствие удалось объяснить, когда было открыто существование незаряженных частиц — нейтронов — с массой, почти равной массе протона. Стало очевидным, что атомное ядро углерода состоит из 6 протонов и такого же числа нейтронов. Поэтому оно, обладая 6 зарядами, в 12 раз тяжелее атомного ядра водорода. В атомном ядре хрома 24 протона и 28 нейтронов, и потому его масса в 52 раза больше массы протона. Самое же тяжелое атомное ядро (урана) состоит из 92 протонов и 146 нейтронов.
Позднее удалось установить, что существуют вещества, атомные ядра которых имеют одинаковый заряд, но разную массу. Их назвали изотопами. Например, кроме обычного урана с атомным весом 238, существует уран, атомное ядро которого только в 235 раз тяжелее протона. Так как заряд их атомных ядер одинаков, то разница только в числе нейтронов.
Протоны и нейтроны удерживаются в ядре силами связи, природа которых еще мало известна. Эти силы при очень близком расстоянии между частицами значительно превосходят силу отталкивания между одноименными зарядами протонов. С увеличением же расстояния между частицами начинает преобладать сила отталкивания одноименных зарядов.
Если в самой внешней электронной оболочке атома не более 2—3 электронов, то они слабо связаны с ним и могут сравнительно легко отделиться.
Заряд электронных оболочек по величине равен заряду ядра. Поэтому атом в целом — нейтральное тело. Но если он потеряет один или несколько электронов, то заряд ядра становится больше, чем у его электронных оболочек. Атом в целом приобретает положительный заряд, по величине равный заряду потерянных электронов. Он называется положительным ионом. Захватывая же в свою внешнюю оболочку лишний электрон, атом в целом приобретает отрицательный заряд. Положительный и отрицательный ионы притягиваются друг к другу и образуют молекулу сложного вещества.
Известно, однако, что водород, кислород и многие другие вещества также состоят из молекул. Как же их нейтральные атомы могут соединиться в молекулу?
Эта загадка уже разрешена физиками.
При сближении нейтральных атомов происходит то же, что наблюдается при приближении наэлектризованной трением стеклянной палочки к сухому шарику из сердцевины бузины: как известно, он притянется к стеклянной палочке.
Предположим, что два нейтральных атома сблизились настолько, что между ними возникает взаимодействие. При этом ядра атомов и электроны под влиянием взаимного притяжения несколько сблизятся между собой. Поэтому сила притяжения между ними, изменяющаяся обратно пропорционально квадрату расстояния, увеличится.
Части же атомов, заряженные одинаковым электричеством, под влиянием взаимного отталкивания немного удалятся друг от друга. Значит, сила отталкивания между ними немного уменьшится. В результате сила притяжения между нейтральными атомами получит перевес над отталкиванием и они притянутся друг к другу.
Предположим, что сблизились два атома водорода. У каждого из них по одному электрону. Каждое из ядер действует на оба электрона. Под влиянием их притяжения каждый из электронов начинает двигаться по очень сложной орбите вокруг то одного, то другого из них.
Ядра атомов не могут сблизиться до соприкосновения. Этому мешает взаимное отталкивание их одноименных зарядов. Но они и не могут удалиться друг от друга, так как их связывает притяжение электронов.
Так образуется молекула водорода.
Пока атомы принимались просто за шарообразные частицы, молекулы изображались двумя прижатыми друг к другу шариками, приплюснутыми в месте соприкосновения. В некоторых случаях можно удовлетвориться такой примитивной моделью.
В действительности же молекула водорода вовсе не два сблизившихся атома. Она представляет собой систему из двух ядер и двух коллективизированных, или «обобществленных», электронов. Очевидно, что в первой модели шарик — воображаемая частица с поперечником, равным радиусу орбиты электрона.
Теперь можно понять, что удерживает в «упаковке» атомы металлов.
У атома металла во внешней оболочке 1—3 электрона, слабо связанных с его ядром. Вещества, имеющие более заполненную внешнюю электронную оболочку, теряют металлические свойства.
Когда конденсируются металлические пары или кристаллизуется металлический расплав, происходит то же, что и при образовании молекулы: внешние электроны атомов металла, слабо связанные с ними, отрываются и «обобществляются». Атомы становятся положительными ионами, взаимно отталкивающими друг друга. Освободившиеся же электроны «блуждают» между ними, обращаясь по сложным орбитам вокруг лежащих по соседству ионов. Они-то и связывают взаимно отталкивающиеся ионы металлов.
Кристалл металла — система плотно упакованных положительных ионов, связанных обращающимися между ними свободными электронами. Притяжение к этим электронам уравновешивает взаимное отталкивание положительных ионов. Равновесие между этими силами притяжения и отталкивания определяет прочность металла.
Каковы же по величине силы, действующие внутри атомов и молекул?
Предположим, что удалось бы извлечь положительные заряды ядер и отрицательные заряды электронов всех атомов одного грамма водорода. Если бы сосредоточить положительные заряды в одной точке, а отрицательные заряды в другой на расстоянии 1 сантиметра, то они взаимно притягивались бы с силой порядка 1029 дин, или 1020 тонн. Эта сила в десятки раз превосходит силу притяжения Солнцем земного шара.
Проникнув в тайну строения вещества, ученые могли уже объяснить, что происходит со сталью и стеклом при закалке.
Схематическое изображение молекул, если принимать атомы за сплошные шарики: 1 — молекула кислорода; 2 — молекула воды; 3 — молекула углекислого газа.
www.stroitelstvo-new.ru
Заряд ядра, теория и примеры задач
Определение и заряд ядра
Заряд ядра (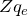 ) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре.
) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре. 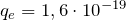 Кл — заряд протона, который равен по величине заряду электрона.
Кл — заряд протона, который равен по величине заряду электрона.
Еще раз подчеркнем, что заряд ядра определяет количество положительных элементарных зарядов, носителями которых являются протоны. А так как атом является в целом нейтральной системой, то заряд ядра определяет и количество электронов в атоме. А мы помним, что электрон имеет отрицательный элементарный заряд. Электроны в атоме распределяются по энергетическим оболочкам и подоболочкам в зависимости от их количества, следовательно, заряд ядра оказывает существенное влияние на распределение электронов по их состояниям. От количества электронов на последнем энергоуровне зависят химические свойства атома. Получается, заряд ядра определяет химические свойства вещества.
В настоящее время принято обозначать различные химические элементы следующим образом: 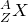 , где X – символ химического элемента в периодической таблице, который соответствует заряду
, где X – символ химического элемента в периодической таблице, который соответствует заряду 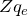 .
.
Элементы, у которых равны Z, но разные атомные массы (A) (это означает, что в ядре одинаковое число протонов, но разное количество нейтронов) называют изотопами. Так, водород имеет два изотопа: 11H-водород; 21H-дейтерий; 31H-тритий
Существуют устойчивые и неустойчивые изотопы.
Ядра, обладающие одинаковыми массами, но разными зарядами называются изобарами. Изобары в основном, встречаются среди тяжелых ядер, причем парами или триадами. Например, 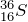 и
и 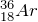 .
.
Первым косвенное измерение заряда ядра сделал Мозли в 1913 г. Он установил связь между частотой характеристического рентгеновского излучения (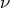 ) и зарядом ядра (Z):
) и зарядом ядра (Z):
![Rendered by QuickLaTeX.com \[\sqrt{\nu}=CZ-B \qquad (1)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-88658a719a84edead4ade60af2ecc0be_l3.png)
где C и B постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра был определен Чедвиком в 1920 г. при исследовании рассеяния ядер атома гелия на металлических пленках.
Состав ядра
Ядро атома водорода 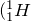 ) называется протоном. Масса протона равна:
) называется протоном. Масса протона равна:
![Rendered by QuickLaTeX.com \[m_p=1,67\cdot {10}^{-27}\left(kg\right)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7428956bc6dacdaa8e6e5e8f479963ec_l3.png)
Ядро состоит из протонов и нейтронов (вместе их называют нуклонами). Нейтрон был открыт в 1932 г. Масса нейтрона очень близка к массе протона. Нейтрон электрического заряда не имеет.
Сумму количества протонов (Z) и числа нейтронов (N) в ядре называют массовым числом A:
![Rendered by QuickLaTeX.com \[A=Z+N \qquad (2)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c03d7dde1c134bc5e91ff43171328557_l3.png)
Поскольку массы нейтрона и протона очень близкие, каждая из них равна почти атомной единице массы. Масса электронов в атоме много меньше, массы ядра, поэтому считают, что массовое число ядра приблизительно равно относительной атомной массе элемента, если округлить его до целого.
Примеры решения задач
ru.solverbook.com
Масса ядра атома - Справочник химика 21
Учитывая массы протона гпр = 1,6725-10 г и нейтрона Шп = 1,6749- 10" г, вычислить дефект массы в граммах и упаковочный эффект в электрон-вольтах для Не (масса ядра атома [c.31]Масса ядра атома некоторого изотопа равна 181 у. е. В электронной оболочке атома содержится 73 электрона. Сколько [c.30]
Ядра атомов отдельных элементов образуются соединением разных количеств протонов и нейтронов. Например, в состав ядра атома хрома входят 24 протона и 28 нейтронов. Всего указанных частиц в ядре 24-f-28=52. Так как масса каждой частицы (т. е. и протона и нейтрона) равна единице, то масса ядра атома хрома составит 52 к. е. Масса атома практически сосредоточена в ядре. Таким образом, и атомный вес хрома должен быть близок к величине 52 к. е., что и имеет место в действительности. [c.204]
Масса ядра атома немного меньше суммы масс протонов и нейтронов, так как при объединении протонов и нейтронов в атомное ядро выделяется большое количество энергии, которое, согласно уравнению (1.1), ведет к так называемому дефекту массы (приблизительно 1% массы). [c.394]ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — совокупность атомов с одинаковыми зарядами ядер и электронными орбиталями. Многие элементы состоят из нескольких изотопов с одинаковыми зарядами ядер и электронными орбиталями, ио различными атомными массами. Ядра атомов изотопов содержат одинаковое число протонов. Уже открыто в природе и получено искусственно 105 Э. х. Взаимосвязь и закономерность в свойствах Э. х. отражает периодическая система элементов Д. И. Менделеева. [c.292]
Масса ядра атома лишь приближенно равна сумме масс протонов и нейтронов, образующих ядро. Если, приняв во внимание точные величины масс протона и нейтрона, подсчитать, чему должны равняться массы различных ядер, то получается некоторое расхождение с величинами, найденными экспериментальным путем. [c.104]
Если принять, что масса ядра атома бесконечно велика по сравнению с массой электрона (ядро неподвижно), то согласно квантовомеханическому расчету постоянная Ридберга Roo = = (109737,3143 0,0010) см-. [c.45]
В химии атомное ядро принято считать точкой, которая обладает положительным зарядом - -2 (в единицах электрического заряда Хе составляет 1,6022-10 2 Кл) и массой, выражаемой массовым числом А (1,6606-10- А кг). Одиако действительная масса ядра атома несколько отлична от этой величины, к тому же ядро не является точкой, а представляет собой частицу, имеющую собственную структуру. Поскольку известно, что структура ядра оказывает влияние на электронное состояние, то имеет смысл рассмотреть вкратце общую картину строения атомного ядра. [c.48]
Целое число, которое округленно выражает массу ядра атома элемента в кислородных единицах, получило название массового числа. [c.54]
Этой величиной можно воспользоваться для очень точного вычисления отношения массы электрона к массе ядра атома водорода т1М + по уравнениям [c.134]
Напомним, что рассматриваемая реакция (п, у) не вызывает существенного изменения массы ядра атома мишени. [c.240]
На самом деле масса ядра атома гелия равна 4,00260 у. е., т. е. на [c.44]
На рис. 4.3 показано также ядро атома кислорода, состоящее из восьми протонов и восьми нейтронов. Масса ядра атома кислорода равна приблизительно 16 единицам массы. [c.90]
Положительно заряженные частицы с массой ядра атома водорода, равной 1,67-10 г, называются протонами. [c.13]
Таким образом, было обнаружено, что в состав атомного ядра входят протоны и нейтроны (их называют нуклонами). Ядра атомов, различных элементов, состоят из различного количества нейтронов и протонов. Масса ядра складывается из суммы входящих в нега масс протонов и нейтронов, а заряд равен количеству протонов. Например, масса ядра атома гелия, равная 4, складывается из двух протонов и двух нейтронов (рис. 22 обозначения 1 — протон, 2 — электрон 3 — нейтрон). Его заряд - -2. [c.79]
Выделение огромного количества энергии при ядерных превращениях объясняет и так называемый дефект массы. Ядро атома гелия, как уже говорилось, состоит из двух протонов и двух нейтронов. Если сложить массу двух протонов (2-1,00757) и двух нейтронов (2-1,00893), то получится 4,03300. Атомная масса гелия 4,00280. Разница составляет 0,03020, т. е. масса гелия на 0,03020 меньше, чем сумма масс двух протонов и двух нейтронов. Это уменьшение массы называется дефектом массы. Его можно объяснить с помогцью формулы Эйнштейна, установившего эквивалентность массы и энергии [c.84]
Здесь, однако, нет противоречия с законом сохранения массы. Процесс образования а-частиц происходит практически мгновенно, так что в момент образования они обладают всей энергией и всей массой ядра атома лития и протона, но тогда масса каждой а-частицы будет равна 4,01315 ат. ед. м., что превышает ее массу покоя на [c.19]
Масса ядра атома равна точному значению массы атома данного изотопа минус масса электронов. Например, масса ядра атома гелия ( t-частицы) равна 4,0039—2-0,00055 = 4,0028. [c.468]
Эта возможность обусловлена тем, что электронные процессы характеризуются обычно значительно более высокими частотами, чем колебательные движения атомов, а последние обладают несколько большими частотами, чем вращательные. Причиной таких различий является то, что масса ядра атома в тысячи и десятки тысяч раз больше массы электрона. В результате этого электронное состояние молекул устанавливается за такие короткие промежутки времени, в течение которых изменения состояния ядер еще не смогут произойти с другой стороны, за период, необходимый для того, чтобы молекула один раз повернулась вокруг своей оси, она совершает десятки колебаний. Частоты, характеризующие изменения электронных состояний, имеют порядок 10 ООО см и относятся к ультрафиолетовой и видимой части спектра . Частоты, характеризующие изменения колебательных состояний атомов, имеют порядок 1000 сл" (близкая инфракрасная, т. е. более коротковолновая инфракрасная область). Изменения вращательных состояний молекул характеризуются частотами 10—100 см (далекая инфракрасная, т. е. более длинноволновая инфракрасная область). [c.40]
Заряд ядра тория 90, а атомная масса 232 у. е. При выбрасывании одного нейтрона п (масса — 1, заряд — 0) масса ядра атома тория уменьшается на единицу, заряд ядра остается прежним. При выбрасывании ядра ксенона масса уменьшаетсн еще на 139 единиц, а заряд— на 54. Второй осколок должен иметь массу 92 у. е., а заряд ядра 36. Это изотоп криптона збКг . [c.107]
Установлено, что величина изотопного эффекта связана с различиями в массах атомов изотопов данного элемента между собой чем больше это различие, тем сильнее выражен изотопный эффект. Так, относительные различия масс изотопов водорода велики масса атома дейтерия составляет 200%, а трития —300% от массы атома протия, и изотопный эффект максимален именно у водорода. Различие в массах атомов изотопов РЬ и РЬ о составляет всего лишь около 1 %, и изотопный эффект в этом случае выражен очень слабо. Вообще величина изотопного эффекта резко убывает с ростом массы ядра атома. У тяжелых элементов этот эффект становится незначительным. [c.25]
Рассмотрим некоторые конкретные примеры. Ядро атома лития при соударении с протоном образует при известных условиях две а-частицы (два ядра атома гелия). Если сравнить массу покоя начальных и конечных частиц, то они окал утся неодинаковыми сумма собственных масс ядра атома лития и протона равна 8,0263 ат. ед. м. (атомных единиц массы), а сумма собственных масс двух ядер гелия — 8,0078 ат. ед. м [c.19]
Рассчитаем теперь энергию образования ядра атома гелия. Сумма масс двух протонов и двух нейтронов равна 4,0332 (теоретическая величина). Но действительная масса ядра атома гелия, как показывает масс-спектрометрический анализ, составляет величину 4,0017. Дефект массы, таким образом, ра- вен 0,0315. Умножая это значение на энергетический эквивалент х одного грамма массы, получаем й громадную величину — 693 млн р ккал. Таким образом, при ядер-ном синтезе гелия выделяется больше энергии, чем в рассмотренном выше примере синтеза л юмные номера дейтерия. В связи с этим большой интерес представляет изме- Рис. ПЛ. Кривая дсффекюв масс нение в ряду химических элементов величии дефектов масс, отра-, [c.211]
Решение задачи об атоме водорода аналогично обсуждавшемуся выше случаю жесткого ротатора. Аналогия заключается в том, что накладываемое при рассмотрении жесткого ротатора условие постоянства расстояния между двумя частицами в случае атома водорода заменяется условием кулоновского взаимодействия между ядром и электроном. Учитывая большое различие между массами ядра атома водорода (М) и электрона (т), можно считать, что ядро (протон) является центром тяжести этой системы, и предположить, что оно находится в начале координат. Вообще говоря, подобная ситуация имеет место в так называемых водородоподобных атомах —системах, состоящих из ядра с Z протонами и одного электрона [они представляют собой катионы с зарядом j-(Z— 1)е, см. рис. 3.8]. Для водородоподобного атома уравнение Шрёдингера в сферических координатах имеет намного более сложный вид, чем в декартовых координатах (см. табл. 3,1), и все же использование сферических координат позволяет, подобно тому как это было проделано в случае жесткого ротатора, легко разделить переменные г, 0, Ф. [c.37]
При изложении строения атома было упомянуто, что не все атомы. чакого-либо элемента обладают одной и той же массой ядра. Атомы с одинаковой внешней электронной структурой, но с разными массами ядер, называются изотопами. Любое различие между свойствами изотопов данного элемента обусловлено различием между мас- ами ядер, причем относительная разница в свойствах между изотопами с массой т и /я -и 1 зависит от величины т. Например, моменты инерции двухатомных молекул М М , и явля- [c.269]
Масса атома (точнее — его ядра) всегда приближённо равна це-локу кратному основной единицы массы, почти равной массе ядра атома водорода. Это целое число называют массовым числом (А). [c.302]
Резюме. Результаты, экспериментальная основа которых обсуждена в гл. I и Н, могут быть вкратце обобщены следующим образом. Все вещества состоят из атомов, в большинстве случаев связанных в молекулы. Атом состоит из положительно заряженного ядра, содержащего большую часть массы атома и окруженного отрицательно заряженными электронами. Электрон имеет заряд 4,80-электростатических единиц и массу 9,12-10 г. Масса ядра атома водорода, легчайшего из всех ядер, приблизительно в 1835 раз больше массы электрона у остальных ядер масса больше, причем наиболее тяжелые тяжелее водорода больше чем в двести раз. Заряд ядра равен сумме зарядов электронов, а весь атом в целом нейтрален. Атомный номер дает заряд ядра, выраженный в зарядах электронов, он также равен числу электронов в нейтральном атоме. Радиусы ядер имеют порядок 10 см, тогда как радиусы атомов, включая электронную оболочку, имеют порядок 10 сл/ (обычно от 2 до 3- 10 слсложное строение, но в этой книге оно не будет рассматриваться. [c.33]
chem21.info