Энциклопедия по машиностроению XXL. Водород хром
Водород в железе и других металлах, страница 11
|
|
|
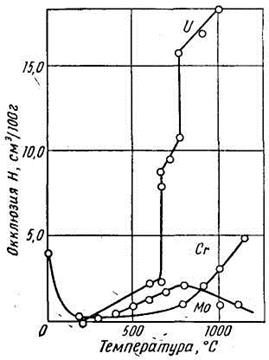
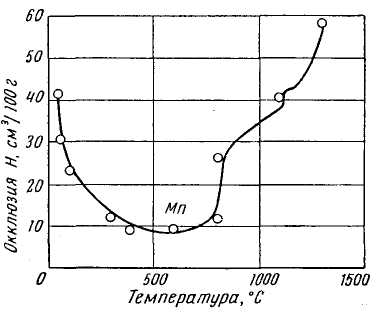
| Рис. 12. Окклюзия водорода хромом, молибденом и ураном | Рис. 13. Окклюзия водорода марганцем |
Атомы хрома и марганца обладают сложной электронной структурой и для них весьма характерны переменная валентность (2 - 6 для хрома и 2 - 7 для марганца) и легкость изменения валентных состояний. Как упоминалось выше, эндотермическая окклюзия водорода марганцем (правая ветвь) по абсолютному значению выше, чем для всех остальных металлов (никеля и др.), а экзотермическая (левая ветвь) — ниже, чем для всех остальных металлов (палладия, ванадия, циркония и других). В атоме более тяжелого элемента VI группы — вольфрама последовательность в заполнении электронных слоев не нарушается. Его окклюзионная способность по отношению к водороду в одинаковом температурном интервале, по-видимому, значительно, ниже, чем хрома и молибдена, что вполне соответствует его положению как элемента с большим зарядом и большим атомным весом. Оценить количественно растворимость водорода в вольфраме в пределах температур до 1500° С пока не удалось ввиду ее незначительности. Что касается последнего элемента группы — урана, то для него совершенно отчетливо установлена кривая эндотерми-ческой окклюзии с характерными скачками в точках аллотропических превращений и при температуре плавления. Таким образом, и для VI группы периодической системы сохраняется та же закономерность — уменьшение окклюзии водорода с увеличением атомного номера и атомного веса элемента.
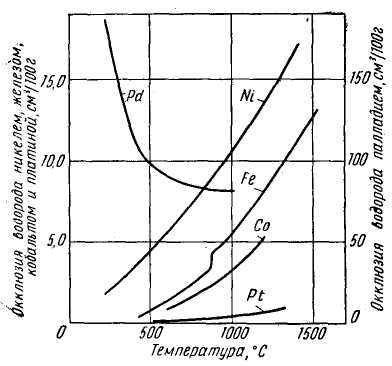
На рис. 14 показана температурная зависимость окклюзии водорода металлами VIII группы. Характер кривых, кроме системы водород — палладий, вполне аналогичен и уменьшение окклюзии при переходе от никеля к платине также очевидно. Отличный от других систем характер взаимодействия водорода с палладием объясняется отличительными особенностями строения его электронных оболочек.
|
|
| Рис. 14. Окклюзия водорода металлами VIII группы |
Проведенное сопоставление показывает, что окклюзия водорода металлами представляет собой процесс, строго подчиняющийся периодическому закону, и что степень окклюзии в пределах металлов одной группы периодической системы убывает по мере увеличения порядкового номера элемента. Отклонения могут и, по-видимому, должны быть только для радиоактивных элементов — урана, тория и др. Для всех остальных металлов исключений быть не может.
Диссоциация двухатомной молекулы водорода приводит к образованию двух электронейтральных атомов, однако лишь в течение совершенно незначительного промежутка времени, необходимого для их ионизации. Направление и степень ионизации атомов водорода определяются характером силового поля металлических атомов, которое в свою очередь зависит от атомной структуры данного металла и от внешних условий системы. В первом предельном случае при взаимодействии с металлом водород становится отрицательно заряженным ионом и образует химическое соединение с ионным типом связи, причем возникает новая решетка определенного химического соединения и полностью утрачиваются металлические свойства. Этот вид взаимодействия свойствен реакциям водорода с щелочными металлами: в результате процесса образуются ионные гидриды, в которых ион водорода имеет отрицательный заряд, а металл заряжен положительно. В другом, также предельном случае атом водорода ионизируется до протона, который входит в решетку металла, не нарушая ее. При этом тип и параметры кристаллической решетки не изменяются и металлический характер системы не утрачивается. Силовое поле металла обладает достаточной интенсивностью, поэтому протон водорода втягивается в электронные оболочки металлических атомов вплоть до самых глубоких уровней. Эндотермическая окклюзия водорода железом, никелем и другими металлами представляет собой именно этот, второй вид взаимодействия. Повышение температуры системы усиливает интенсивность силовых полей, что и приводит к повышению окклюзии водорода.
vunivere.ru
Хром — водород - Энциклопедия по машиностроению XXL
Испытание на газоны деление. По выделению водорода во время химической реакции металла покрытия с кислотой монтолщину покрытия. Так, хром выделяет водород под действием соляной кислоты. Толщину хромового покрытия можно вычислить, измерив время газовыделения соляной кислотой. Хромовое покрытие толщиной 0,25 мкм выделяет газ приблизительно 10 с при 20° С, покрытие из кадмия толщиной [c.144] Жидкий металл содержит в растворенном состоянии углерод, кремний, марганец, фосфор, серу, хром, алюминий, водород, азот, кислород и их соединения. Все компоненты жидкого металла находятся в атомарно-ионном состоянии н обладают большой кинетической энергией колебательного и поступательного движения. При тепловом взаимодействии с формой температура жидкого металла снижается и вследствие уменьшения растворимости из металла выделяются газы, количество которых зависит от исходных материалов и режима плавки. Например, при электроплавке выделяется водорода 0,00005—0,082%, азота 0,002—0,20%, кислорода 0,0008—0,1%- [c.45]В зависимости от состава материала и требований к свойствам готового изделия спекание проводят в водороде, диссоциированном аммиаке, эндогазе, аргоне или вакууме. Так, фильтры из титана спекают в вакууме, а из нержавеющих сталей и сталей, содержащих хром, - в водороде, подвергнутом глубокой очистке от кислорода и острой осушке, или в защитных засыпках, обеспечивающих поглощение кислорода (например, в засыпке из оксида алюминия, содержащей 15- [c.73]
Для систем лантана с мышьяком, висмутом, углеродом, кадмием, хромом. галлием, водородом, ртутью, азотом, кислородом, кремнием, натрием, кислородом и серой диаграмм не имеется, но есть отдель- [c.608]
Интерес, проявляемый к практическому использованию солей трехвалентного хрома для его электроосаждения, обусловлен большей экономичностью процесса и меньшей вредностью в производстве по сравнению с шестивалентными соединениями [3]. Однако осуществление процесса электроосаждения хрома из растворов трехвалентных соединений связано с преодолением ряда трудностей, обусловленных как сложностью химической природы растворов солей хрома, так и разнообразием реакций на катоде выделение хрома и водорода, восстановление трехвалентных ионов хрома до двухвалентных и т. д. [4]. Данные относительно вос- [c.149]
Элементы, понижающие температуру а Р-превращения, называются р-стабилизаторами. Они расширяют р-область (рис. 163, а). Такими элементами являются железо, молибден, тантал, ванадий, хром, марганец, водород. [c.281]
Этот раствор разрушает пленку и, проникая к поверхности металла, взаимодействует с ним. При этом содержащиеся в растворе ионы шестивалентного хрома восстанавливаются водородом до трехвалентных, что проявляется в изменении оранжевой окраски капли в зеленую. Чем больше толщина и чем меньше [c.49]
Газовое хромирование осуществляют следующим образом. Через реторту, где помещены феррохром (хром) и детали (рис. 116), пропускают смесь водорода и хлористого водорода или газообразный хлористый водород (хлор). В первом случае водород пропускают через концентрированную соляную кислоту и вытесненный хлористый водород вместе с водородом поступает в реторту, нагретую до 950—1000° С. При воздействии на феррохром (хром) хлористого водорода- образуется легкоиспаряющийся хлорид хрома [c.166]
Введение в сталь добавок хрома, титана, молибдена, ванадия, вольфрама и других элементов, способных образовывать сложные карбиды, более стойкие по отношению к водородной коррозии, чем цементит (РедС), повышает сопротивляемость стали обезуглероживанию. Насколько сильно препятствуют добавки, например хрома, диффузии водорода в металл, можно видеть из следующих данных проникновение водорода в углеродистую сталь (0,15% С) за один и тот же промежуток времени при отсутствии хрома состав- [c.138]
Количество водорода в электролитных осадках обычно незначительно например, в цинке оно равно 0,001—0,01 весовых процента, в олове 0,0005—0,0002 весовых процента. В металлах группы железа содержание водорода может достигнуть 0,1%, а в электролитически осажденном хроме содержание водорода доходит до 0,45 весовых процента. [c.104]
Углеродистая сталь промышленного производства — сложный по химическому составу сплав. Кроме основы — железа (содержание которого может колебаться в пределах 97,0— 99,5%), в ней имеется много элементов, наличие которых обусловлено технологическими особенностями производства (марганец, кремний), либо невозможность полного удаления их из металла (сера, фосфор, кислород, азот, водород), а также случайными примесями (хром, никель, медь и др.). [c.180]На свойства железоуглеродистых сплавов влияет наличие в них постоянных примесей (вредных — серы, фосфора, кислорода, азота, водорода полезных — кремния, марганца и др.). Эти примеси могут попадать в сплав из природных соединений (руд), например, сера и фосфор из металлического лома — хром, никель и др. в процессе раскисления — кремний и марганец. [c.14]
Тугоплавкие металлы (титан, ванадий, хром и др.) имеют высокую химическую активность в расплавленном состоянии. Они активно взаимодействуют с кислородом,азотом, водородом и углеродом. Поэтому плавку этих металлов и их сплавов ведут в вакууме или в среде защитных газов. [c.173]
Насыщающим веществом при термохромировании служит хлорид хрома, получающийся в результате применения хлористого водорода, который действует на хром или феррохром при высокой температуре. Процесс осуществляется по следующей реакции при температуре около 1000° С [c.322]Твердые растворы внедрения могут возникнуть только в тех случаях, когда диаметр атома растворенного элемента невелик. Поэтому твердые растворы этого типа получаются лишь при растворении в металле (например, в железе, молибдене, хроме и т. д). углерода (атомный радиус 0,077 нм), азота (0,071 нм), водорода (0,046 нм), т. е. элементов с малым атомным радиусом. Твердые растворы внедрения могут быть только ограниченной концентрации, поскольку число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки. Роль этого вида твердого раствора значительна в сталях и чугунах. [c.81]
Состав и количество вредных газов, пыли и испарений зависит от вида сварки, состава защитных средств (покрытий, флюсой, газов), свариваемого и электродного материалов. Количество сварочной пыли (аэрозоли) и летучих соединений при сварке составляет от 10 до 150 г на 1 кг расплавленного электродного металла. Основными составляющими являются окислы железа (до 70%), марганца, кремния, хрома, фтористые и другие соединения. Наиболее вредными являются хром, марганец и фтористые соединения. Кроме аэрозоли, воздух в рабочих помещениях при сварке загрязняется различными вредными газами окислами азота, углерода, фтористым водородом и др. [c.156]
Активационная поляризация определяет также кинетику осаждения или растворения металла. Она мала для таких металлов, как серебро, медь, цинк, но возрастает для металлов переходной группы, например железа, кобальта, никеля, хрома (см. табл. 4.1). Природа анионов электролита больше влияет на перенапряжение процессов разряда и ионизации металла, чем на реакцию выделения водорода. [c.53]
Установлено, что при увеличении содержания углерода прочность и твердость железа увеличиваются, то есть несмотря на то, что в стали содержится большое количество металлических и неметаллических элементов марганец, кремний, фосфор, сера, хром, никель, медь, азот, кислород или водород, решающую роль в превращении железа в сталь играет именно углерод [37]. Например, для стали У7А (содержание углерода 0,63- 0,73 %) предел прочности при растяжении 650 МПа, относительное удлинение 18 %, в отожженном состоянии НВ 180 [15]. [c.66]
В обычной атмосфере титан стоек по отношению к окислению до 400 - 500°С при более высоких температурах он проявляет большую реакционную способность к взаимодействию с кислородом, азотом и водородом. Можно значительно увеличить жаростойкость титана путем его легирования хромом и особенно алюминием и кремнием. [c.78]
Электропроводящие частицы (карбиды вольфрама, титана, хрома) в 1,5-3 раза уменьшают количество водорода в осадке, что связано с их деполяризующим действием и различной величиной перенапряжения водорода на дисперсных частицах и никелевом электроде. Меньше всего содержат никелевые осадки с карбидами титана, хрома, вольфрама, обладающими наибольшим деполяризующим эффектом (рис. 29). [c.108]
Из рассмотренных методов получения X. в. ч. только рафинирование электроли-тич. хрома в водороде при высоких темп-рах осуществлено в полупромышленных масштабах. Остальные методы не выходят за рамки лабораторных исследований. [c.418]
Согласно Сивертсу [ПО] поглощение водорода хромом в интервале 20—300 °С уменьшается с повышением температуры. При 250—300 °С абсорбция достигает минимального значения и дальнейшее повышение температуры сопровождается увеличением растворимости водорода в хроме. Растворимость водорода в хроме составляет [126] [c.433]
Защитную способность оксидных пленок, полученных анодированием алюминия и его сплавов, определяют капельной пробой с раствором, содержащим 25 мл НС1 (уд. вес 1,19), 3 г КгСггО,, 75 мл HgO. Этот раствор разрушает пленку и, проникая к поверхности металла, взаимодействует с ним. При этом содержащиеся в растворе ионы шестивалентного хрома восстанавливаются водородом до трехвалентных, что проявляется в переходе оранжевой окраски капли в зеленую. Чем больше толщина и меньше пористость пленки, тем больше времени пройдет до начала реакции металла с раствором и, следовательно, тем выше будет защитная способность оксидного слоя. Норму времени при контроле защитной способности [c.111]
Элементы, понижающие температуру а=ёьр-превра-щения, называются -стабилизаторами. Они расширяют -область (рис. 173,6). Такими элементахми являются железо, молибден, тантал, ванадий, хром, марганец, водород. [c.375]
Диффузионное хромирование в газовых средах осуществляется следующим образом. Через реторту, нагретую до 950—1050°, в которую помещается феррохром или хром и подвергаемые хромированию детали, пропускается смесь водорода и хлористого водорода, или хлор, или хлористый водород. При воздействии на феррохром или хром хлористого водорода происходит образование хлорида хрома ( r lj). При контакте с поверхностью стальных деталей из хлорида хрома вытесняется хром в атомарном состоянии, который и диффундирует в поверхность деталей. [c.257]
Обычными конструкционными материалами при воздействии водородсодержащих сред и температур не выше 300° С являются стали 20 и ЗОХМА. При более высоких температурах применяют легированные стали. В качестве легирующих добавок в углеродистые стали вводят элементы, способные образовать сложные карбиды, более стойкие по отношению к водородной коррозии, чем цементит РезС. Некоторые элементы (хром, титан, молибден, ванадий и др.), образуя такие карбиды, повышают сопротивляемость стали обезуглероживанию. В какой степени препятствуют добавки, напрнмер, хрома диффузии водорода в металл, можно [c.59]
Влияние трехвалентного хрома. Трахвалентный хром 1хромовом ангидриде и образуется в результате восстановительных процессов на катоде при электролизе наряду с протекающим выделением металлического хрома д водорода. Он, наконеп, часто вво- [c.307]
В перегреной сварочной ванне протекает ряд металлургических процессов испарение или окисление (выгорание) некоторых легирующих элементов, например углерода, марганца, кремния, хрома и др., и насыщение расплавленного металла кислородом, азотом и водородом из окружающего воздуха. В результате возможно изменение состава сварного шва по сравнению с электродным и основным металлом, а также понижение его механических свойств, особенно вследствие насыщения шва кислородом. Для обеспечения заданных состава и свойств шва в покрытие вводят легирующие элементы и элемеиты-раскислители. [c.190]
Насколько сильно пре . .тствуют добавки, например хро.ма, диффузии водорода в металл, можно видеть из следуюидпх данных проникновение водорода в углеродистую сталь (0,157о С) за один и тот же промежуток времени при отсутствии хрома составляет 0,9 мм, при содержании 1% Сг — 0,3 мм, а при содержании 5% Сг — 0,1 мм. На рис. 118 пока,зап.а зависимость глубины проникновения водорода в хромистую сталь от температуры газа и содержания хрома в металле. Карбиды хрома не [c.151]
На рис. 122 показано влияние содержания хрома на скорость коррозии хромистой стали при П35°С в парах нефти, содержащей различные количества сероводорода при 11,1 об.% водорода и давлении 1,23 Мн1м . Из приведенных данных видно, что скорость коррозии хромистых сталей увеличивается с ростом концентраций сероводорода в парах нефти и понижением содержания хрома в сталях. Скорость коррозии хромистых сталей в парах серы в интервале температур 500—800° С также увеличивается с ростом температуры и понижением соде()жания хрома (рис. 123). [c.156]
Очень эффективным катализатором конверсии является мелкий порошок гидрата окиси железа, хотя также эффективны юкислы других магнитных элементов, такие, как окись хрома, окиси железоникелевых сплавов. На практике значительные трудности вызывает требование полного отсутствия катализатора в опытах, где требуется совершенно неконвертированный нормальный водород. Наиболее эффективно в качестве катализатора использование гидрата окиси железа при его непосредственном контакте с жидким водородом. Скорость диффузии [c.154]
При катодной поляризации хрома, нержавеющих сталей и пассивного железа пассивность нарушается вследствие восстановления пленки пассивирующего оксида или пленки адсорбционного кислорода (в зависимости от принятой точки зрения на природу пассивности). К тому же, согласно адсорбционной теории, атомы водорода, образующиеся при разряде ионов Н+ на переходных металлах, стремятся раствориться в металле. Растворившийся в металле водород частично диссоциирован на протоны и электроны, а электроны способны заполнять вакансии d-уровня атомов металла. Следовательно, переходный металл, содержащий достаточное количество водорода, более не в состоянии хемосорбиро-вать кислород или пассивироваться, так как у него заполнены d-уровни. [c.98]
Эти кислоты можно получить в лаборатории, пропуская сероводород через воду, насыщенную SO . Для понимания механизма наблюдаемых разрушений следует учесть, что при протекании коррозионных процессов эти кислоты легко катодно восстанавливаются. В связи с этим политионовые кислоты действуют в качестве катодного деполяризатора, который способствует растворению металла по границам зерен, обедненным хромом. Еще одна форма влияния, возможно, заключается в том, что продукты их катодного восстановления (HjS или аналогичные соединения) стимулируют абсорбцию межузельного водорода сплавом, обедненным хромом. Под напряжением этот сплав, если он имеет ферритную структуру, подвергается водородной коррозии вдоль границ зерен. Аустенитный сплав в этих условиях устойчив. Показано, что наличие в морской воде более 2 мг/л серы в виде Na S либо продуктов катодного восстановления сульфитов SOg" или тиосульфатов SjO вызывает водородное растрескивание высокопрочных сталей с 0,77 % С, а та кже ферритных и мартенситных нержавеющих сталей 167]. Предполагают, что и политионовые кислоты оказывают аналогичное действие. [c.323]
В ряду напряжений никель отрицател ен по отношению к водороду, но положителен по отношению к железу. В отсутствие растворенного кислорода он реагирует с разбавленными неокислительными кислотами (например, h3SO4 и НС1) весьма медленно. Никель устойчив в деаэрированной воде при комнатной температуре в этих условиях продуктом коррозии является N1 (ОН)г. Никель пассивен во многих аэрированных водных растворах, однако пассивирующая пленка не столь устойчива, как, например, на хроме. (Фладе-потенциал никеля Ер = 0,2 В [1]). При контакте с морской водой на никеле наблюдается питтинго-вая коррозия. [c.359]
С азотом энергично взаимодействуют хром и ниобий. Охрупчи-вающее воздействие азота на ниобий меньше, чем водорода, однако пластичность азотсодержащего ниобия снижается при холодной прокатке показатели деформируемости снижаются с ростом содержания азота с 75% [для Nb+0,003—0,22 % (по массе) N2] до 10 % [Nb+0,73 % (по массе) N2]. [c.526]
Росту трещиностойкости и увеличению коррозионной прочности способствует введение хрома, молибдена, титана, которые формируют стойкие карбиды, измельчают зерно и уменьшают окклюзию водорода. Бор оказывает отрицательное влияние, что объясняется увеличением зерна, v > 1 > оляющим прокаливаемос ь стали и oo.iti чающи.ч с ок дясло каций. [c.39]
Как видно из таблицы, при электролитическом хромировании содержание водорода в покрытии (18,9 10 %) на порядок выше, чем в стали (1,6 10 %), т.е. практически водород адсорбируется преимущественно покрытием. Для основного металла характерно заметное уменьшение содержания водорода после термообработки при 473 К в течение 3 ч. Увеличение продолжительности термообработки приводит к росту градиента концентрации водорода вблизи границы сталь — хром. В се 5ово-дородсодержащей среде разряд водорода протекает на катодном хромовом покрытии, которое не препятствует диффузии водорода в сталь. [c.65]
mash-xxl.info
Список литературыГенератор кроссвордовГенератор титульных листовТаблица истинности ONLINEПрочие ONLINE сервисы |
| В нашем каталогеОколостуденческоеЭто интересно...Наши контакты | |||||
spisok-literaturi.ru