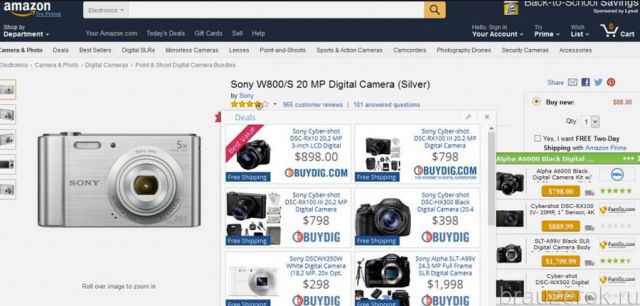
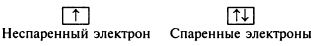Как определить валентные электроны? Валентные электроны хрома
Валентные электронные слои атомов | Задачи 188
Задача 188. Структура валентного электронного слоя атома элемента выражается электронной формулой: а) 5s25p4; б) 3d54s1. Определить порядковый номер и название элемента.Решение:а) Валентный электронный слой 5s25p4 указывает на то, что атом элемента имеет пять электронных энергетических уровней, значит, атом расположен в пятом периоде. Наличие на внешнем энергетическом уровне двух 5s- и четырёх 5p-электронов указывает на то, что данный элемент относится к семейству p-элементов, и расположен в шестой группе главной подгруппе периодической системы Д. И. Менделеева. В пятом периоде шестой группы находится элемент с порядковым номером 52 (теллур).
б) Электронная конфигурация валентного слоя 3d54s1 указывает на то, что атом находится в четвёртом периоде (n = 4), относится к d-элементам (наличие 3d-подуровня) и является элементом шестой группы побочной подгруппы. Такому состоянию соответствует элемент с порядковым номером 24 (хром).
Ответ: Te; Cr.
Задача. 189. Электронная структура атома описывается формулой: 1s22s22p63s23p63d64s2. Какой это элемент?Решение:Так как число электронов в атоме элемента равно его порядковому номеру в таблице Д. И. Менделеева, то для элемента с электронной структурой, описываемой формулой 1s22s22p63s23p63d64s2, порядковый номер равен 26 (общее число электронов равно 26). Под номером 26 в таблице Д. И. Менделеева находится железо.
Задача 190. Написать электронные формулы ионов: а) Sn2+; б) Sn4+; в) Мn2+; г) Сu2+; д) Сг3+; е) S2-.Решение:а) Электронная формула олова имеет вид: 1s22s22p63s23p63d104s24p64d105s25p2. Отдав два с 5p-подуровня атом, олова превращается в ион Sn2+, который имеет электронную формулу:
1s22s22p63s23p63d104s24p64d105s25p0
б) Атом олова, отдав четыре электрона, два с 5p-подуровня и два с 4s-подуровня, атом олова превращается в ион Sn4+. Электронная формула иона олова Sn4+ имеет вид: 1s22s22p63s23p63d104s24p64d105s05p0.
в) Электронная формула марганца имеет вид: 1s22s22p63s23p63d54s2. При отдаче двух электронов с 4s-подуровня, атом марганца превращается в ион Мn2+ с электронной формулой: 1s22s22p63s23p63d54s0
г) Атом меди имеет электронную формулу: 1s22s22p63s23p63d104s1. при отдаче одного электрона с 4s-подуровня и одного с 3d-подуровня атом меди превращается в ион Сu2+, электронная формула которого будет иметь вид: 1s22s22p63s23p63d9.
д) Атом хрома имеет следующую электронную формулу: 1s22s22p63s23p63d54s1. При отдаче одного электрона с 4s-подуровня и двух с 3d-подуровня атом хрома превращается в ион Сг3+, электронная формула которого будет иметь вид: 1s22s22p63s23p63d34s0.
е) Электронная формула атома серы имеет вид: 1s22s22p63s23p4. Присоединив два недостающих электрона на 3p-подуровень, атом серы превращается в ион S2-, электронная формула которого будет иметь вид: 1s22s22p63s23p6.
Задача 191. У элементов каких периодов электроны внешнего слоя характеризуются значением n + l = 5?Решение:Значение квантовых чисел n + l = 5 означает, что у элементов электроны внешнего слоя могут находиться на пятом энергетическом уровне и s-подуровне (5 + 0 = 5) или на четвёртом энергетическом уровне и p-подуровне (4 +1 = 5). Таким образом, у элементов IV и V периодов электроны внешнего слоя характеризуются значением n + l = 5.
Задача 192. Перечислить электронные аналоги среди элементов VI группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов.Решение:Электронными аналогами называют элементы, у которых валентные электроны расположены на орбиталях, описываемых формулой, общей для всех элементов. В периодической системе электронные аналоги входят в состав одной подгруппы.
Валентные электроны элементов главной подгруппы VI группы (кислород, сера, селен, теллур и полоний) описываются общей формулой ns2np4, а элементы побочной подгруппы VI группы (хром, молибден и вольфрам) - nd4ns2. У хрома и молибдена валентные электроны описываются формулой nd5ns1, что объясняется «провалом» (переходом электрона с наружного s-подуровня на d-подуровень).
Задача 193. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?Решение:Электронные конфигурации атомов хрома, серы, ванадия и фосфора имеют виды:+24Cr 1s22s22p63s23p63d54s1; +16S 1s22s22p63s23p4; +23V 1s22s22p63s23p63d34s2;+15P 1s22s22p63s23p3.
а) Атомы ванадия и фосфора содержат по пять валентных электронов, поэтому они расположены в пятой группе периодической системы химических элементов. На основании того, что валентными электронами атома серы являются наружные два 3s- и четыре 3p-электрона, фосфор расположен в главной подгруппе. У атома ванадия валентными электронами являются два 4s- и три 3d-электроны, ванадий расположен в побочной подгруппе.
б) Атомы хрома и серы содержат по шесть валентных электронов, поэтому они располо-жены в шестой группе периодической системы химических элементов. На основании того, что валентными электронами атома серы являются наружные два 3s- и три 3p-электрона, сера расположена в главной подгруппе. У атома хрома валентными электронами являются один 4s- и пять 3d-электроны, хром расположен в побочной подгруппе.
Задача 194. Почему медь имеет меньший атомный объем, чем калий, расположенный в той же группе и том же периоде?Решение:Зависимость атомного объёма от заряда атома (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома, что объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. В пределах подгруппы с увеличением Z атома, но самое существенное, с появлением нового электронного слоя, атомные объёмы возрастают.
Калий и медь являются элементами IV периода главной подгруппы. Количество электронных слоёв у атомов калия и меди одинаковое (4), а заряды имеют разное значение (+19K; +29Cu) и разное число электронов (K содержит 19 электронов, а Cu – 29). Поэтому электростатические силы взаимодействия в атоме меди будут значительно меньше, чем у калия. Следовательно, у элементов, расположенных в одном периоде и в одной группе периодической системы химических элементов, атомные объёмы уменьшаются с увеличением порядкового номера элемента. Так у меди атомный радиус имеет меньшее значение, чем у калия (r+29Cu = 129 нм; r+19K = 236 нм), потому что при большем значении Z и большем количестве электронов электростатическое взаимодействие больше, что приводит к сжиманию атома меди в большей степени, чем атома калия.
buzani.ru
Содержание
Вам понадобится
Инструкция
|
completerepair.ru
1.6 Проскок (провал) электронов
Проскок электрона - отступления от общей для большинства элементов последовательности заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем, что эти "нарушения правил" обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек "по правилам".
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d- подуровня за счёт проскока (или провала) электрона с внешнего s- подуровня на нижележащий (предвнешний) d- подуровень (закономерные проскоки).
Таблица 4 – АВЗ элементов, характеризующихся провалом электрона
| Элемент | Атомная валентная зона | |
| теоретическая | практическая | |
| Cu | 3d9 4s2 | 3d10 4s1 |
| Ag | 4d9 5s2 | 4d10 5s1 |
| Au | 5d9 6s2 | 5d10 6s1 |
| Cr | 3d4 4s2 | |
| Mo | 4d45s2 | 4d5 5s1 |
Теперь для этих элементов определим возможные валентные состояния.
Построим энергетическую диаграмму АВЗ для меди.
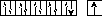
На этой диаграмме изображение s– электронов имеет чуть больший размер, чем d– электронов.
В таком состоянии медь одновалентна, так как присутствует только один неспаренный электрон. А на практике оказывается, что медь проявляет валентность, равную двум. Следовательно, возможно, вопреки правилу, перевести один проскочивший электрон с предвнешнего 3d– подуровня на внешний 4р– подуровень. В этом случае В*=2.
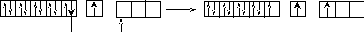
Поскольку остаётся ещё один неспаренный электрон на предвнешнем d– подуровне, то медь может быть, хотя и реже (так как этот электрон менее активен), трехвалентна.
Остальные 3d– электроны перевести на р– подуровень нельзя, поскольку это другой энергетический уровень.
Для золота характерна та же картина: В = 1; 2*; 3*. Отличие заключается в том, что этот элемент стоит в шестом периоде и, следовательно, имеет больший радиус. Поскольку электроны ядром удерживаются слабее, то их оторвать проще. Поэтому золото чаще всего трёхвалентно, так как отдаёт сразу все электроны.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице. Объясняется это строением электронной оболочки палладия- элемента, который стоит перед серебром. Дело в том, что палладий - единственный элемент в таблице, у которого происходит провал не одного электрона, а сразу двух. То есть, электронная формула имеет вид 4d10 5s0, вместо 4d8 5s2. Поэтому номер периода не соответствует количеству уровней, так как нет электронов – нет уровня. Серебро идёт сразу за палладием и у него происходит стабилизация 4d– подуровня (электрон оттуда вернуться уже не может), а следующий электрон попадает уже на 5s– подуровень.
Ч то касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:
то касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:
В данном случае s– электроны выделены более чётко, так как являются более активными. Поэтому при вступлении в связь хром и молибден отдают, как правило, не один, а сразу два электрона. Значит В*=2-6.
Можно привести достаточно большое количество незакономерных проскоков. Например, Ru : 4d75s1 (вместо 4d65s2), Pt: 5d96s1 (вместо 5d86s2) и так далее. Валентность рутения определяется по такому же принципу как и у хрома, а валентность платины – по такому же принципу как и у меди.
studfiles.net
Как определить валентные электроны?
Чтобы ответить на вопрос «как определить валентные электроны» нужно для начала определиться с самим понятием валентных электронов.Атом химического элемента состоит из положительно заряженного ядра, внутри которого находятся протоны и нейтроны, а вокруг него по орбитам движутся электроны. Орбитали, которые расположены дальше всего от ядра носят название внешних (внешний энергетический уровень), а электроны, расположенные на них – внешних или валентных. Именно эти электроны отвечают за образование химической связи с другими атомами.Общее количество валентных электронов можно определить при помощи Периодической таблицы Д.И. Менделеева. Номер группы, в которой находится интересующий вас элемент, вне зависимости от подгруппы (главная или побочная), равен числу электронов на внешнем энергетическом уровне. Например, Na расположен в I группе, значит у него 1 валентный электрон, Al в III группе – 3 валентных электрона и т.д.Чтобы определить, электроны, расположенные на каких подуровнях, являются валентными для элементов разных семейств, нужно записать электронную конфигурацию атома в основном состоянии. Рассмотрим на примере Li (s-элемент), S (p-элемент), Cr (d-элемент) и La (f-элемент).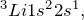
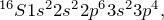
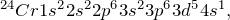
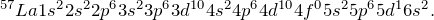 Для s-элементов валентными считаются электроны, расположенные s-орбитали, p-элементов – сумма электронов, расположенных на s- и p-орбиталях внешнего уровня; d-элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня; f- элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня.
Для s-элементов валентными считаются электроны, расположенные s-орбитали, p-элементов – сумма электронов, расположенных на s- и p-орбиталях внешнего уровня; d-элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня; f- элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня.
ru.solverbook.com
1.5 Проскок (провал) электронов
Проскок электрона — отступления от общей для большинства элементов последовательности заполнения электронных оболочек, связанные с тем, что эти “нарушения правил” обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек “по правилам”.
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3 ; р6 ; d5 ; d10 ; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d– подуровня за счёт проскока ( или повала) электрона с внешнего s– подуровня на нижележащий (предвнешний) d– подуровень.
Для ряда элементов закономерные проскоки приведены в таблице 1.
Таблица 1– Проскоки электронов
| Элемент | Атомная валентная зона | |
| теоретическая | практическая | |
| Cu | 3d9 4s2 | 3d10 4s1 |
| Ag | 4d9 5s2 | 4d10 5s1 |
| Au | 5d9 6s2 | 5d10 6s1 |
| Cr | 3d4 4s2 | 3d5 4s1 |
| Mo | 4d45s2 | 4d5 5s1 |
Согласно приведенным электронным конфигурациям медь одновалентна, так как в атоме только один неспаренный электрон.
На практике оказывается, что Cu проявляет валентность, равную двум. Следовательно, возможен, вопреки правилу, переход одного проскочившего электрона с предпоследнего 3d- подуровня на внешний 4р- подуровень. На рисунке 5 показано расширение атомной валентной зоны атома меди.
3d 4s 4p 3d 4s 4p

Рисунок 5– Расширение атомной валентной зоны атома меди
В этом случае максимальная валентность меди будет равна трем. На практике медь проявляет валетность (В) равную единице и двум.
Для золота характерна валентность В = 1; 2; 3. Расширение валентной зоны происходит таким же образом, как у меди. На практике золото обычно имеет валентность, равную трем, поскольку оно стоит в шестом периоде и электроны ядром удерживаются слабее.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице.
Хром и молибдена имеют одинаковое строение АВЗ и проявляют одинаковую валентность от двух до шести.
2 Периодическая система элементов
В современной формулировке периодический закон звучит так: свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
Периодическая система состоит из периодов и групп.
Периодом называется последовательный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
Все периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода s-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы элементов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент.
Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги).
В главных подгруппах расположены s–элементы (I, II групп) и p–элементы (III-VIII групп). В атомах элементов главных подгрупп валентные электроны находятся на s– и р–подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
В побочных подгруппах располагаются d- и f-элементы. Валентные электроны в атомах d-элементов находятся на s-подуровне внешнего и d-подуровне предпоследнего энергетических уровней.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
studfiles.net
Окисление и валентные электроны - Справочник химика 21
В ряду СЮ — СЮг — СЮз — СЮ4 по мере увеличения степени окисления хлора устойчивость анионов возрастает. Это можно объяснить тем, что при переходе от СЮ к СЮ увеличивается число электронов, принимающих участие в образовании связей. Особо устойчив ион СЮ4, в котором все валентные электроны атома хлора принимают участие в образовании связей [c.295] Атом серы 5, как и атом кислорода, имеет шесть валентных электронов (35 3/) ). Сера — типичный неметаллический элемент. По электроотрицательности (ЭО = 2,5) она уступает только галогенам, кислороду, азоту. Наиболее устойчивы четные степени окисления серы (—2, +2, -j-4 и +6), что объясняется участием в образовании химических связей двух непарных электронов, а также одной или двух электронных пар [c.322]Фосфор Р (Is 2s 2/f 3s Зр ) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота — элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. Максимальное координационное число фосфора шесть. Как и для других элементов 3-го периода, рл — рл-связывание для атома фосфора не характерно и поэтому в отличие от азота sp- и sp -гибридные состоянья орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5. [c.365]
Характерная для ниобия и тантала тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления +5. При низких же степенях окисления эта тенденция осуществляется за счет образования связей М—М (см. сл. главу). [c.544]
Катализ окисления металлами переменной валентности связан с участием их в генерировании радикалов по окислительновосстановительным реакциям. Ионы тяжелых металлов легко вступают в окислительно-восстановительные реакции, отдавая (в состоянии низшей валентности) или принимая (в состоянии высшей валентности) электрон. Гидропероксиды разрушаются по циклу Габера — Вейса [295] [c.192]
При окислении переходных металлов их атомы могут терять из валентной электронной оболочки не больше двух л-электронов и все неспа- [c.449]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
Хлор образует целую серию оксианионов СЮ, СЮ , СЮ3 и СЮд, в которых проявляет последовательный ряд положительных степеней окисления. Хлорид-ион, С1 , обладает электронной структурой благородного газа Аг с четырьмя парами валентных электронов. Указанные выше четыре оксианиона хлора можно представить себе как продукты реакции хлорид-иона, СГ, в качестве льюисова основания с одним, двумя, тремя или четырьмя атомами кислорода, каждый из которых обладает свойствами акцептора электронов, т.е. льюисовой кислоты [c.482]
Из этих уравнений следует, что окисление магния — это процесс оттягивания от его атома двух валентных электронов атомом окислителя, в данном случае кислорода, который восстанавливается, принимая ири этом отрицательную степень окисления. [c.54]
В атомах галлия, индия и таллия валентными электронами яв- ляются наружные, но только в возбужденном состоянии — Таким образом, обычно проявляемая этими элементами в соединениях высшая степень окисления равна -ЬЗ. Однако галлий и индий [c.334]
Поглощение твердым веществом фотонов, сопровождающееся переходом валентных электронов в зону проводимости, является, в сущности, обратимым процессом внутримолекулярного окисления — восстановления. Например, при поглощении кванта света цинк-сульфидным кристаллофосфором, активированным окисью цинка, проходят мгновенные реакции окисления ионов серы и кислорода [c.127]
Известны и другие соединения нулевой степени окисления -элементов, например Сг(РРз)в, Мо(РРз)в, Сг(РРз)з(СО)з, Ре(М0)4, Ре(N0),(С0) К1[Р(С,Н5)з14. В этих соединениях молекулы-лиганды выступают в качестве а-доноров и я-акцепторов электронных пар. Координационные числа -элементов здесь также обусловливаются числом свободных орбиталей, возникающих при спаривании валентных электронов комплексообразователя. [c.463]
Одинаковое число валентных электронов у атомов алюминия п бора определяет сходство этих элементов. Различие в структуре предвнешнего слоя и в размерах атомов, а в особенности наличие у атомов алюминия вакантных З -орбиталей предопределяют существенное различие их свойств. Как и для бора, для алюминия наиболее характерна степень окисления +3, а отрицательная поляризация атолюв проявляется еще реже. [c.524]
Написать электронную формулу азота и распределение его валентных электронов по атомным орбиталям. Обосновать возникновение высшей степени окисления азота -+5. [c.79]
Из уравнения загруженности ОВ-системы ( /П,91) видно, что загруженность системы зависит от параметров п, В и V. Чем больше число валентных электронов, участвующих в реакции, тем выше загруженность окислительно-восстановительной реакции. Максимальная загруженность или стабильность окислительно-восстановительной системы наступит при условии, что концентрации окисленной и восстановленной форм этой системы примерно одинаковы (т. е. К = 50%), а абсолютная концентрация всех компонентов этой системы (В) больше абсолютных концентраций компонентов всех остальных ОВ-систем, находящихся в растворе. [c.262]
При химической коррозии атомы металла после разрыва металлической связи непосредственно соединяются химической связью с атомами (или группами атомов), которые входят в состав окислителей, отбирающих у металла его валентные электроны. Такая коррозия может иметь место практически в любой коррозионной среде наиболее часто она протекает в средах, не являющихся электролитами. В качестве примера химической коррозии можно назвать взаимодействие металлов с хлором и серой, окисление на воздухе поверхности алюминия, высокотемпературное окисление металлов кислородом, коррозию в неэлектропроводных органических жидкостях и др. [c.273]
Элементы группы 6А имеют одинаковую валентную электронную конфигурацию где п может принимать значения от 2 до 6. Следовательно, атомы этих элементов могут приобретать электронную конфигурацию благородных газов, присоединяя два электрона, т. е. переходя в состояние окисления — 2. Поскольку элементы группы [c.299]
А принадлежат к неметаллам, указанное состояние является для них наиболее распространенным. Однако элементы группы 6А, за исключением кислорода, нередко находятся в состояниях с положительной степенью окисления вплоть до + 6, что соответствует обобществлению всех шести валентных электронов с атомами более электроотрицательных элементов. [c.300]
Как видно, для определения числа принятых электронов не потребовалось никаких сведений о степени окисления, валентности и т. п. характеристиках реагирующих частиц. Полуреакция с Ре + в данном случае не отличается от (6,3). Чтобы уравнять число отдаваемых и принимаемых электронов, коэффициенты полуреакции (6.3) необходимо умножить на 5 [c.104]
Таким образом, максимально возможное число валентных электронов для элементов побочных подгрупп равно номеру группы. Следовательно, максимальная возможная положительная степень окисления должна быть равна номеру группы. [c.75]
Электроны заполняют 4/-, а не 5(/-подуровень потому, что в этом случае атом обладает меньшей энергией. Однако разница в энергиях 4/- и 5с(-состояний очень мала. Благодаря этому один из 4/-электронов (а в некоторых случаях, например, у церия, два 4/-электрона) легко возбуждается, переходя на 5й-подуровень, и становится, таким образом, валентным электроном. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления -1-3, а не +2. Это обстоятельство объясняет близость свойст лантаноидов к свойствам элементов подгруппы скандия. [c.500]
ГОРЕНИЕ — сложный химический процесс окисления, сопровождающийся выделением большого количества теплоты и свечением раскаленных частиц — продуктов реакции. К реакциям горения относят все химические процессы, связанные с быстрым превращением, например, разложение взрывчатых веществ, озона, ацетилена, реакции с хлором, фтором и др. Реакция Г. состоит из многих элементарных окислительновосстановительных процессов, сопровождающихся перераспределением валентных электронов между атомами реагирующих веществ (см. Окисление — восстановление). [c.79]
Кластеры типичны для соединений -элементов, металлы которых имеют высокие энергии атомизации. В кластерных соединениях с формально низкими степенями окисления -элементов валентные электроны их атомов в значительной степени используются на связи М—М, а оставшиеся образуют связи с атомами неметаллов (партнерами). В итоге все валентные электроны атомов -элементов в кластерах принимают участие в образовании связей независимо от степени окисления. [c.109]
Наличие только одного электрона в -состоянии делает конфигурацию валентных электронов нестабильной, а расположение в наружном слое двух 5-электронов обусловливает металлическую природу элементов и близость их по свойствам к щелочно-земельным металлам. Для них характерна постоянная степень окисления +3. Некоторые свойства элементов приведены в табл. 19.1. [c.355]
У атомов и р-элементов валентными являются электроны внешнего слоя. При участии в образовании связей всех валентных электронов элемент проявляет высшую степень окисления, которая численно равна номеру группы периодической системы, в которой он находится. В характере значений степеней окисления у з- и р-элементов про-янляется правило четности . Энергетически относительно более ста-бгльны соединения, в которых элементы нечетных групп проявляют Нечетные степени окисления, а элементы четных групп — четные степени окисления. [c.266]
Кремний 81(15 2 2р 35 Зр ) по числу валентных электронов является аналогом углерода. Однако у кремния больший размер атома, меньшая энергия ионизации, большее сродство к электрону и большая поляризуемость атома. Поэтому кремний — элемент 3-го периода — по структуре и свойствам однотипных соединений существенно отличается от углерода — элемента 2-го периода. Максимальное координационное число кремния равно итести, а наиболее характерное — четырем. Как п для других элементов 3-го периода, рл — ря-связывание для кремния не характерно и потому в отличие от углерода р- и зр -гибридные состояния для него неустойчивы. Кремний в соединениях имеет степени окисления +4 и —4. [c.410]
У бериллия (ls 2s ) по сравнению с бором ( s 2s 2p ) в соответствии с увеличением радиуса атома и уменьшением числа валентных электронов неметаллические признаки проявляются слабее, а металлические усиливаются. Бериллий обладает более высокими энергиями ионизации атома (II = 9,32 эВ, /а == 18,21 эВ), чем остальные s-элементы II группы. В то же время он во многом сходен с алюминием (диагональное сходство в периодической системе) и является типичным амфотерным эле.ментом в обычных условиях он простых ионов не образует для него характерны комплексные ионы как катионного, так и анионного типа. Во всех устойчивых соединениях степень окисления бериллия -f2. Для Ве (II) наиболее характерно координационное число 4 (зр -гибри-Д1(зация валентных орбиталей). [c.470]
Атомы рассматриваемых элементов имеют единственный валентный электрон. По сравнению с элементами других подгрупп у них наиболее низкие первые энергии ионизации, размеры атомов и ионов наибол ьшие. Таким образом, щелочных металлов наиболее сильно выражены металлические признаки. Они проявляют только степень окисления + 1, так как вторая энергия ионизации у этих элементов очень сильно отличается по значению от первой. [c.485]
В кластерных галидах атомы -элемента используют в образовании связи М—М и М—Hal все сеюи валентные электроны (Тс и Re—7, Мо и W—6, Nb и Та—5) независимо от степени окисления. Таким образом, стремление к использованию всех своих валентных [c.557]
Соединения Сг([П), Мо(П1), W (III). У хрома степень окисления -ЬЗ является наиболее устойчивой. Координационное число хрома (HI) равно шести, поэтому его комплексы (структурные единицы) имеют форму октаэдра. Валентные электроны в октаэдрических комплексах Сг (HI) располагаются только на связывающих и несвязывающих орбиталях [c.558]
В энергиях 4[- и 5 -состояний очень мала. Благодаря этому одии из 4/-электронов (а в некоторых случаях, например, у церия, два 4/-электрона) легко возбуждается, переходя иа 5 -подуровень, и сгановится, таким образом, валентным электроном. Поэтому в большинстве своих соединений лантаноиды имеют степень окисленности +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия. [c.642]
В триаде Ti-Zr-Hf с валентной конфигурацией атомов 5- Т и 2г обнаруживают состояния окисления 4-2, 4- 3 и 4-4. тогда как НГ имеет только одно состояние окисления 4-4. В этом случае мы сталкиваемся с примером общей закономерности, присущей переходным металлам низшие степени окисления играют меньшую роль для переходных металлов второго и третьего рядов, потому что в их атомах валентные электроны нах.одятся на большем удалении от ядра. В условиях когда эти атомы могут терять валентные электроны, они чаще всего теряют их полностью. В низших состояниях окисления Т1 образует ионные соединения, а в состоянии окисления 4- 4 его соединения имеют более ковалентный характер и он обладает неметаллическими свойствами. Оксид титана(Н), ТЮ, представляет собой ионное соединение основного типа со структурой кристалла Na l. В отличие от этого диоксид титана, Т Ог,-белый нерастворимый пигмент, об.падающий как кислотными, так и основными свойствами. [c.440]
В данной главе будет рассмотрен простой метод описания ковалентных связей с использованием структурных схем Льюиса. Мы занищем льюисовы структуры для известных молекул и ионов и дадим им объяснение, пользуясь представлениями об обобществлении электронных пар и построении замкнутых валентных оболочек такого типа, как у атомов благородных газов. Затем мы объясним степени окисления атомов в соединениях на основе соображений о неравномерности обобществления электронных пар атомами, обладающими разной электроотрицательностью, после чего перейдем к установлению взаимосвязи между кислотностью некоторых молекул и электронным строением их центрального атома. В последней части главы будет показано, как для предсказания формы молекул используется метод отталкивания валентных электронных пар (ОВЭП). [c.465]
Кислород отличается от остальных элементов подгруппы VIA отсутствием высших (превышающих. 2) степеней окисления. Это обусловлено тем, что в валентном электронном слое атома кислорода нет i-орбиталей. В водородсодержащих соединениях кислорода (Н2О, Н2О2, спирты и т. д.) образуются водородные связи. [c.437]
Степень окисления углерода в СОг равна +4. Следовательно, все четыре валентных электрона ц. а. используются на образование связей число несиязы-вающих электронных пар равно нулю. Координационному числу ц. а. 2 соответствуют две о-связывающие электронные пары, т. е, молекула СО имеет линейную формулу (см. табл. 10). Согласно модели гибридизации в образовании двух о-связей принимают участие одна 5- и одна р-орбитали ц. а., имеет место хр-гибри-дизация валентных орбиталей углерода [c.73]
Степень окисления углерода в СОз равна - -4. Следовательно, все четыре валентных электрона ц. а. использ ются на образование связей число несвязывающих электронных пар равно нулю. [c.180]
Характерная для ниобия и тантала тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления +5. При низких же степенях окисления эта тенденция осуществляется за счет образования связей М—М. Таким образом, производные низких степеней окисления ниобия и тантала в (кновном относятся к соединениям кластерного типа. [c.441]
Подобная близость свойств объясняется тем, что в высшей степени окисления атом элемента, находящегося в третьем периоде (в главной подгруппе) и атомы элементов побочной подгруппы приобретают сходное электронное строение. Например, атом хрома имеет электронную конфигурацию 1з Когда хром находится в степени окисления 4-6 (например, в оксиде СгОз), шесть электронов его атома (пять М- и один 4б-электрон) вместе с валентными электронами соседних атомов (в случае СгОз — атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисления -Ьб (например, в триокси-де серы ЗОз), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных (1з 28 р ) также соответствует электронной структуре благородного газа. Короче говоря, сходство в свойствах соединений элементов побочной подгруппы и элемента третьего периода той же группы обусловлено тем, что их ионы, отвечающие высшим степеням окисления, являются электронными анапогами. Это легко видеть из данных табл. 21.1. [c.497]
ГАЛОГЕНЫ (галоиды) — химические элементы главной подгруппы VII группы периодической системы элементов Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Название галогены происходит от греч. hais — соль и genes — рождать. Неправильное название галоиды , которое ввел Г. И. Гесс, означает солеподобный . Атомы Г. имеют конфигурацию валентных электронов присоединяя один электрон, приобретают конфигурацию инертного газа s p . Все Г.— активные неметаллы, непосредственно соединяются с большинством элементов, образуя галогениды. Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Известно два соединения [(ЫНз)5Со02Со(К Нз)б](НОз)4 и [(NHз)5 o02 o(NHз)5](NOз)5, из которых первое неустойчиво, а второе стабильно, хотя в соответствии с формулой должно содержать кобальт в необычном для него состоянии окисления. Для объяснения устойчивости второго соединения было проведено измерение его магнитной восприимчивости. Оказалось, что осуществляется следующее строение электронных оболочек центральных ионов кобальта из девяти 1-, 8-, /)-ячеек каждого атома Со две заняты спаренными электронами Со, пять — акцепторными связями с МНз. У двух атомов Со остаются четыре ячейки с четырьмя электронами и группа О с тремя электронами, участвующими в образовании валентных связей (один неспаренный валентный электрон и пара электронов у отрицательно заряженного атома кислорода). Неспаренный электрон может дать одну ковалентную связь с одним из электронов кобальта, а электронная пара — донорную связь со свободной орбитой Со. В результате семь электронов двигаются в поле четырех центров, причем у двух из этих центров (у кобальта) имеются по две орбиты. [c.345]
Образуются, таким образом, четыре вакантные sp -гибридиые орбитали. Появляется возможность возникновения о-связи по донорно-акцепторному механизму за счет перекрывания гибридных валентных орбиталей возбужденного атома -металла, в нашем случае никеля, с неподеленной парой электронов оксида [СО]— [М—СО). Атом d-металла имеет здесь нулевую степень окисления — М(0). Карбонильные соединения диамагнитны, следовааельно, при их образовании происходит спаривание валентных электроне (-элемента (см. 9.3). [c.399]
chem21.info