Способ получения модифицированного оксида хрома для полирования. Получение оксида хрома
Синтез 4. Получение оксида хрома(III)
Посуда, приборы и реактивы:
фарфоровая ступка, фарфоровый тигель, фарфоровый треугольник, прибор для фильтрования, дихромат калия, сера.
На листе бумаги смешайте 3-5 г измельченного в ступке дихромата калия и порошкообразную серу, взятую в трехкратном избытке по отношению к количеству, найденному по уравнению реакции:
К2Сr2О7 + S 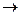 K2SO4 + Сr2О3
K2SO4 + Сr2О3
Смесь поместите в ступку, еще раз тщательно перемешайте и разотрите. Перенесите смесь в фарфоровый тигель, поставьте его на фарфоровый треугольник и осторожно нагрейте на газовой горелке в вытяжном шкафу. Когда загорится сера и появится голубое пламя, нагревание тигля прекратите, восстановление дихромата пойдет самопроизвольно. Затем содержимое тигля охладите, разотрите в ступке с 30 мл воды. При этом соединения калия перейдут в раствор, а оксид xpoмa останется в виде взвеси твердой фазы болотно-зеленого цвета. Полученный оксид хрома отфильтруйте на воронке Бюхнера и на фильтре промойте два раза небольшими порциями дистиллированной воды. После этого осадок высушите. Затем определите выход продукта в процентах от теоретического, исходя из количества дихромата калия. Проведите термодинамический анализ возможности процесса восстановления дихромата серой, укажите интервал температур, в котором он выгоден. Испытайте отношение полученного оксида к кислотам (h3SO4, HCI) и раствору щелочи. Запишите свои наблюдения.
Контрольные вопросы и задачи
1.Какими способами можно получить оксиды хрома? Запишите уравнения реакций.
2.Запишите уравнения реакций, характеризующих амфотерные свойства оксида хрома (III). В чем причина малой реакционной способности прокаленного Сr2О3?
3.Как изменится устойчивость, кислотно-основные свойства в ряду оксидов и гидроксидов хрома: СrО – Сr2O3 – СrО3. Сr(ОН)2 - Сr(ОН)3 - Н2СrО4 - Н2Сr2O7?
4.Используя значения стандартных окислительно-восстановительных потенциалов электродных равновесии:
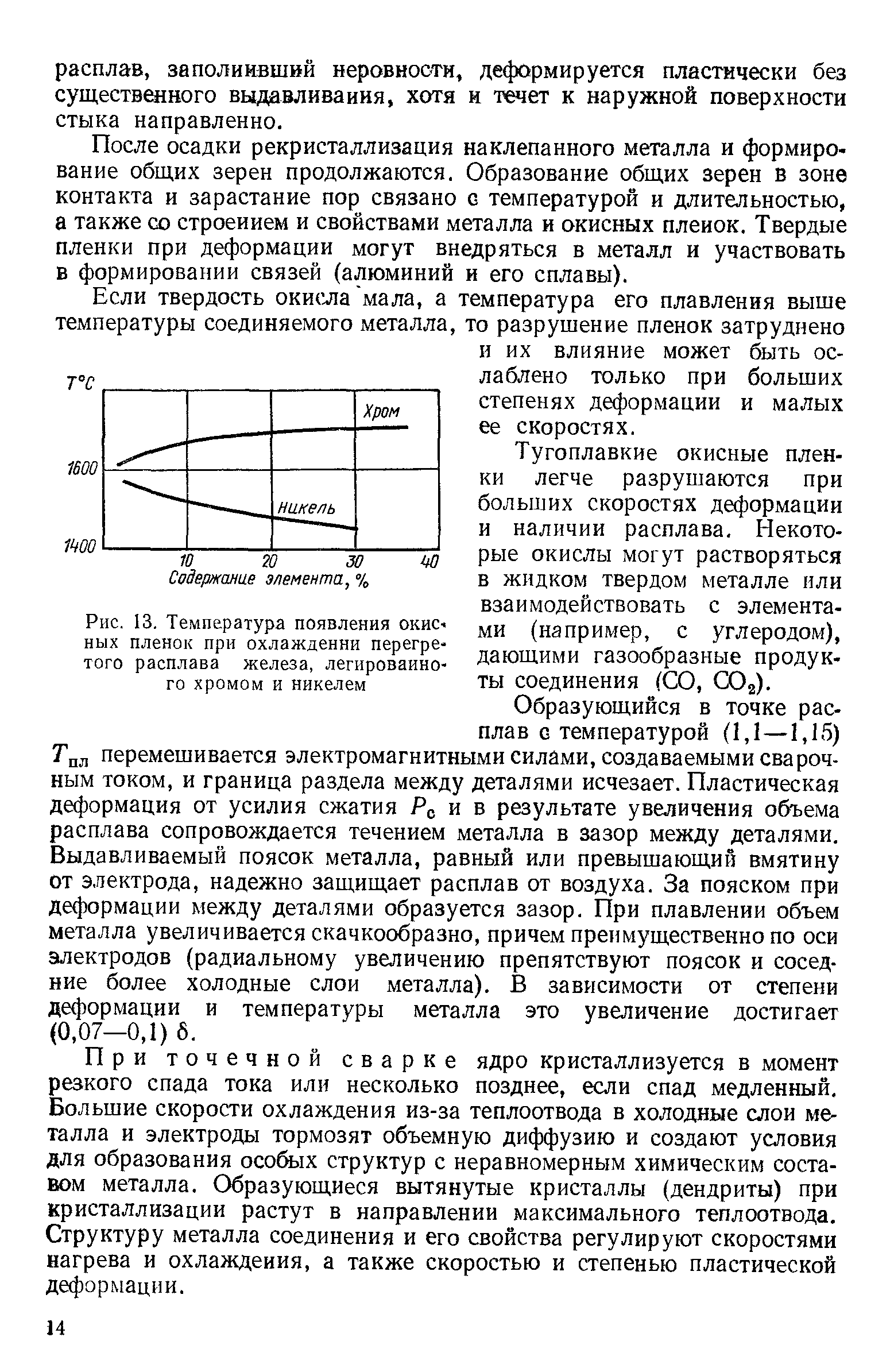
Cr2O27 + 14H+ + 6е = 2СrЗ+ + 7Н2О;
CгО24 + 4Н2О + 3е = Сr(ОН)3 + 5ОН-;
сопоставьте окислительные свойства Сr (+6) в кислой и щелочной средах. В какой среде термодинамически выгоднее проводить процесс окисления СгЗ+.
5.При каких температурах следует сушить оксид Сr2О3, каково его отношение к кислороду воздуха?
6.К какому типу процессов - экзо- или эндотермическим относится реакция, используемая в данной работе? Почему необходимо нагревать смесь К2Сr2O7 с серой в процессе получения Сr2O3 в настоящей работе?
7.Для чего нужно измельчать исходные продукты?
8.Почему для проведения реакции используется фарфоровый тигель, а не стеклянный стакан?
9.Почему нагревание необходимо проводить в вытяжном шкафу?
10.Для чего промывают полученный оксид хрома (III) водой?
11.Почему для реакции, используемой в работе, необходим избыток серы?
Гродненский государственный аграрный университет.
Практикум по неорганической химии.
Отчет студента____ курса___группы
Лабораторная работа:_________________________________________________
Количество получаемого вещества:_______
| Описание вещества (цвет, агрегатное состояние, отношение к воде и воздуху) | Замечания по ТБ |
| Схема прибора | Используемая посуда |
| Уравнение реакций и расчеты | |
| Ионно-молекулярные уравнения реакции | |
| Наблюдаемый эффект реакции. Вывод о свойствах. | |
Виза преподавателя о допуске к работе:__________________________________
Выход продукта: ___________ грамм; ________ процентов;
Перечень операций в данном синтезе:
| Методика синтеза |
| Защита работы |
Дата:____________
Список литературы:
Основная
1. Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. Химические свойства неорганических веществ. М.: «Колос», 2006.
2. Глинка Н.Л. Общая химия.-Л.:Химия, 1990.И.Г. Новиков, И.М. Жарский. Общая и экспериментальная химия. Мн., «Современная школа», 2007.
3. И.М.Жарский, А.Л. Кузьменко, С.Е.Орехова. Теоретические основы химии. Сборник задач., Мн., 2004.
4. И.М.Жарский, А.Л. Кузьменко, С.Е.Орехова. Лабораторный практикум по общей и неорганической химии. Под редакцией Г.И. Новикова. Мн., изд-во «Дизайн ПРО», 1998.
5. Н.С. Ахметов. Общая и неорганическая химия. М.: «Высшая школа», 1998.
6. М.Х. Карапетьянц, С.И.Дракин. Общая и неорганическая химия. М.: «Химия», 1992.
7. Общая химия в формулах, определениях, схемах./Под ред. В.Ф.Тикавого.-Мн.: изд-во БГУ, 1987.
8. Д.А.Князев, С.Н. Смарыгин. Неорганическая химия. -М.: ВШ, 1990.
10. Задачи и упражнения по общей химии./Под ред. Проф. Н.В Коровина. -М.: ВШ, 2003.
11. Л.М. Романцева. и др. Сборник задач и упражнений по общей химии.-М.: ВШ, 1980.
12. Л.М.Витинг, Л.А. Резницкий. Задачи и упражнения по общей химии.-М.: МГУ, 1995.
Дополнительная.
1. Я.А. Угай. Общая химия. -М.: ВШ, 1984.
2. Я.А. Угай. Неорганическая химия.-М.: ВШ, 1989.
3. Г.П .Хомченко., И.К.Цитович. Неорганическая химия. -М.: ВШ, 1978.
4. Н.Л. Глинка. Общая химия.-Л.:Химия, 1990.
5. Н.Л. Глинка. Задачи и упражнения по общей химии. -Л.:Химия, 1988.
6. Б.В. Некрасов. Основы общей химии. -М.: Химия, 1973.
7. Петров М.М., Михилев Л.А., Кукушкин Ю.Н. Неорганическая химия. –Л.: Химия, 1981.
Учебное издание
АпановичЗинаида Васильевна
РАБОЧАЯ ТЕТРАДЬ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
Методические указания
Ст. корректор Ж.И. Бородина
Компьютерная верстка: А.В. Сычевник
Подписано в печать
Формат 60 x 84/16.Бумага офсетная. Гарнитура. Таймс.
Печать. Riso . Усл. печ.л. 8.25. Уч. Изд.л. 9,14
Тираж 250 экз. Заказ №
Учреждение образования
«Гродненский государственный аграрный университет»
Л.И. № 02330/0133326 от 29. 06. 2004.
Отпечатано на технике издательско-полиграфического отдела
Учреждения образования «Гродненский государственный
аграрный университет»
230008, г. Гродно, ул. Терешковой,28
infopedia.su
Способ получения оксида хрома (iii) с малым содержанием шестивалентного хрома
Изобретение относится к производству оксида хрома (III), применяемого в лакокрасочной промышленности и для полирования.
Способ получения оксида хрома (III) с малым содержанием шестивалентного хрома (III) включает терморазложение хромового ангидрида, отмывку от водорастворимых веществ получающегося Cr2O3, суспендирование в 8 - 10%-ном растворе мочевины, отделение от жидкой фазы до влажности осадка 30 - 35 мас.% и термообработку при температуре 200 - 280oC. 1 табл., 1 ил.
РИСУНКИ
Рисунок 1, Рисунок 2www.findpatent.ru
Получение - окись - хром
Получение - окись - хром
Cтраница 1
Получение окиси хрома из калиевого или натриевого хромпика состоит в прокаливании смеси хромпика с серой, углем или содержащими уголь веществами, аммониевыми солями, гипсом. [1]
Получение окиси хрома по способу ГИПХ на Уральском хромпиковом химзаводе, Отч. [2]
Получение окиси хрома из производственных монохроматных щелоков действием сернистого натрия, Отч. [3]
Получение окиси хрома из растворов хромата натрия и сернистого натрия, Отч. [4]
Процесс получения окиси хрома из гидрата заключается в следующем. Отмытую пасту гидрата окиси хрома загружают в чан с мешалкой ( обычно стальной), добавляют воду из расчета получения суспензии с содержанием 60 % воды ( по отношению к окиси хрома) и вводят добавки, необходимые для сообщения пигменту того или иного оттенка. Из сушилки гидрат окиси хрома с помощью шнека, охлаждаемого водой, подается во вра вдающуюся печь, где прокаливается на окись хрома. Таким образом, весь этот процесс является непрерывным. [5]
Процесс получения окиси хрома из гидрата заключается в следующем. Отмытую пасту гидрата окиси хрома загружают в чан с мешалкой ( обычно стальной), добавляют воду из расчета получения суспензии с содержанием 60 % воды ( по отношению к окиси хрома) и вводят добавки, необходимые для сообщения пигменту того или иного оттенка. Из сушилки гидрат окиси хрома с помощью шнека, охлаждаемого водой, подается во вращающуюся печь, где прокаливается на окись хрома. Таким образом, весь этот процесс является непрерывным. [6]
Установка для получения окиси хрома состоит из футерованной вращающейся барабанной печи ( примерные размеры: d 2 м, / 14 м), скрубберов, промывателя, фильтрующей аппаратуры и сушилок. [8]
С -, Получение окиси хрома действием сернистого газа на хроматные щелоки, Отч. [9]
Из известных способов получения окиси хрома практическое значение имеют два: термический и осадочно-прокалочный. [10]
Существуют и другие методы получения окиси хрома. [11]
Вскоре был открыт способ получения окиси хрома прокаливанием смеси хромпика с серой, углем или хлористым аммонием. [12]
Вскоре был открыт способ получения окиси хрома прокаливанием смеси хромпика с серой, углем или хлоридом аммония. [13]
Существуют и другие методы получения окиси хрома. [14]
Вскоре был открыт способ получения окиси хрома прокаливанием смеси хромпика с серой, углем или хлористым аммонием. [15]
Страницы: 1 2 3
www.ngpedia.ru
Получение оксида хрома - Справочник химика 21
Опыт 4. Получение оксида хрома (III) и его свойства (ТЯГА ). [c.132]Опыт 341. Получение оксида хрома (VI) [c.183]
Р А Б О Т А 37. ПОЛУЧЕНИЕ ОКСИДА ХРОМА (III) [c.139]
Смесь помещают в фарфоровый тигель, а тигель — на фарфоровый треугольник и осторожно нагревают на газовой горелке в вытяжном шкафу. Когда начнется самовозгорание массы, нагревание прекращают и тиглю дают охладиться. Содержимое тигля растирают в ступке с водой. При этом соединение калия переходит в раствор, а оксид хрома остается в виде взвеси. Полученный оксид хрома отфильтровывают на воронке Бюхнера, высушивают и взвешивают. Затем определяют выход продукта в процентах от теоретического исходя из бихромата калия, испытывают отношение полученного оксида к кислотам и щелочам. [c.140]
Опыт 3. Получение оксида хрома (111) (демонстрационный) [c.42]Получение оксида хрома (III) из дихромата калия [c.259]
Полученный сульфат калия через некоторое время растворится в воде. Жидкость удалить с помощью фильтровальной бумаги. Снова добавить воды и удалить ее тем же способом. Отметить цвет полученного оксида хрома (III). Написать уравнение реакции. [c.259]
Бихроматы натрия и калия могут быть использованы для получения оксида хрома (VI). Последний выделяется в виде темно-красных игольчатых кристаллов при действии концентрированной серной кислоты на насыщенные растворы бихромата натрия или калия [c.472]
Каковы физические свойства и способы получения оксида хрома (VI) [c.259]
Какой способ используется в промышленности для получения оксида хрома Каковы его химические основы [c.337]
Выполнение работы. Поместить на асбестовую сетку 1/3 объема пробирки растертого в порошок бихромата аммония. Раскалить железную проволочку на горелке и погрузить ее в бихромат. Наблюдать бурное разложение соли. Какой цвет имеет полученный оксид хрома(III) [c.288]
Опыт 1. Получение оксида хрома(111 [c.196]
Опыт 298. Получение оксида хрома (П1) из дихромата аммония. [c.201]
Получение оксида хрома (IV) проводят осторожным окислением Сгг(3з под давлением кислорода. Диоксид хрома проявляет способность сохранять однажды сообщенную ему намагниченность (ферромагнитные свойства). [c.451]
Напишите уравнения реакций всех способов получения оксида хрома (III), оксида углерода (IV), оксида кальция. [c.256]
Исходной рудой для получения оксида хрома (П1) является хромистый железняк. При окислительно-щелочном сплавлении хромита железа с содой (окислитель — кислород воздуха) образуется хромат натрия Naa rOi [c.380]
chem21.info
Способ получения модифицированного оксида хрома для полирования
Изобретение относится к производству оксида хрома, применяемого для полирования. Способ получения модифицированного оксида хрома включает термообработку суспензии хромового ангидрида с добавкой осадка отхода, образующегося при нейтрализации сточных вод хромового производства, при отношении: 2 массовых части хромового ангидрида и 1 - 1,5 массовых частей "свежеосажденного", отмытого осадка, при температуре 350 - 370oC в течение 1 часа и при температуре 980 - 1100oC в течение 1,5 - 2 часов. Спек измельчают, классифицируют, отмывают горячей водой от водорастворимых веществ, осадок отделяют фильтрацией и сушат при температуре 100 - 105oC. Модифицированный оксид хрома, получаемый по предлагаемому способу, имеет полирующую способность 0,4 - 0,5 мг мин-1
мин-1 см-2, дает шероховатость поверхности после полировки 0,08 - 0,09 мкм, содержит в составе 4 - 8 мас.% FeO3 и 1 - 2 мас.% CaO. 1 табл. 2 ил.
см-2, дает шероховатость поверхности после полировки 0,08 - 0,09 мкм, содержит в составе 4 - 8 мас.% FeO3 и 1 - 2 мас.% CaO. 1 табл. 2 ил.
Изобретение относится к способам получения оксида хрома, применяемого для полирования. Способ позволяет ликвидировать отход, образующийся при нейтрализации сточных вод хромового производства.
Наиболее близким к предполагаемому изобретению является способ получения оксида хрома путем термической обработки хромового ангидрида с добавкой гидроксида кальция при температуре 220 270oC в течение 1,5 2 ч, при 350 400oC в течение 1,0 1,5 ч, при 1100 1200oC в течение 1,5 2 ч с последующим измельчением спека, классификацией, отмывкой от водорастворимых веществ и сушкой. К недостаткам этого способа можно отнести сравнительно низкую полирующую способность оксида хрома 0,31 0,33 мг мин-1
мин-1 см-2 при шероховатости поверхности после полировки Rz 0,09 0,10 мкм. Целью предполагаемого изобретения является повышение полирующей способности модифицированного оксида хрома до 0,4 0,5 мг
см-2 при шероховатости поверхности после полировки Rz 0,09 0,10 мкм. Целью предполагаемого изобретения является повышение полирующей способности модифицированного оксида хрома до 0,4 0,5 мг мин-1
мин-1 см-2, дающего шероховатость поверхности после полировки Rz 0,08 0,09 мкм, и ликвидация отхода хромового производства, образующегося при нейтрализации сточных вод. Поставленная цель достигается предлагаемым способом получения модифицированного оксида хрома, который заключается в термообработке суспензии хромового ангидрида с добавкой предварительно отмытого осадка отхода, полученного при нейтрализации сточных вод хромового производства в течение не более месяца и содержащего в составе гидроксиды железа, хрома, кальция при массовом отношении 2 1,0 1,5. Сырье: водная суспензия хромового ангидрида, содержащая 2000 г/дм3 CrO3 и 1000 1500 г/дм3 осадка гидроксидов железа, хрома, кальция, являющегося отходом хромового производства, подвергается термообработке при температуре 350 370oC в течение 1 часа и при температуре 980 1100oC в течение 1,5 2 ч, спек измельчают, классифицируют, отмывают горячей водой от водорастворимых веществ и сушат при температуре 100 105oC. В результате термообработки при указанных условиях происходит образование оксида хрома, модифицированного железом и кальцием. Готовый продукт обладает полирующей способностью 0,4 0,5 мг
см-2, дающего шероховатость поверхности после полировки Rz 0,08 0,09 мкм, и ликвидация отхода хромового производства, образующегося при нейтрализации сточных вод. Поставленная цель достигается предлагаемым способом получения модифицированного оксида хрома, который заключается в термообработке суспензии хромового ангидрида с добавкой предварительно отмытого осадка отхода, полученного при нейтрализации сточных вод хромового производства в течение не более месяца и содержащего в составе гидроксиды железа, хрома, кальция при массовом отношении 2 1,0 1,5. Сырье: водная суспензия хромового ангидрида, содержащая 2000 г/дм3 CrO3 и 1000 1500 г/дм3 осадка гидроксидов железа, хрома, кальция, являющегося отходом хромового производства, подвергается термообработке при температуре 350 370oC в течение 1 часа и при температуре 980 1100oC в течение 1,5 2 ч, спек измельчают, классифицируют, отмывают горячей водой от водорастворимых веществ и сушат при температуре 100 105oC. В результате термообработки при указанных условиях происходит образование оксида хрома, модифицированного железом и кальцием. Готовый продукт обладает полирующей способностью 0,4 0,5 мг мин-1
мин-1 см-2, дает шероховатость поверхности после полировки 0,08 0,09 мкм и имеет в своем составе 4 8 мас. Fe2O3, 1 2 мас. CaO. Повышение полирующей способности, вероятно, можно объяснить усиливающим действием электронного обмена в процессе полирования между изделием и полировочным материалом за счет внедрения в решетку оксида хрома ионов железа и кальция. Последний факт подтверждается рентгено-фазовым анализом: происходит смещение лини межплоскостных расстояний по сравнению с чистым оксидом хрома. Увеличение количества вводимого в суспензию отхода более 1,5 массовой части на 2 массовых части хромового ангидрида и уменьшение количества вводимого отхода менее 1 массовой части приводит к снижению полирующей способности оксида хрома, модифицированного железом, кальцием. Применение "постаревшего" осадка отхода в течение месяца и более снижает полирующую способность оксида хрома. Уменьшение температуры термообработки на первой стадии ниже или увеличение выше 350 370oC и на второй уменьшение ниже 980oС и продолжительности менее 1,5 часа ведет к получению оксида хрома с более низкой полирующей способностью. Увеличение температуры выше 1100oC приводит к увеличению шероховатости поверхности после полировки (табл. фиг. 1, фиг. 2). Сопоставительный анализ с прототипом показывает, что заявленный способ получения оксида хрома, модифицированного железом, кальцием, отличается тем, что термообработке подвергают суспензию хромового ангидрида с модифицирующей добавкой, в качестве которой используют осадок, образующихся при нейтрализации сточных вод хромового производства. Таким образом, заявленный способ соответствует критерию изобретения "новизна". Сравнение заявленного способа с другими способами позволяет установить, что в аналогичных решениях не применяется термообработка суспензии хромового ангидрида с осадком отхода хромового производства, образующегося при нейтрализации сточных вод. Это решение не является очевидным из уровня знаний и техники и позволяет сделать вывод о соответствии критерию "изобретательский уровень". Изобретение возможно использовать в промышленности. Пример 1. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,5 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 6 мас. Fe2O3, 1,5 мас. CaO, 2,0 мас. Cr2O3, 88 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 370oC в течение 1 часа и при температуре 980oC в течение 1,5 часа. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 4 мас. Fe2O3, 1 мас. CaO и 95 мас. Cr2O3 с полирующей способностью 0,42 мг
см-2, дает шероховатость поверхности после полировки 0,08 0,09 мкм и имеет в своем составе 4 8 мас. Fe2O3, 1 2 мас. CaO. Повышение полирующей способности, вероятно, можно объяснить усиливающим действием электронного обмена в процессе полирования между изделием и полировочным материалом за счет внедрения в решетку оксида хрома ионов железа и кальция. Последний факт подтверждается рентгено-фазовым анализом: происходит смещение лини межплоскостных расстояний по сравнению с чистым оксидом хрома. Увеличение количества вводимого в суспензию отхода более 1,5 массовой части на 2 массовых части хромового ангидрида и уменьшение количества вводимого отхода менее 1 массовой части приводит к снижению полирующей способности оксида хрома, модифицированного железом, кальцием. Применение "постаревшего" осадка отхода в течение месяца и более снижает полирующую способность оксида хрома. Уменьшение температуры термообработки на первой стадии ниже или увеличение выше 350 370oC и на второй уменьшение ниже 980oС и продолжительности менее 1,5 часа ведет к получению оксида хрома с более низкой полирующей способностью. Увеличение температуры выше 1100oC приводит к увеличению шероховатости поверхности после полировки (табл. фиг. 1, фиг. 2). Сопоставительный анализ с прототипом показывает, что заявленный способ получения оксида хрома, модифицированного железом, кальцием, отличается тем, что термообработке подвергают суспензию хромового ангидрида с модифицирующей добавкой, в качестве которой используют осадок, образующихся при нейтрализации сточных вод хромового производства. Таким образом, заявленный способ соответствует критерию изобретения "новизна". Сравнение заявленного способа с другими способами позволяет установить, что в аналогичных решениях не применяется термообработка суспензии хромового ангидрида с осадком отхода хромового производства, образующегося при нейтрализации сточных вод. Это решение не является очевидным из уровня знаний и техники и позволяет сделать вывод о соответствии критерию "изобретательский уровень". Изобретение возможно использовать в промышленности. Пример 1. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,5 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 6 мас. Fe2O3, 1,5 мас. CaO, 2,0 мас. Cr2O3, 88 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 370oC в течение 1 часа и при температуре 980oC в течение 1,5 часа. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 4 мас. Fe2O3, 1 мас. CaO и 95 мас. Cr2O3 с полирующей способностью 0,42 мг мин-1
мин-1 см-2 и дающего шероховатость поверхности после полировки RZ=0,08 мкм. Пример 2. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,75 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 8,5 мас. Fe2O3, 2,0 мас. CaO, 2 мас. Cr2O3, 85 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 - 370oC в течение 1 часа, при температуре 1100oC в течение 2 часов. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 7,5 мас. Fe2O3 и 1,8 мас. CaO с полирующей способностью 0,5 мг
см-2 и дающего шероховатость поверхности после полировки RZ=0,08 мкм. Пример 2. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,75 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 8,5 мас. Fe2O3, 2,0 мас. CaO, 2 мас. Cr2O3, 85 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 - 370oC в течение 1 часа, при температуре 1100oC в течение 2 часов. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 7,5 мас. Fe2O3 и 1,8 мас. CaO с полирующей способностью 0,5 мг мин-1
мин-1 см-2 и дающего шероховатость поверхности после полировки RZ= 0,09 мкм. Пример 3. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,5 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 6 мас. Fe2O3, 1,5 мас. CaO, 2 мас. Cr2O3, 82 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 370oC в течение 1 часа, при температуре 1050oC в течение 2 часов. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 4 мас. Fe2O3, 1 мас. CaO и 95 мас. Cr2O3 с полирующей способностью 0,45 мг
см-2 и дающего шероховатость поверхности после полировки RZ= 0,09 мкм. Пример 3. В никелевый тигель емкостью 0,003 м3 помещают 1 кг хромового ангидрида, 0,5 кг воды и 0,5 кг "свежеосажденного" осадка отхода хромового производства, предварительно отделенного от жидкой фазы и отмытого однократно объемом воды, равным объему фильтрата, и содержащего в своем составе 6 мас. Fe2O3, 1,5 мас. CaO, 2 мас. Cr2O3, 82 мас. h3O, перемешивают. Полученную суспензию подвергают термообработке при температуре 350 370oC в течение 1 часа, при температуре 1050oC в течение 2 часов. Спек измельчают в вибрационной мельнице в течение 3 мин, суспендируют в 0,001 м3 горячей воды, классифицируют через сито N 0,0056, отделяют фильтрацией, промывают 0,005 м3 воды, сушат при температуре 100 105oC, получают 0,77 кг продукта, содержащего 4 мас. Fe2O3, 1 мас. CaO и 95 мас. Cr2O3 с полирующей способностью 0,45 мг мин-1
мин-1 см-2 и дающего шероховатость поверхности после полировки RZ=0,08 мкм.
см-2 и дающего шероховатость поверхности после полировки RZ=0,08 мкм.Формула изобретения
Способ получения оксида хрома для полирования, включающий термообработку хромового ангидрида с добавкой, измельчение спека и отмывку продукта, отличающийся тем, что в качестве добавки используют предварительно отмытый осадок отхода, полученного при нейтрализации сточных вод хромового производства в течение не более одного месяца, содержащий в составе гидроксиды железа, хрома и кальция при массовом отношении хромового ангидрида и осадка, равном 2 1 1,5.РИСУНКИ
Рисунок 1, Рисунок 2, Рисунок 3www.findpatent.ru
способ получения окиси хрома - патент РФ 2258039
Изобретение относится к способам получения окиси хрома, которая может быть использована для производства магнитных носителей, а также для производства грунтовок, эмалей, красок, полировальных паст, производства абразивного материала и металлического хрома. Способ включает разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO 3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании с получением бихромата аммония и сульфата натрия. Сульфат натрия отделяют от раствора. Раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома. Техническим результатом изобретения является упрощение способа получения окиси хрома, повышение качества окиси хрома за счет уменьшения примесей и повышения содержания Cr2 О3 в готовом продукте, а также возможность получения окиси хрома различного назначения.
Изобретение относится к способам получения окиси хрома, которая может быть использована для производства магнитных носителей, а также для производства грунтовок, эмалей, красок, полировальных паст, производства абразивного материала и металлического хрома.
Известные способы получения окиси хрома основаны, как правило, на термическом разложении CrO3 или восстановлении Na2CrO4 элементарной серой (хроматно-серный метод) - см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.216.
Известно получение пигментной окиси хрома термическим разложением CrO3 при температуре 900-1150°С (см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.217).
Недостатком данного способа получения пигментной окиси хрома является низкое качество готового продукта, обусловленное высокой температурой прокалки и получением частиц окиси хрома большого размера: средний размер частиц составляет около 5 мкм, при этом пигмент имеет темный цвет, причем содержание Cr2О3 в готовом продукте не превышает 99%.
Известно получение абразивной окиси хрома термическим разложением CrO3 (см. авторское свидетельство СССР №1701635, МПК C 01 G 37/02, приоритет от 15.11.89, опубликованное 30.12.1991 г. "Способ получения оксида хрома для полирования").
Недостатком данного способа получения абразивной окиси хрома является низкое качество готового продукта, обусловленное низким содержанием Cr2O3, не превышающим 98%, и наличием примесей, которые не позволяют получить однородные по размеру частицы окиси хрома и обеспечить высокие потребительские свойства окиси хрома для полирования.
Известно получение окиси хрома для магнитных носителей термическим разложением CrO 3 (см. авторское свидетельство СССР №1570996, МПК C 01 G 37/027, приоритет от 20.07.87., опубликованное 15.06.1990 г. "Способ получения порошка двуокиси хрома для носителей магнитной записи").
Получаемая известным способом окись хрома содержит большое количество примесей серы, углерода, кремния SiO2, железа FeO, что не позволяет получить высокоплотную, высокочастотную запись из-за неоднородности зернового состава и величины среднего удельного объема частиц, лежащего в разнодоменной области.
Известен способ получения пигментной окиси хрома восстановлением хромата натрия серой (см. авторское свидетельство СССР №226573, МПК C 01 G 37/02, приоритет от 28.04.1966 г., опубликованное 03.06.1970 г. "Способ получения окиси хрома").
Известен способ получения абразивной окиси хрома восстановлением хромата натрия серой (см. авторское свидетельство СССР №236447, МПК C 01 G 37/02, приоритет от 20.07.1964 г., опубликованное 05.08.1969 г. "Способ получения окиси хрома для полирования").
Известен способ получения пигментной и металлургической окиси хрома путем восстановления соединений шестивалентного хрома Na2CrO4 в щелочном растворе серой (см. авторское свидетельство СССР №343567, МПК C 01 G 37/02, приоритет от 06.04.1970 г., опубликованное 03.11.1972 г. "Способ получения окиси хрома").
Известно также получение металлургической окиси хрома хроматно-серным методом (см. Авербух Т.Д., Павлов П.Г. Технология соединений хрома. Л.: Химия, 1973, с.216-217).
Вышеперечисленные способы получения окиси хрома хроматно-серным методом достаточно сложны, а конечный продукт содержит большое количество примесей, что ухудшает потребительские свойства окиси хрома, например, пигментная окись хрома имеет неудовлетворительные цветовые качества и физико-малярные свойства, а абразивная окись хрома имеет неудовлетворительные полирующие свойства.
Наиболее близким по совокупности существенных признаков к заявляемому изобретению является способ получения окиси хрома путем восстановления бихромата натрия сульфатом аммония, заключающийся в том, что смесь бихромата натрия и сульфата аммония подвергают термическому разложению в течение 6 часов при температуре 700-800°С с дальнейшим вымыванием сульфатов до получения готового продукта - окиси хрома, причем в качестве соли аммония используют сульфат аммония (см. патент Германии №728233, НПК 22 f 7, приоритет от 03.04.1940 г., опубликованный 23.11.1942 г. "Способ получения пигментной окиси хрома").
Известный способ получения окиси хрома является трудоемким, так как требует нескольких стадий выщелачивания (отмывки) готового продукта от сульфата натрия Na2SO4, которого в готовом продукте содержится до 50%.
Кроме того, с помощью известного способа невозможно получить окись хрома иного назначения, кроме пигментной, так как повышение температуры термического разложения свыше заявленной (700-800°С) ведет к плавлению сульфата натрия и образованию намотов в барабанных печах, в которых осуществляют термическое разложение, а также образованию агломератов готового продукта, затрудняющих его термическое разложение и снижающих качество получаемой окиси хрома, содержание которой в готовом продукте не превышает 98%.
Техническим результатом заявляемого изобретения является упрощение способа получения окиси хрома, повышение качества окиси хрома за счет уменьшения примесей и повышения содержания Cr2О3 в готовом продукте, а также возможность получения окиси хрома различного назначения.
Заявляемый технический результат достигается тем, что в способе получения окиси хрома, включающем разложение бихромата натрия и сульфата аммония с последующим вымыванием полученной окиси хрома, согласно изобретению первоначально осуществляют обменное разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании с получением бихромата аммония и сульфата натрия, причем последний затем отделяют от раствора, а раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома.
Обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 минут при постоянном перемешивании позволяет весь бихромат натрия перевести в бихромат аммония за счет прохождения следующей химической реакции:

Образующийся при этом сульфат натрия Na2SO 4 кристаллизуется и выпадает в осадок.
При концентрации раствора бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO 4 менее 400 г/л по CrO3 кристаллизация сульфата натрия Na2SO4 не происходит; при концентрации раствора бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO 4 более 450 г/л по CrO3 обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4 затрудняется в связи с преждевременной кристаллизацией сульфата натрия Na 2SO4, в результате чего реакция (1) протекает не в полном объеме.
Химическое разделение продуктов реакции и отделение сульфата натрия Na2SO4 от раствора бихромата аммония исключает необходимость многостадийного вымывания сульфатов и упрощает способ получения окиси хрома.
Охлаждение очищенного от кристаллов сульфата натрия раствора бихромата аммония (Nh5)2Cr2O7 до температуры его кристаллизации позволяет перевести бихромат аммония (NH 4)2Cr2O7 в кристаллическое состояние.
Термическое разложение кристаллического бихромата аммония (Nh5)2Cr2O7 при температуре 440-1400°С до образования окиси хрома обеспечивает возможность получения окиси хрома различного назначения в зависимости от конкретной температуры, лежащей в защищаемых пределах, а именно:
- при термическом разложении бихромата аммония (NH 4)2Cr2O7 при температуре 440-450°С образуется окись хрома, которая используется для магнитных носителей;
- при термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 800-900°С образуется мелкокристаллическая пигментная и абразивная окись хрома;
- при термическом разложении бихромата аммония (Nh5)2Cr 2O7 при температуре 1200-1400°С образуется крупнокристаллическая металлургическая окись хрома.
Вымывание полученной окиси хрома Cr2O3 позволяет окончательно отмыть окись хрома Cr2O3 от водорастворимых солей, что способствует уменьшению примесей до минимальных величин.
В результате заявляемый способ позволяет упростить процесс получения окиси хрома за счет исключения многостадийной отмывки готового продукта от сульфата натрия Na2SO 4, повысить качество окиси хрома за счет исключения примеси сульфата натрия и повышения содержание окиси хрома Cr 2O3 в готовом продукте, составляющем более 99%, а также обеспечить возможность получения окиси хрома различного назначения.
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как "новизна".
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как "изобретательский уровень".
Условие патентоспособности "промышленная применимость" подтверждается примерами конкретного выполнения, изложенными в разделе "Сведения, подтверждающие возможность осуществления изобретения".
Для получения окиси хрома используют следующее сырье:
1. Раствор бихромата натрия Na2Cr2O 7, концентрации 800-1000±100 г/л по CrO3 ;
2. Сульфат аммония кристаллический (Nh5) 2SO4 с содержанием азота не менее 21%.
Исходный раствор готовят следующим образом.
В раствор бихромата натрия Na2Cr2O7 концентрации 800-1000 г/л по CrO3 добавляют упаренный до концентрации 300-350 г/л по CrO3 маточный раствор бихромата аммония (Nh5)2Cr2O7, возвращаемый в процесс после стадии отделения кристаллов бихромата аммония (Nh5)2Cr2O7. Компоненты смешивают в баке до получения раствора с концентрацией 400-450 г/л по CrO3, после чего в приготовленный раствор добавляют сульфат аммония (Nh5)2SO4, который задают по расчету в стехиометрических количествах к заданному количеству бихромата натрия Na2Cr2O 7.
Концентрация раствора бихромата натрия Na 2Cr2O7 и сульфат аммония (NH 4)2SO4, в котором происходит обменное разложение, составляет 400-450 г/л по CrO3.
Затем осуществляют обменное разложение бихромата натрия Na 2Cr2O7 и сульфата аммония (NH 4)2SO4 при температуре 100-105 в течение 45-60 минут при постоянном перемешивании с образованием бихромата аммония (Nh5)2Cr2O 7 и сульфата натрия Na2SO4, происходящим по химической реакции (1), при этом весь бихромат натрия Na2Cr2O7 переводится в бихромат аммония (Nh5)2Cr2 O7.
Сульфат натрия Na2SO4 в растворах бихроматов обладает ограниченной растворимостью, поэтому значительная его часть сразу же выпадает в осадок.
Далее отделяют сульфата натрия Na2SO4 от раствора, для чего пульпу сульфата натрия Na2SO 4 в растворе бихромата аммония (Nh5) 2Cr2O7 направляют в отстойник, где происходит осаждение основного количества кристаллов сульфата натрия Na2SO4.
Осветленный раствор бихромата аммония (Nh5)2Cr2O 7 после отстойника направляют на контрольную фильтрацию на патронном фильтре, где от него отделяют оставшуюся часть сульфата натрия Na2SO4. Осадок сульфата натрия Na 2SO4 из отстойника и патронного фильтра подают на центрифугу, где происходит его обезвоживание.
Кристаллы сульфата натрия Na2SO4 после центрифуги направляют в производство белого сульфата натрия Na 2SO4. Маточные растворы после центрифуги возвращают в отстойник. Весь процесс отделения сульфата натрия Na2SO4 осуществляют при температуре раствора не ниже 90°С.
Затем раствор, содержащий бихромат аммония (Nh5)2Cr2O7 с концентрацией по CrO3 400-450 г/л и температурой 90°С, охлаждают до температуры 35-40°С, являющейся температурой кристаллизации бихромата аммония (Nh5)2Cr2O 7.
При этом в осадок выпадают кристаллы бихромата аммония (Nh5)2Cr2O7 , которые затем отделяют от маточного раствора на барабанном вакуум-фильтре.
Влажность осадка составляет 10-15%, содержание сульфатов до 1,5%.
Маточный раствор отправляют в голову процесса на упаривание, что способствует более полному вовлечению бихромата аммония (Nh5)2Cr2O 7 в процесс получения окиси хрома Cr2О 3, что, в свою очередь, способствует увеличению содержания окиси хрома Cr2O3 в готовом продукте до 99,5%.
Далее кристаллы бихромата аммония (Nh5 )2Cr2O7 подвергают термическому разложению в барабанной вращающейся печи при температуре 440-1400°С. При этом происходит следующая химическая реакция с образованием окиси хрома Cr2О3:

При термическом разложении бихромата аммония (Nh5 )2Cr2O7 при температуре 440-450°С образуется окись хрома Cr2O3 , которая используется для магнитных носителей;
При термическом разложении бихромата аммония (Nh5)2Cr 2O7 при температуре 800-900°С образуется мелкокристаллическая пигментная и абразивная окись хрома Cr 2О3;
При термическом разложении бихромата аммония (Nh5)2Cr2O7 при температуре 1200-1400°С образуется крупнокристаллическая металлургическая окись хрома Cr2О3.
После получения окиси хрома Cr2О3 осуществляют ее вымывание водой при отношении Т:Ж=1:4-1:6.
Полученную при этом пульпу фильтруют на барабанном вакуум-фильтре, в результате чего осуществляется окончательная отмывка окиси хрома Cr 2О3 от водорастворимых солей, что способствует уменьшению примесей и повышению содержания Cr2О 3 в готовом продукте до 99,5% и выше.
Осадок окиси хрома Cr2O3 с фильтра подают в барабанную вращающуюся сушилку, где он подвергается сушке при температуре 100-150°С.
Пример.
Бихромат натрия Na2 Cr2O7 с концентрацией 1000 г/л по CrO 3 в количестве 1,8 м3 раствора смешивают с 10 м3 упаренного маточного раствора бихромата аммония (Nh5)2Cr2O7 с концентрацией 350 г/л по CrO3 и получают раствор с концентрацией 450 г/л по CrO3 в количестве 11,8 м3.
В 1,8 м3 раствора бихромата натрия Na2 Cr2O7 с концентрацией 1000 г/л по CrO 3, содержится 1,8×1000×1,31=2358 кг сухого бихромата натрия Na2Cr2O7, где 1,31 - пересчетный коэффициент из CrO3 в Na2Cr 2O7. По химической реакции (1) устанавливают, что на 2358 кг бихромата натрия Na2Cr2O 7 необходимо задать 1188 кг сульфата аммония (NH 4)2SO4. Это количество отвешивают на весах и задают в раствор.
Затем согласно химической реакции (1) осуществляют обменное разложение бихромата натрия Na2Cr2O7 и сульфата аммония (Nh5)2SO4.
По окончании обменного разложения от раствора отделяют кристаллы сульфата натрия Na2SO4 в количестве 1278 кг, которые направляют на производство белого сульфата натрия Na2 SO4.
После отделения сульфата натрия Na 2SO4 получают 11 м3 очищенного раствора бихромата аммония (Nh5)2Cr2O 7, который затем охлаждают до температуры его кристаллизации - 35°С.
Полученные таким образом кристаллы бихромата аммония (Nh5)2Cr2O7 отделяют на вакуум-фильтре, при этом концентрация маточного раствора по CrO3 составляет 250 г/л, что обеспечивает получение кристаллов бихромата аммония (Nh5)2 Cr2O7 в количестве (450-250)×11,8×1,26=2973 кг.
Маточный раствор и промывные воды с вакуум-фильтра направляют в голову процесса на упаривание.
Далее кристаллы бихромата аммония (Nh5)2Cr2O 7 загружают в барабанную вращающуюся печь для термического разложения. После термического разложения по химической реакции (2) образуется 1794 кг окиси хрома Cr2O3 .
Для получения окиси хрома Cr2O3 , используемой для магнитных носителей, задают температуру термического разложения 440-450°С.
Для получения мелкокристаллической пигментной и абразивной окиси хрома Cr2О3 задают температуру термического разложения 800-900°С.
Для получения крупнокристаллической металлургической окиси хрома Cr2O3 задают температуру термического разложения 1200-1400°С.
Окись хрома Cr2 O3, полученная заявляемым способом, содержит Cr 2О3 в количестве 99,5% при минимальном количестве примесей: содержание серы S - 0,005%, содержание углерода С - 0,005%, содержание кремния SO2 - 0,07%, содержание железа FeO - 0,1%.
Таким образом, заявляемое изобретение позволяет упростить способ получения окиси хрома Cr2 О3, повысить качество окиси хрома Cr2О 3 за счет уменьшения примесей и повышения содержания Cr 2О3 в готовом продукте, а также получать окись хрома Cr2O3 различного назначения.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ получения окиси хрома, включающий разложение бихромата натрия и сульфата аммония с последующим вымыванием полученной окиси хрома, отличающийся тем, что первоначально осуществляют обменное разложение бихромата натрия и сульфата аммония, которое ведут в растворе с концентрацией 400-450 г/л по CrO3 при температуре 100-105°С в течение 45-60 мин при постоянном перемешивании с получением бихромата аммония и сульфата натрия, причем последний отделяют от раствора, а раствор, содержащий бихромат аммония, охлаждают до температуры его кристаллизации, после чего осуществляют термическое разложение кристаллов бихромата аммония при температуре 440-1400°С до образования окиси хрома.
www.freepatent.ru
Способ получения окиси хрома
0 П И С А Н И Е н, 546565
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Союз Советских
Социалистических
Республик (61) Дополнительное к авт. свид-ву (22) Заявлено 02.01.75 (21) 2091246/26 с присоединением заявки № (23) Приоритет
Опубликовано 15.02.77. Бюллетень № 6
Дата опубликования описания 19.04.77 (51) М. Кл. С 01G 37/02
Государственный комитет
Совета Министров СССР ло делам изобретенмй и открытий (53) УДК 661.876.12 (088.8) (72) Авторы изобретения Б. П. Середа, Н. А. Охотникова, А. К. Чирва, Г. А. Сорокин, В. И. Дейнеженко, Я. В. Пиввуев, Г. В. Зевалкина, Ю. Е. Важенин, 3. А. Ильюк и Г. А. Кравченко (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ОКИСИ ХРОМА
Изобретение относится к производству окиси хрома, используемой как металлургической промышленностью для выплавки металлического хрома, так и в качестве зеленого пигмента лакокрасочной промышленностью с одновременным получением кристаллического сульфата натрия для производства сульфида натрия.
Известны способы получения окиси хрома, применяемой для выплавки металлического хрома, а также в качестве зеленого пигмента, включающие стадию переработки образующихся сульфатных растворов на кристаллический сульфат натрия.
К ним относятся, в частности, способы, базирующиеся на термической обработке продуктов восстановительного осаждения хрома из хроматных растворов серой или сульфидом натрия на первой стадии и тиосульфатом натрия на второй.
Первую стадию процесса, в случае использования серы, осуществляют обычно при повышенном давлении в автоклаве и избытках серы; в случае сульфида натрия процесс ведут при атмосферном давлении и кипении реакционной смеси. Образующийся на первой стадии тиосульфат натрия используют в качестве восстановителя на второй.
Вторая стадия процесса реализуется путем добавления серной кислоты к смеси, содержащей хромат и тиосульфат натрия в заданном соотношении. Осуществляют ее при атмосферном давлении и температуре кипения реакционной смеси. Конечную величину рН среды
5 поддерживают в пределах 5 — 6, предпочтительнее 5,2 — 5,7, а количество тпосульфата натрия в зависимости от метода переработки сульфатных растворов варьируют в пределах
17 — 134% от теоретически необходимого для
10 восстановления хрома (3 1) моно- или бихромата натрия.
Продукты восстановительного осаждения хрома, образующиеся в процессе такого двухстадийного процесса, отделяют от сульфатно15 го раствора и подвергают термической обработке с получением металлургической или пигментной окиси хрома, а сульфатные растворы перерабатывают на кристаллический сульфат натрия, который используют затем в
20 производстве сульфида натрия. Поскольку сульфатные растворы, кроме сульфата натрия, содержат серусодержатцие восстановители и шестивалентный хром, то в технологическую схему получения окиси хрома включают обыч25 но дополнительные стадии автоклавной обработки либо реакционной массы после второй стадии восстановления, либо сульфатного раствора, обеспечивающие полное окисление серусодержащих восстановителей, а переработ30 ку сульфатных растворов ведут в производст546565
65 ве бпхромата натрия совместно с бпхромагносульфатными растворами (1).
Наиболее близким к описываемому изобретению по технической сущности и достигаемому результату является способ получения окиси хрома, предусматривающий переработку сульфатных растворов на кристаллический продукт путем подщелачивания их до рН среды, при котором хром шестпвалентпый и тиосульфат натрия не реагируют. В качестве щелочного реагента используют суспензию гидрата окиси хрома в растворе тиосульфата натрия, получаемую на первой стадии процесса.
После подщелачивания до заданной величины рН среды гидрат окиси хрома, введенный с суспензией, отделяют фильтрацией; сульфаттио-сульфатный раствор упарпвают, выпавшие кристаллы сульфата натрия отделяют, а маточный тиосульфат-сульфатный раствор вместе с осадком гидрата окиси хрома возвращают в начало процесса на вторую стадию, которую осуществляют при рН 5 — 6, температуре кипения реакционной смеси и количестве тиосульфата натрия в пределах 119—
134% от теоретически необходимого (2).
Недостатками этого способа являются сложность технологического процесса ввиду его многостадийности и относительно низкая скорость фильтрации продуктов восстановительного осаждения, составляющая 4—
6 мл/см . мин (по фильтрату).
С целью повышения скорости фильтрации продуктов восстановительного осаждения хрома из растворов моно- илп бихромата натрия тиосульфатом натрия и упрощения процесса по предлагаемому способу на вторую стадию исходный моно- или бихромат натрия вводят в количестве, обеспечивающем содержание тиосульфата натрия в суспензии, равное 150—
200% от теоретически необходимого, а отделение осадка гидрата окиси хрома осуществляют по достижению рН среды 6,2 — 6,7. Причем переработку отделенного от осадка маточника ведут в аппарате с псевдоожиженным слоем.
Пример 1. а) На первой стадии восстановления подвергают взаимодействию 260 кг
NaqCrO4 в виде щелочного хроматного раствора с содержанием 160 кг/м CrO> и 96 кг серы, что соответствует -122О/О от стехиометрического количества ее в уравнении:
4NaqCrO4+6S+ (2х+1) Н О =
=2 (Сг Оз хН О) +3NaqS>O>+2NaOH (1) Процесс ведут в автоклаве при 135 С, получая суспензию гидрата окиси хрома в щелочном растворе тиосульфата натрия, содержащем -240 кг/м Na S O3.
На второй стадии восстановления к полученной суспензии добавляют 384 кг Ка Сг04 в виде раствора монохромата натрия, получая хромат-тиосульфатную смесь, содержание тиосульфата натрия в которой соответст10
35 вует — 163%-ному количеству против стехиометрического в уравнении:
8МaqCr04+3NaqSqOq+5HqSOq+ (4х — 5) Н О =
-4 (Сг Оз хН О) +11Хаф04
Полученную смесь нагревают до 95 С и медленно вводят серную кислоту до достижения величины рН среды -6,5. Реакционную массу кипятят в течение 60 мин, и образовавшийся осадок гидроокпсных соединений хрома отделяют фильтрацией. Средняя скорость фильтрации по фильтрату составляет
8 мл/см мин.
Осадок отмывают от растворимых солей и прокаливают при температуре — 1300 С; спек выщелачивают, окись хрома отмывают и сушат, получая готовый продукт — металлургическую окись хрома.
Сульфатный раствор с содержанием
135,3 кг/м Nà SO4 и 26,0 кг/м Na>SqO>, что соответствует молярному отношению Мар504 ..
: Na Sq0> — — 5,8, подвергают сушке в аппарате
«КС», получая кристаллический сульфат натрия с содержанием -16% Na S O>, который направляют на переработку в производство сульфида натрия на стадию окускования сульфата натрия. б) Лналогичный результат получают, подвергая на первой стадии восстановления взаимодействию 200 г Na>Cr O в виде бихроматного раствора с содержанием 150 г/л CrOa u
90 г сульфида натрия в виде раствора с содержанием 80 г/л i%aqS, что соответствует — 101 % от стехиометрического количества его в уравнении:
4Nа Сг О7+6Nа $+ (4х+7) Н О =
=4(Сг Оз xHqO)+3Na>S>Oq+14NaOH... (3) Процесс ведут при 100 С, получая суспензию гидрата окиси хрома, в которую затем на второй стадии вводят 100 г Na>Cr>Oq в виде исходного бихроматного раствора, получая хромат-тиосульфатную смесь, содержание тиосульфата натрия в которой соответствует
200%-ному количеству против стехиометрического в уравнении (2) .
Далее поступают, как описано выше, заканчивая вторую стадию процесса при рН среды
6,6. Полученный осадок гидроокисных соединений хрома отделяют от сульфатного раствора, отмывают и прокаливают; спек выщелачивают, окись хрома промывают и сушат.
Пример 2. Первую стадию восстановления осуществляют в примере 1.
На второй стадии восстановления к полученной щелочной суспензии гидрата окиси хрома в растворе тиосульфата натрия добавляют 268 кг Na CrqOq и 140 кг NaqSO4 в виде бпхром атно-сульфатного раствора после бисульфатной травки растворов монохромата натрия. Полученная хромат-тиосульфатная смесь содержит тиосульфат натрия в количе546565
Формула изобретения
Составитель И. Зиннер
Текред Н. Аук
Корректор Л. Брахнина
Редактор Т. Логинова
Заказ 437j l3 Изд.. и 209 Тираж 654 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретешш и открыт и
113035, Москва, 1К-35, Раушская иаб., д. 4, 5
Типография, пр. Сапунова, 2 стве, соответствующем -200 о/о -ному против стехпометрического в уравнешш:
4Ха Сг От+8Ма $04+ЗИавЬзОз+Нв$04+
+ (4х — 1) Н>О =4 (Сг Оз хНгО) +15Ма,804 (4)
Далее поступают, как в примере 1, получая реакционную массу с рН среды -6,7. Средняя скорость фильтрации по фильтрату составляет -10 мл/см мин.
Осадок гидроокисных соединений хрома отмывают и прокаливают прп — 1300 С; спек выщелачивают, полученную металлургическую окись хрома промывают и сушат.
С сульфатным раствором, содержащим
17,5 кг/м NaqSO4 и 39,0 кг/м Na>S>O>, поступают, как в примере 1.
Во всех приведенных примерах получена окись хрома, по качеству полностью соответствующая действующему ГОСТУ.
Технико-экономическая эффективность изобретения обеспечивается в результате упрощения переработки получающихся на второй стадии восстановления сульфатных растворов, содержащих строго регламентируемое количество тиосульфата натрия (молярное отношение Na>SO4. Na S O, поддерживается в пределах 4 — 10), интенсификации стадии фильтрации продуктов восстановительного осаждения (фильтруемость последних улучшается в
1,5 — 2 раза) и получения кристаллического сульфата натрия в хорошо брпкетируемой форме (брикеты, полученные на основе такого сульфата натрия, выдерживают нагрузку
200 — 300 кг/см ), что позволяет интенсифицировать процесс его переработки в производстве сульфида натрия.
1. Способ получения окиси хрома, включающий восстановление части моно- плп бихро5 мата натрия серусодержащпм восстановителем на первой стадии, введение и образовавшуюся суспензпю гпдрата окиси хрома в щелочном растворе тпосульфата натрия оставшейся части исходного моно- плп бихромата
10 натрия на второй стадии, отделение осадка гпдрата окиси хрома фильтрацией, его термическую обработку и переработку отделенного маточника на кристаллический сульфат натрия, отличающийся тем, что, с целью
15 повышения скорости фильтрации и упрощения процесса, на вторую стадию исходный моноплп бпхромат натрия вводят в количестве, обеспечивающем содержание тпосульфата натрия в суспензпп, равное 150 — 200о/о от теоре20 тически необходимого, а отделение осадка гидрата окиси хрома осуществляют по достижению рН среды 6,2 — 6,7.
2. Способ по п. 1, отл и ч а ю щи и с я тем, что переработку отделенного от осадка ма25 точника ведут в аппарате с псевдоожпженным слоем.
Источники информации, принятые во внимание при экспертизе
30 1. «Химия и технология хромовых соединений>>. Изд. «Химия». М.— Л., 1966, стр. 199—
208.
2. «Химия и технология окиси хрома». Труды УНИХИМ, вып. 15, Свердловск, 1969, 35 стр. 73 — 83 (прототип).



www.findpatent.ru