Большая Энциклопедия Нефти и Газа. Хром строение
ХРОМ Строение атома Атомные свойства Атомный вес молярная
 ХРОМ
ХРОМ
 Строение атома Атомные свойства: Атомный вес(молярная масса): 51, 9961(г/моль) Электронная конфигурация: 4 s 1 3 d 5 Радиус атома: 130 пм Степени окисления: 0, 2, 3, 6 Термодинамические свойства: Плотность: 7, 19 г/см 3 Температура плавления: 2130 К Температура кипения: 2945 К Уд. теплота плавления: 21 к. Дж/моль Уд. теплота испарения: 342 к. Дж/моль Состояние вещества: твердое
Строение атома Атомные свойства: Атомный вес(молярная масса): 51, 9961(г/моль) Электронная конфигурация: 4 s 1 3 d 5 Радиус атома: 130 пм Степени окисления: 0, 2, 3, 6 Термодинамические свойства: Плотность: 7, 19 г/см 3 Температура плавления: 2130 К Температура кипения: 2945 К Уд. теплота плавления: 21 к. Дж/моль Уд. теплота испарения: 342 к. Дж/моль Состояние вещества: твердое
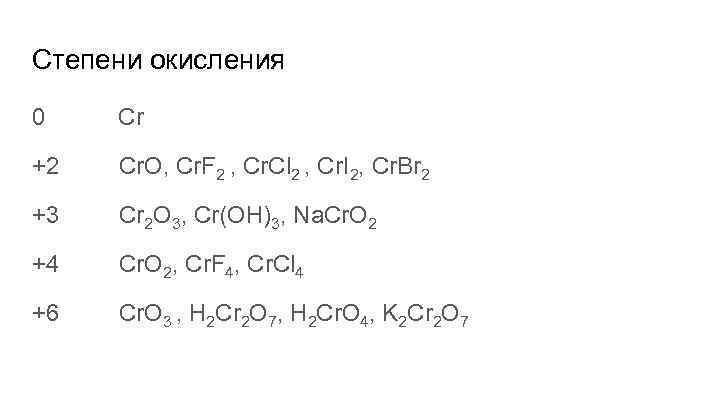
 Нахождение в природе Хромистый железняк(хромит) Fe. O*Cr 2 O 3 Магнезиохромит Mg. Cr 2 O 4 Свинцовая красная руда(крокоит) Pb. Cr. O 4
Нахождение в природе Хромистый железняк(хромит) Fe. O*Cr 2 O 3 Магнезиохромит Mg. Cr 2 O 4 Свинцовая красная руда(крокоит) Pb. Cr. O 4
 Получение 1. Алюминотермия Сr 2 O 3+2 Al = Al 2 O 3+2 Cr 2. Восстановление коксом(углеродом) Fe(Cr. O 2)2+4 C = Fe+ 2 Cr+4 CO 3. Электролиз
Получение 1. Алюминотермия Сr 2 O 3+2 Al = Al 2 O 3+2 Cr 2. Восстановление коксом(углеродом) Fe(Cr. O 2)2+4 C = Fe+ 2 Cr+4 CO 3. Электролиз

 Химические свойства. Взаимодействие с неметаллами и водой. 4 Cr + 3 O 2 = 2 Cr 2 O 3 2 Cr + 3 Cl 2 = 2 Cr. Cl 3. 2 Cr + N 2 = 2 Cr. N 2 Cr + 3 S = Cr 2 S 3. Cr + 2 B = Cr. B 2 Cr + 2 Si = Cr. Si 2 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2
Химические свойства. Взаимодействие с неметаллами и водой. 4 Cr + 3 O 2 = 2 Cr 2 O 3 2 Cr + 3 Cl 2 = 2 Cr. Cl 3. 2 Cr + N 2 = 2 Cr. N 2 Cr + 3 S = Cr 2 S 3. Cr + 2 B = Cr. B 2 Cr + 2 Si = Cr. Si 2 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2
 Взаимодействие с кислотами Cr + 2 HCl = Cr. Cl 2 + H 2 Cr + H 2 SO 4 = Cr. SO 4 + H 2 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O. 2 Cr + 6 H 2 SO 4(конц)= Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr + 6 HNO 3(конц)= Cr(NO 3)3 + 3 NO 2 + 3 H 2 O.
Взаимодействие с кислотами Cr + 2 HCl = Cr. Cl 2 + H 2 Cr + H 2 SO 4 = Cr. SO 4 + H 2 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O. 2 Cr + 6 H 2 SO 4(конц)= Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr + 6 HNO 3(конц)= Cr(NO 3)3 + 3 NO 2 + 3 H 2 O.
 Взаимодействие с щелочью. Восстановление металлов из солей. 2 Cr + 6 KOH = 2 KCr. O 2 + 2 K 2 O + 3 H 2. Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O. 2 Cr + 3 Cu. Cl 2 = 2 Cr. Cl 3 + 3 Cu.
Взаимодействие с щелочью. Восстановление металлов из солей. 2 Cr + 6 KOH = 2 KCr. O 2 + 2 K 2 O + 3 H 2. Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O. 2 Cr + 3 Cu. Cl 2 = 2 Cr. Cl 3 + 3 Cu.
 Соединения Оксид хрома(II) Cr(OH)2+2 HCl = Сr. Cl 2+ 2 H 2 O 2 Сr. Cl 2+2 HCl = 2 Cr. Cl 3 +H 2 4 Cr(OH)2+O 2+2 H 2 O=4 Сr(OH)3 Оксид хрома(III) (NH 4)2 Cr 2 O 7 = N 2+Cr 2 O 3 Cr(OH)3+3 Na. OH = Na 3[Cr(OH)6] Cr 2 O 3+2 Na. OH = 2 Na. Cr. O 2+H 2 O 4 K 2 Cr 2 O 7 = 2 Cr 2 O 3+4 K 2 Cr. O 4+3 O 2
Соединения Оксид хрома(II) Cr(OH)2+2 HCl = Сr. Cl 2+ 2 H 2 O 2 Сr. Cl 2+2 HCl = 2 Cr. Cl 3 +H 2 4 Cr(OH)2+O 2+2 H 2 O=4 Сr(OH)3 Оксид хрома(III) (NH 4)2 Cr 2 O 7 = N 2+Cr 2 O 3 Cr(OH)3+3 Na. OH = Na 3[Cr(OH)6] Cr 2 O 3+2 Na. OH = 2 Na. Cr. O 2+H 2 O 4 K 2 Cr 2 O 7 = 2 Cr 2 O 3+4 K 2 Cr. O 4+3 O 2
 Соединения Гидроксид хрома(III) 2 Cr(OH)3+3 H 2 SO 4 = Cr 2(SO 4)3+ 6 H 2 O Cr(OH) 3+KOH = K[Cr(OH)4] 2 Cr(OH) 3+4 Na. OH(конц)+3 H 2 O 2(конц) = 2 Na 2 Cr. O 4+8 H 2 O Оксид хрома(VI) K 2 Cr 2 O 7+H 2 SO 4 = 2 Cr. O 3+K 2 SO 4+H 2 O K 2 Cr. O 4+H 2 SO 4 = Cr. O 3+K 2 SO 4+H 2 O Cr. O 3+2 KOH = K 2 Cr 2 O 4+H 2 O
Соединения Гидроксид хрома(III) 2 Cr(OH)3+3 H 2 SO 4 = Cr 2(SO 4)3+ 6 H 2 O Cr(OH) 3+KOH = K[Cr(OH)4] 2 Cr(OH) 3+4 Na. OH(конц)+3 H 2 O 2(конц) = 2 Na 2 Cr. O 4+8 H 2 O Оксид хрома(VI) K 2 Cr 2 O 7+H 2 SO 4 = 2 Cr. O 3+K 2 SO 4+H 2 O K 2 Cr. O 4+H 2 SO 4 = Cr. O 3+K 2 SO 4+H 2 O Cr. O 3+2 KOH = K 2 Cr 2 O 4+H 2 O
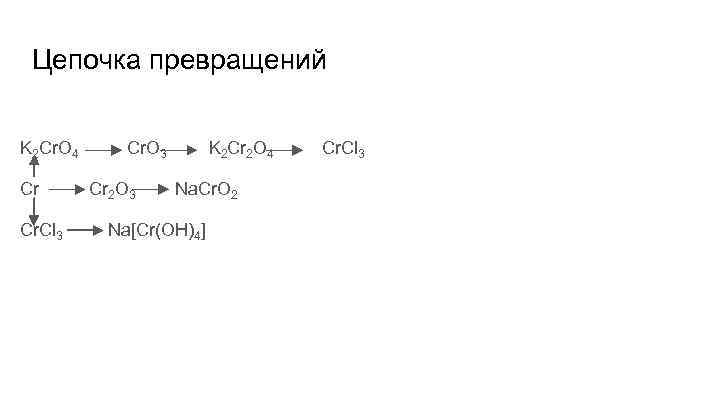 Цепочка превращений K 2 Cr. O 4 Cr Cr. Cl 3 Cr. O 3 Cr 2 O 3 K 2 Cr 2 O 4 Na. Cr. O 2 Na[Cr(OH)4] Cr. Cl 3
Цепочка превращений K 2 Cr. O 4 Cr Cr. Cl 3 Cr. O 3 Cr 2 O 3 K 2 Cr 2 O 4 Na. Cr. O 2 Na[Cr(OH)4] Cr. Cl 3
present5.com
Хром | Наука | FANDOM powered by Wikia
| Атомный номер | 24 |
| Внешний вид | очень твёрдый металлстального цвета |
| Атомная масса(молярная масса) | 51,9961 а. е. м. (г/моль) |
| Радиус атома | 130 пм |
| Энергия ионизации(первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность(по Полингу) | 1,66 |
| Электродный потенциал | 0 |
| Степени окисления | 6, 3, 2, 0 |
| Плотность | 7,18 г/см³ |
| Удельная теплоёмкость | 0,488 Дж/(K·моль) |
| Теплопроводность | 93,9 Вт/(м·K) |
| Температура плавления | 2130 K |
| Теплота плавления | 21 кДж/моль |
| Температура кипения | 2945 K |
| Теплота испарения | 342 кДж/моль |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Период решётки | 2,880 Å |
| Отношение c/a | n/a |
| Температура Дебая | 460,00 K |
Хром — 24 элемент периодической таблицы, атомная масса 51,996, металл голубовато-стального цвета.
В 1766 в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия  Править
Править
Название элемент получил от греч. chroma — цвет, краска, из-за разнообразия окраски своих соединений.
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
FeO·Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в бихромат подкисляя раствор и выкристаллизовывая бихромат;
4) получают чистый оксид хрома восстановлением бихромата углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трех валентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома;
Физические и химические свойства 
Править
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Устойчив на воздухе. При 300 °C сгорает с образованием зеленого оксида хрома (III) Cr2O3, обладающего амфотерными свойствами. Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3 + 2NaOH = 2NaCrO2 + h3O.
Непрокаленный оксид хрома (III) легко растворяется в щелочных растворах и в кислотах:
Cr2O3 + 6НСl = 2CrСl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(OH)6 получают красный основной оксид хрома (II) CrO. Коричневый или желтый гидроксид Cr(OН)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома (II).
При осторожном разложении оксида хрома (VI) CrO3 в гидротермальных условиях получают диоксид хрома (IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома (VI) CrO3. Типично кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую h3CrO4, дихромовую h3Cr2O7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и СrI2 и тригалогениды CrF3, CrCl3, CrBr3 и СrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
В растворах наиболее устойчивы соединения хрома (III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3-.
При окислении соединений хрома (III) в щелочной среде образуются соединения хрома (VI):
2Na3[Cr(OH)6] + 3h3O2 = 2Na2CrO4 + 2NaOH + 8h3O.
Хрому (VI) отвечает ряд существующих только в водных растворах кислот: хромовая h3CrO4, дихромовая h3Cr2O7, трихромовая h4Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении желтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7:
2K2CrO4 + 2НСl = K2Cr2O7 + 2КСl + Н2О.
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в желтую так как снова образуется хромат калия K2CrO4:
K2Cr2O7 + 2КОН = 2K2CrO4 + Н2О.
При добавлении к желтому раствору, содержащему хромат-ионы, раствора соли бария выпадает желтый осадок хромата бария BаCrO4:
Bа2+ + CrO42- = BаCrO4↓.
Соединения хрома (III) — сильные окислители, например:
K2Cr2O7 + 14НСl = 2CrCl3 + 2KCl + 3Cl2↑ + 7h3O.
Биологическая роль и физиологическое действие  Править
Править
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани лёгких. Соединения хрома (III) вызывают дерматиты. Соединения хрома (VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома (VI) в атмосферном воздухе 0,0015 мг/м3.
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
af:Chroom ar:كروم az:Xrom bg:Хром bs:Hrom ca:Crom co:Cromu cs:Chróm da:Krom de:Chrom el:Χρώμιο en:Chromium eo:Kromo es:Cromo et:Kroom fa:کروم fi:Kromi fr:Chrome gl:Cromo (elemento) he:כרום hr:Krom hu:Króm hy:Քրոմ id:Kromium io:Kromio is:Króm it:Cromo ja:クロム jbo:rogjinme ko:크로뮴 ku:Krom la:Chromium lb:Chrom lt:Chromas lv:Hroms mi:Konukita mk:Хром nl:Chroom nn:Krom no:Krom oc:Cròme pl:Chrom pt:Cromo ro:Crom sh:Hrom simple:Chromium sk:Chróm sl:Krom sq:Kromi sr:Хром sv:Krom ta:குரோமியம் th:โครเมียม tr:Krom uk:Хром uz:Xrom vi:Crom zh:铬
- Страница 0 - краткая статья
- Страница 1 - энциклопедическая статья
- Разное - на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Хром 1», чтобы сохранить ее
ru.science.wikia.com
Структура - хром - Большая Энциклопедия Нефти и Газа, статья, страница 1
Структура - хром
Cтраница 1
Структура элект-роосажденного хрома значительно мельче, чем выделенного из сульфатных электролитов. Диапазон температур ( рис. 9), обеспечивающих получение блестящих осадков в саморегулирующемся электролите, более широкий. При температуре 40 С и плотности тока 20 - 30 А / дм2 получаются серо-матовые покрытия; при 50 С и 20 - 30 А / дм8 осадки хрома имеют молочный оттенок, а при 60 С и 40 - 100 А / дмг образуются блестящие осадки. [2]
Эдкок [6] для выявления структуры хрома предлагает электролитическое травление смесью царской водки и глицерина. [3]
Иеничек [5] для выявления структуры хрома предлагает электролитическое травление / Электролитическое травление 10 % - ным гидроксидом натрия или раствором тиосульфата натрия позволяет провести последующую обработку 10 % - ной соляной кислотой в течение 5 - 8 с без токовой нагрузки. Структура, выявленная таким образом, может быть замаскирована голубоватыми иглами хлорида хрома, которые осаждаются на поверхности шлифа. [4]
Структура сплава марки ФХ001 аналогична структуре алюминотер-мического хрома: она также представлена зернами а-твердого раствора с тонкой сеткой выделений карбидов ( карбонитридов) хрома. Зерно а-твердого раствора мелкое - от 0 05 до 0 2 мм. Присутствие железа в сплаве приводит к дендритной ликвации, причем последние порции кристаллизующего расплава обогащены железом. При увеличении содержания углерода от 0 01 до 0 1 % ( сплав марки ФХ10) наблюдается утолщение карбидной сетки вокруг зерен а-твердого раствора. [5]
Изменение состава электролита отражается на проникновении водорода в сталь вследствие изменения скорости осаждения и структуры хрома: снижение скорости осаждения увеличивает наводороживание, а увеличение дефектности структуры, сопутствующее образованию более блестящих осадков, наоборот, снижает. Влияние изменения состава электролита зависит от режима электролиза. Например, увеличение содержания h3SO4 от 2 5 до 7 5 г / л при 1К 90 Л / дм2 существенно снижает проникновение водорода в сталь при 75 С и незначительно влияет при 55 С. [6]
Изменение состава электролита отражается ни проникновении водорода в сталь вследслвие изменения скорости осаждения и структуры хрома: снижение скорости осаждения увеличивает наводорожнвание, а увеличение дефектности структуры, сопутствующее образованию более блестящих осадков, наоборот, снижает. Влияние изменения состава электролита зависит от режима электролиза. Например, увеличение содержания h3SO, от 2 5 до 7 5 г / л при 1 к 90 Л / дм существенно снижает проникновение водорода в сталь при 75 С и незнач 1тельно влияет при 55 С. [7]
Повышение износостойкости хромовых осадков, полученных на токе переменной полярности при повышенных плотностях, объясняется измельчением структуры хрома, снижением хрупкости и изменением природы изнашивания. [8]
Плотную гексагональную структуру имеют технеций, рений, рутений, осмий вследствие того, что четыре d - электрона в е & ( - состоянии, стабилизовавшие ОЦК структуру хрома, молибдена, вольфрама и сохранившиеся у металлов VII-VIII групп, деформируют сферическую з2 - оболочку в сфероид. [9]
При плотности тока 21 - 28 а / дм2, температуре 54 получены блестящие покрытия толщиной до 25 мк с выходом по току 35 % в расчете на трехвалентный хром. Осадки имеют структуру, подобную структуре твердого хрома, по твердости и износоустойчивости эти покрытия напоминают хромовые. [10]
В УЗ-поле, направленном параллельно поверхности катода, количество окклюдированного водорода увеличивается при увеличении Дк до 130 А / дм2, оставаясь, однако, в 1 5 - 2 раза меньше, чем при обычных условиях электролиза, а далее уменьшается до 4 5 мл / 100 г при Дк 200 А / дм2, что значительно меньше водородосодержания обычных осадков хрома. При осаждении хрома в УЗ-поле наводороживаиие влияет и на структуру хрома. [11]
Максимум водородопроницаемости на стали У8 - А при блестящем осадке ( кривая 2) в два раза больше, чем у стали ЗОХГСНА ( кривая /), а при молочном осадке ( кривая 4) больше в три раза. Усиленная водородопроницае-мость при молочном осадке объясняется как увеличением коэффициента диффузии водорода при повышении температуры, так и особенностями структуры хрома, осажденного при повышенных температурах. Повышение плотности тока мало влияет на водородопроницаемость. [13]
Для нейтрализации кислотных центров поверхности, а следовательно, для предотвращения нежелательных побочных реакций, в алюмохромовые катализаторы вводят соли щелочных и щелочноземельных металлов. В промышленных катализаторах наиболее часто используют окиси калия, натрия, бериллия. Наиболее подробно изучено влияние добавок калия, действие которого сводится к стабилизации структуры хрома в катализаторе. [14]
Страницы: 1
www.ngpedia.ru











