CrCl3 + Na2S = ? уравнение реакции. Хлорид хрома 3 гидроксид натрия
CrCl3 + h3O2 + NaOH = ? уравнение реакции
В результате взаимодействия растворов хлорида хрома (III) с пероксидом водорода в щелочной среде, создаваемой гидроксидом натрия (CrCl3 + h3O2 + NaOH = ?) происходит образование средних солей – хромата и хлорида натрия, а также вода. Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[2CrCl_3 + 3H_2O_2 + 10NaOH \rightarrow 2Na_2CrO_4 + 8H_2O + 6NaCl.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e7801bc83423d5c7e359b7bea3255dd7_l3.png)
Запишем ионные уравнения, учитывая, что пероксид водорода и вода на ионы не распадаются, т.е. не диссоциируют.
![Rendered by QuickLaTeX.com \[ 2Cr^{3+} + 6Cl^{-} + 3H_2O_2 + 8Na^{+} + 8OH^{-} \rightarrow 4Na^{+} + 2CrO_4^{-} + 8H_2O + 6Na^{+} + 6Cl^{-};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8e805e0a6ea364c8c14bc2603f3f01ed_l3.png)
![Rendered by QuickLaTeX.com \[ 2Cr^{3+} + 3H_2O_2 + 10OH^{-} \rightarrow 2CrO_4^{-} + 8H_2O.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a89587feb8f2a17376c0719aa6dc40d1_l3.png)
Первое уравнение называют полным ионным, а второе – сокращенным ионным.Данная реакция относится к окислительно-восстановительным, поскольку химические элементы хром и кислород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
![Rendered by QuickLaTeX.com \[Cr^{+3} -3e \rightarrow Cr^{+6};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8675597a258637e95f3b8f1087f53179_l3.png)
![Rendered by QuickLaTeX.com \[O^{-1} +e \rightarrow O^{-2}.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ce6097a171d8fe88d552522c1e5c2743_l3.png)
Хлорид хрома (III) представляет собой тугоплавкие кристаллы фиолетово-красного цвета, разлагающиеся при прокаливании и сублимирующиеся при нагревании в потоке хлора. Хорошо растворяется в холодной воде (но чрезвычайно медленно, растворение ускоряется в присутствии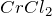 ), гидролизуется по катиону. Образует кристаллогидраты состава
), гидролизуется по катиону. Образует кристаллогидраты состава 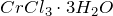 и
и 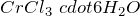 .Хлорид хрома (III) реагирует со щелочами, гидратом аммиака. Слабый окислитель, в растворе восстанавливается атомным водородом, при высокой температуре — водородом, кальцием, хромом. Слабый восстановитель, в растворе окисляется хлорноватой кислотой, перманганатом калия, галогенами, при высокой температуре — фтором. Вступает в реакции обмена и комплексообразования.
.Хлорид хрома (III) реагирует со щелочами, гидратом аммиака. Слабый окислитель, в растворе восстанавливается атомным водородом, при высокой температуре — водородом, кальцием, хромом. Слабый восстановитель, в растворе окисляется хлорноватой кислотой, перманганатом калия, галогенами, при высокой температуре — фтором. Вступает в реакции обмена и комплексообразования.
ru.solverbook.com
CrCl3 + Na2S = ? уравнение реакции
В результате взаимодействия хлорида хрома (III) с водным раствором сульфида натрия (CrCl3 + Na2S = ?) происходит образование осадка гидроксида хрома (III), хлорида натрия и выделение газа — сероводорода. Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[ 2CrCl_3 + 2Na_2S + 6H_2O \rightarrow 2Cr(OH)_3_{solid} + 3H_2S_{gas} + 6NaCl.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e17435f5b9b9acda83c7a726d27a59c0_l3.png)
Запишем ионные уравнения, учитывая, что гидроксид хрома (III), вода и газы на ионы не распадаются, т.е. не диссоциируют.
![Rendered by QuickLaTeX.com \[ 2Cr^{3+} + 6Cl^{-} + 4Na^{+} + 2S^{2-} + H_2O \rightarrow 2Cr(OH)_3 + 3H_2S + 6Na^{+} + 6Cl^{-};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b30c5a1f3bb0cfd6d460a0e8a361d1e1_l3.png)
![Rendered by QuickLaTeX.com \[ 2Cr^{3+} + 2S^{2-} + H_2O \rightarrow 2Cr(OH)_3 + 3H_2S.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b49915d80f3232d6459bcaf0ec25a1df_l3.png)
Первое уравнение называют полным ионным, а второе – сокращенным ионным.Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
![Rendered by QuickLaTeX.com \[2H_2S + 3O_2 \rightarrow 2H_2O + 2SO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1bcecd7b429e7a6c4a74cda3f4114c57_l3.png)
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При 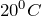 один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой.Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой.Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
![Rendered by QuickLaTeX.com \[H_2S + 4Cl_2 + 4H_2O \rightarrow H_2SO_4 + 8HCl.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9b49606034ed00d53f6b50c3638aabfb_l3.png)
Средние соли сероводорода называют сульфидами.При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
![Rendered by QuickLaTeX.com \[FeS + 2HCl \rightarrow FeCl_2 + H_2S.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f2652b2297e16169449d2f3890dc8fea_l3.png)
ru.solverbook.com
Хрома III гидроокиси хлорид - Справочник химика 21
Никель (карбонат, окись, гидроокись, хлорид, сульфат, формиат, борат, хромит, сульфид, карбонил, нитрат, ацетат, силикат, вольфрамат, оксалат, бутират, олеат, бензоат) [c.6]Окись хрома + (железо, хлористый марганец) на активном угле Железо, железная руда Железо (хлорид, сулы )ат, гидрат окиси) на активированном угле Медь (окись, хлорид, карбонат, хромит, гидроокись, ацетат) [c.8]
Проведение опыта. К раствору хлорида хрома(1П) в бокале прилить немного раствора щелочи. Выпадает зеленый осадок гидроокиси хрома (1П). Часть жидкости с осадком перенести во второй бокал. В один бокал добавить раствор соляной кислоты, а в другой — немного раствора щелочи. В обоих случаях осадок растворяется с образованием растворов зеленого цвета, так как гидроокись хрома(III) проявляет амфотерные свойства. Поместить в пробирку немного раствора хромита натрия и прокипятить. Из раствора снова выпадает осадок Сг(ОН)з вследствие гидролиза хромита натрия при нагревании. [c.119]
Однако можно провести и раздельное определение шестивалентного li трехвалентного хрома. Рекомендуемый метод основан на том, что хром (III) может быть количественно осажден окисью магния (pH 10,5—11). Гидроокись хрома (III) сорбируется на поверхности окиси магния, хром (VI) остается в растворе. Органические вещества, восстановители и хлорид-ионы, даже в больших количествах, определению этим методом не мешают. Подробности см. в литературе. [c.305]Хром — твердый металл блестящего серого цвета, плотность 6,92 г/м , способен корродировать. Гидроокись хрома и карбонаты в воде не растворяются, но соединения трехвалентного хрома (хлориды, нитраты и сульфаты) и шестивалентного (хроматы и бихроматы натрия, калия и аммония) в воде растворяются легко. [c.26]
Аммиак. Опыты 1—10. Прибор для получения аммиака (см. рис. 84). Водоструйный насос. Хлорид аммония, твердый и раствор. Гидроокись кальция. Натровая известь. Стеклянная вата. Фенолфталеин. Аммиак, концентрированный и разбавленный растворы. Фильтровальная бумага. Сульфат меди. Прибор для восстановления аммиаком трехокиси хрома (см. рис. 85). Хлоркальциевая трубка, наполненная кусками окиси кальция, Трехокись хрома. Хлорид аммония, твердый и раствор. Соляная кислота, концентрированная и разбавленная. Лакмусовая бумага — синяя и красная. Мрамор. Едкий натр. Карбонат аммония. Железная пластинка. [c.176]
В аналитической химии буферные растворы используют в весовом, объемном, экстракционном, инструментальном анализе, а также для разделения катионов и анионов, требующего соблюдения определенного pH. Например, катионы III аналитической группы отделяют от II и I групп при pH от 8—8,5. Если осаждать при рНнекоторые катионы III группы полностью не выпадут в осадок, например Мп2+. При рН>9 гидроокись алюминия образует растворимые алюминаты, а при рН>11 гидроокись хрома образует растворимые хромиты. Отделение карбонатов бария, стронция и кальция от ионов Mg + в присутствии смеси хлорида аммония и гидроокиси аммония также представляет собой пример применения буферных растворов. [c.32]
Щелочные растворы солей алюминия, хрома, цинка, свинца, олова и сурьмы. Эти соли можно открыть реакцией с хлоридом аммония, от действия которого выпадают гидроокиси алюминия, хрома, свинца, олова, сурьмы (но не гидроокись цинка, так как при данных условиях ион цинка остается в растворе в виде комплексной аммиачной соли).Применять хлорид аммония удобнее, чем соляную кислоту, так как последняя при неудачной дозировке может помешать осаждению гидроокисей. [c.209]
Указанное выше применение азотной кислоты для нейтрализации вместо соляной кислоты основано на том, что необходимо еще удалить фосфор, который присутствует почти всегда, и хром, а это можно сделать только в азотнокислом растворе следующим образом. К еще щелочной жидкости приливают в избытке нитрат серебра выпадают фосфат, хромат и хлорид серебра (последний, если присутствовали хлорид-ионы), а также гидроокись или карбонат серебра. В результате реакции между кислыми фосфатами и нитратом серебра могла бы выделиться свободная кислота, но она будет нейтрализована карбонатом серебра или его гидроокисью, а сохранение нейтральной реакции необходимо для полноты осаждения хромата и фосфата серебра. [c.934]
Окись И гидроокись Хрома обладают амфотерными свойствами. Для трехвалентного хрома существует два типа солей где хром является катионом, например хлорид хрома СгС1з, сульфат хрома Сг2(504)з, и где хром входит в состав аннона, например соли метахромистой НСгО и ортохромистой НдСгОз кислот. Соли трехвалентного хрома окрашены в зеленый, сине-зеленый или сине-фиолетовый цвета. [c.294]
Катионы 3-й аналитической группы осаждаются в щелочной среде сульфидом аммония при pH 9 в присутствии буферного раствора — смеси гидроокиси и хлорида аммония. 3-ю группу делят на две подгруппы 1) подгруппу катионов, образующих гидроокиси, и 2) подгруппу катионов, образующих сульфиды. Гидроокиси металлов получаются из сульфидов в том случае, когда растворимость гидроокиси меньше, чем растворимость сульфида данного металла. В подгруппе катионов, образующих гидроокиси, ясно заметно влияние диагонального направления в системе Менделеева. По диагоналям расположены элементы, выделяющиеся в этих условиях в виде гидроокисей а) бериллия, алюминия, титана, ниобия б) скандия, циркония, тантала, урана (VI) в) иттрия, гафния, лантана, тория вследствие сходства в свойствах с лантаном и актинием вместе с гидроокисями указанных металлов выпадают также все лантаноиды и актиноиды. Может выпасть и гидроокись магния в отсутствие иона ЫН . Выпадение в этой же подгруппе гидроокиси хрома, Сг(ОН)з, объясняется существованием электронной конфигурации. .. ёЧзК По этой же причине медь с электронной конфигурацией. .. За 1"451 попадает не в 3-ю, а в 4-ю аналитическую группу, образуя сульфид Сы5, не растворимый в кислой среде. Появление внешнего подуровня наблюдается через четыре элемента калий 5, кальций скандий s титан s ванадий хром 5 марганец s железо s кобальт 5% никель 5% медь цинк 5 Поведение ионов ванадия и марганца отличается от поведения хрома, поведение никеля и цинка — от поведения меди. [c.28]
Получение раствора хромата натрия вначале производилось аналогично получению хлорида хрома. После растворения облученного металла и выпаривания раствора в реактор добавляли 50 мл 0,2 N НС1 и перемешивали раствор. Затем, не прекращая перемешивания, вливали по каплям титрованный раствор 1 N NaOH в количестве 22 мл. При этом выпадала гидроокись хрома, которая в избытке щелочи переходила в хромит натрия (Na rOJ. После этого добавляли 2,5 мл 25—30%-ной HjOj, причем хромит окислялся до хромата. Затем удаляли избыток перекиси водорода путем перемешивания сжатым воздухом в течение 20 мин. Наконец отключали нагрев реактора, добавляли дистиллированную воду до общего объема 90 мл и еще раз перемешивали раствор. [c.61]
Применение сульфата алюминия в качестве протравы основано на том, что образующаяся вследствие гидролиза в водном растворе чрезвычайно дисперсная гидроокись алюминия поглощается и прочно удерживается волокнами шерсти. В свою очередь гидроокись алюминия , может связывать органические вещества (с образованием так называемых красильных лаков). Таким же образом действуют и другие легко гидролизуюпщеся соли, например сульфат хрома, хлорид олова и др. Шерстяные волокна, обработанные (протравленные) такими солями, могут вследствие способности адсорбированных ими гидроокисей металлов поглощать красители, окрашиваться такими веществами, которые иначе не удерживались бы на волокне. Бумажные волокна не могут, подобно шерстяным, непосредственно поглощать гидроокись алюминия из раствора (горячего). Поэтому при крашении бумажных тканей и получают осадок гидроокиси алюминия внутри волокна, пропитывая его сначала раствором сульфата алютния и затем действуя на него щелочью (содой и т. п.). [c.402]
Возможность структур сэндвичевого типа с участием бензольных колец была вновь выяснена недавно благодаря открытию катиона дибензолхрома (I) Сг(СвНб)2 и незаряженного дибензолхрома (0) Сг(СбНе)2 [186]. Первый из них был получен взаимодействием хлорного хрома с бензолом он у.меренно устойчив по отношению к гидролизу и окислению. Хлорид и гидроокись растворимы в воде, но с большими ионами — рейнека-том , тетрабензолборатом и пикратом — образуются нерастворимые осадки. Дибензолхром получают восстановлением. Он [c.262]
Окись и гидроокись хрома обладают амфотерными свойствами. Для трехвалентного хрома существуют два типа солей с хромом в качестве катиона, например хлорид хрома СгСЬ, сульфат хрома Сг2(304)з, и с хромом, входящим в анион, например соли метахромистой НСгОг и ортохромистой НзСгОз кислот. Соли трехвалентного хрома окрашены в зеленый, сине-зеленый или сине-фиолетовый цвета. [c.270]
chem21.info