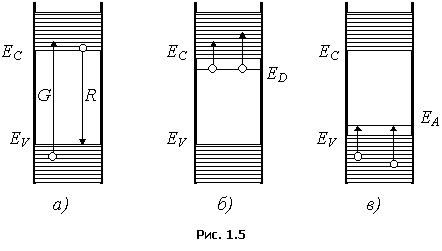
Большая Энциклопедия Нефти и Газа. Электрохимический эквивалент хрома
Электрохимический эквивалент
Электрохимический эквивалент (устар. электролитический эквивалент) — количество вещества, которое должно выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.Содержание
- 1 Законы Фарадея
- 2 Таблица значений электрохимических эквивалентов
- 3 Примечания
- 4 Литература
Законы Фарадея
Основная статья: Законы электролиза ФарадеяПервый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
m = k Q {\displaystyle m=kQ} ,Согласно второму закону Фарадея, электромеханический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
k = 1 F μ e q {\displaystyle k={\frac {1}{F}}\mu _{eq}} ,где F = {\displaystyle F=} 96 485,33289 Кл/моль — постоянная Фарадея, а μ e q {\displaystyle \mu _{eq}} — эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:
μ e q = μ z {\displaystyle \mu _{eq}={\frac {\mu }{z}}} ,где μ {\displaystyle \mu } — молярная масса, а z {\displaystyle z} — валентное число ионов вещества (число электронов на один ион). Таким образом электромеханический эквивалент может быть вычислен как:
k = 1 z F ⋅ μ {\displaystyle k={\frac {1}{zF}}\cdot \mu } .Таблица значений электрохимических эквивалентов
| молярная массаμ {\displaystyle \mu } (г/моль) | изменение валентностиz | 1 z F {\displaystyle {\frac {1}{zF}}} (мкмоль/кулон) | электрохимический эквивалент(мг/кулон) | электрохимический эквивалент(г/Ампер-час) | пример применения | |
| Водород | 1,0079 | 1 ↔ 0 | 10,364 | 0,0104 | 0,0376 | электролиз воды |
| Кислород | 15,999 | 2 ↔ 0 | 5,1821 | 0,0829 | 0,298 | |
| Фтор | 18,998 | 1 ↔ 0 | 10,364 | 0,197 | 0,709 | производство фтора |
| Натрий | 22,990 | 1 ↔ 0 | 10,364 | 0,238 | 0,858 | производство натрия |
| Алюминий | 26,981 | 3 ↔ 0 | 3,4548 | 0,0932 | 0,336 | производство алюминия |
| Хлор | 35,451 | 1 ↔ 0 | 10,364 | 0,367 | 1,32 | электролиз хлорида натрия |
| Хром | 51,996 | 6 ↔ 3 или 3 ↔ 0 | 3,4548 | 0,180 | ||
| Хром | 51,996 | 6 ↔ 0 | 1,7274 | 0,0898 | 0,323 | |
| Марганец | 54,938 | 4 ↔ 3 или 3 ↔ 2 | 10,364 | - | - | щелочной элемент |
| Марганец | 54,938 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,285 | 1,02 | |
| Марганец | 54,938 | 7 ↔ 4 или 3 ↔ 0 | 3,4548 | 0,190 | 0,683 | |
| Марганец | 54,938 | 7 ↔ 0 | 1,4806 | 0,0813 | 0,293 | |
| Железо | 55,845 | 3 ↔ 2 | 10,364 | - | - | |
| Железо | 55,845 | 2 ↔ 0 | 5,1821 | 0,289 | 1,04 | |
| Железо | 55,845 | 3 ↔ 0 | 3,4548 | 0,193 | 0,695 | |
| Никель | 58,693 | 2 ↔ 0 | 5,1821 | 0,304 | 1,09 | |
| Кобальт | 58,933 | 2 ↔ 0 | 5,1821 | 0,305 | 1,10 | |
| Медь | 63,546 | 2 ↔ 1 или 1 ↔ 0 | 10,364 | 0,659 | 2,37 | |
| Медь | 63,546 | 2 ↔ 0 | 5,1821 | 0,329 | 1,19 | рафинирование меди |
| Цинк | 65,409 | 2 ↔ 0 | 5,1821 | 0,339 | 1,22 | |
| Родий | 102,91 | 3 ↔ 0 | 3,4548 | 0,356 | 1,28 | |
| Палладий | 106,42 | 2 ↔ 0 | 5,1821 | 0,552 | 1,99 | |
| Серебро | 107,87 | 1 ↔ 0 | 10,364 | 1,12 | 4,02 | |
| Кадмий | 112,41 | 2 ↔ 0 | 5,1821 | 0,583 | 2,10 | |
| Олово | 118,71 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,615 | 2,21 | |
| Олово | 118,71 | 4 ↔ 0 | 2,5911 | 0,308 | 1,11 | |
| Платина | 195,08 | 2 ↔ 0 | 5,1821 | 1,01 | 3,64 | |
| Золото | 196,97 | 1 ↔ 0 | 10,364 | 2,04 | 7,35 | Au(I) |
| Золото | 196,97 | 3 ↔ 0 | 3,4548 | 0,680 | 2,45 | |
| Свинец | 207,2 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 1,07 | 3,87 | свинцово-кислотный аккумулятор |
| Свинец | 207,2 | 4 ↔ 0 | 2,5911 | 0,537 | 1,93 |
Примечания
- ↑ Кистяковский В. А. Электрохимический эквивалент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература
- Петрий, О. А. Эквивалент электрохимический // Краткая химическая энциклопедия / гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия. — Т. 5: Т−Я. — С. 979.
Электрохимический эквивалент Информация о
Электрохимический эквивалентЭлектрохимический эквивалентЭлектрохимический эквивалент Информация Видео
Электрохимический эквивалент Просмотр темы.Электрохимический эквивалент что, Электрохимический эквивалент кто, Электрохимический эквивалент объяснение
There are excerpts from wikipedia on this article and video
Электрохимические эквиваленты
| Серебро Ag | 1 | 11.18 |
| Алюминий Al3 | 3 | 0.932 |
| Золото Au3 | 3 | 6.81 |
| Барий Ba2 | 2 | 7.12 |
| Кальций Ca2 | 2 | 2.08 |
| Кадмий Cd2 | 2 | 5.824 |
| Хром Cr3 | 3 | 1.797 |
| Хлор Cl | 1 | 3.674 |
| Медь Cu | 1 | 6.588 |
| Медь Cu2 | 2 | 3.294 |
| Железо Fe2 | 2 | 2.893 |
| Железо Fe3 | 3 | |
| Водород H | 1 | 0.1045 |
| Калий K | 1 | 0.4051 |
| Литий Li | 1 | 0.72 |
| Магний Mg2 | 2 | 1.26 |
| Марганец Mn2 | 2 | 2.85 |
| Найтрий Na | 1 | 2.38 |
| Никель Nl2 | 2 | 3.041 |
| Кислород O2 | 2 | 0.8293 |
| Свинец Pb2 | 2 | 10.74 |
| Олово Sn2 | 2 | 6.15 |
| Стронций Sr2 | 2 | 4.54 |
| Цинк Zn2 | 2 | 3.388 |
www.formules.ru
Электрохимический эквивалент — WiKi
Электрохимический эквивалент (устар. электролитический эквивалент) — количество вещества, которое должно выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
m=kQ{\displaystyle m=kQ} ,где Q{\displaystyle Q} — количество электричества (измеряемое как правило в кулонах), а m{\displaystyle m} — масса осаждённого вещества. Коэффициент пропорциональности k{\displaystyle k}
Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
k=1Fμeq{\displaystyle k={\frac {1}{F}}\mu _{eq}} ,где F={\displaystyle F=} 96 485,33289 Кл/моль — постоянная Фарадея, а μeq{\displaystyle \mu _{eq}} — эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:
где μ{\displaystyle \mu } — молярная масса, а z{\displaystyle z} — валентное число ионов вещества (число электронов на один ион). Таким образом электрохимический эквивалент может быть вычислен как:
k=1zF⋅μ{\displaystyle k={\frac {1}{zF}}\cdot \mu } .Электрохимический эквивалент сплава и практический электрохимический эквивалент.
Электрохимической обработке часто подвергаются не чистые металлы, а их сплавы. В этом случае электрохимический эквивалент подсчитывается с использованием метода “сложения зарядов”:
C= (F 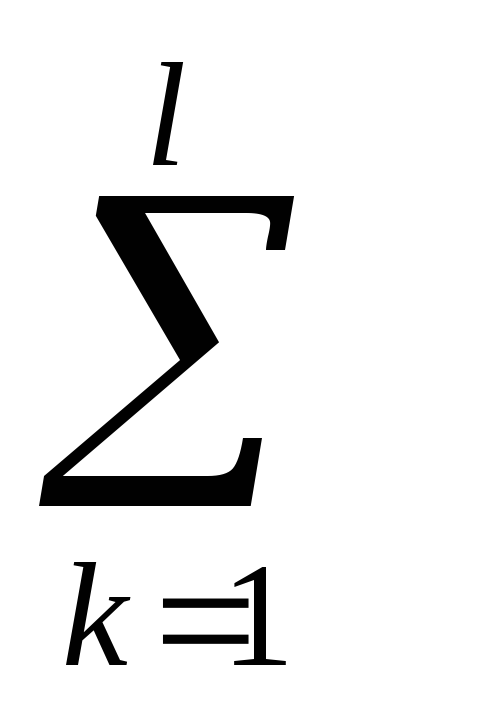 xknk/Mk) -1, (2.12)
xknk/Mk) -1, (2.12)
где l– число компонентов в сплаве, аxk, nk, Mk– массовая доля, число переносимых электронов и атомная массаk– того компонента сплава.
Например, для сплава, содержащего 20% хрома и 80% железа величина xFe= 0,8, аxCr= 0,2,MFeиMCrравны 59 и 52 соответственно (атомные массы железа и хрома),l= 2 (число компонентов сплава), величиныnFeиnCrопределяются степенью окисления железа и хрома в продуктах растворения.
Часто в практике электрохимической обработки используются т.н. “практический электрохимический эквивалент”, представляющий собой произведение εC. Это произведение, будучи подставленным в выражения (2.7) – (2.9) даёт реальную скорость обработки. Например:
Vi = 
 (2.13)
(2.13)
Vv =  (2.14)
(2.14)
Vm=  (2.15)
(2.15)
Очевидно, что выражения (2.7) – (2.9) представляют собой частные случаи (2.13) –(2.15) при ε = 1 (100% выходе по току).
Вопросы и задачи
Рассчитать электрохимический эквивалент титана, если при его анодном растворении титан ионизируется в виде Ti+4 (Ti Ti+4 + 4
 )
)Рассчитать электрохимический эквивалент хрома, если хром ионизируется в высшей степени окисления
Рассчитайте электрохимический эквивалент сплава Ni–Crс одинаковым весовым содержанием никеля и хрома в сплаве, если никель растворяется доNi(II), а хром до своей высшей степени окисления.
Определить выход по току растворения сплава Fe – Cr, если растворение железа происходит до высшей степени окисления, а хрома до степени окисления +3. В растворе после растворения сплава током 100А в течение 100с обнаружено 0,5г хрома и 0,5г железа (растворение было равномерным).
Определить эффективную валентность растворения железа, если после пропускания тока в 1000А в течение 2 часов в раствор перешло 2 кг железа.
Сколько времени необходимо затратить, чтобы растворить слой вольфрама толщиной 0,1 мм с поверхности 100 см2током 100А, если растворение вольфрама происходит в высшей степени окисления с выходом по току 100%?
Определить линейную скорость (мм/мин) растворения стальной пластины (сталь содержит 18% (вес) хрома) площадью 10см2, если в системе поддерживается ток в 1000А, железо растворяется с образованием ионовFe+2, а хром - с образованием бихромат-ионов. Плотность стали линейно изменяется с содержанием хрома в стали.
Определить линейную скорость хромирования (мм/час) детали общей площадью 1 м2, если в ванне поддерживается ток в 1000 А, а осаждение идет из раствора, содержащего бихромат-ионы с выходом по току 95%.
Рассчитайте линейную скорость обработки (мм/мин) детали из хрома общей площадью 100 см2током 5 кА, если выход по току растворения хрома равен 100%.
Какой источник тока необходим (исходя из максимального тока источника), чтобы обеспечить обработку стали с электрохимическим эквивалентом 1 г/Ачас для прошивки полости общей поверхностью 100 см2со скоростью 1 мм/мин?
studfiles.net
Электрохимический эквивалент — википедия орг
Электрохимический эквивалент (устар. электролитический эквивалент) — количество вещества, которое должно выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
m=kQ{\displaystyle m=kQ} ,где Q{\displaystyle Q} — количество электричества (измеряемое как правило в кулонах), а m{\displaystyle m} — масса осаждённого вещества. Коэффициент пропорциональности k{\displaystyle k} зависит от вещества и называется электрохимическим эквивалентом этого вещества.
Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
k=1Fμeq{\displaystyle k={\frac {1}{F}}\mu _{eq}} ,где F={\displaystyle F=} 96 485,33289 Кл/моль — постоянная Фарадея, а μeq{\displaystyle \mu _{eq}} — эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:
μeq=μz{\displaystyle \mu _{eq}={\frac {\mu }{z}}} ,где μ{\displaystyle \mu } — молярная масса, а z{\displaystyle z} — валентное число ионов вещества (число электронов на один ион). Таким образом электрохимический эквивалент может быть вычислен как:
k=1zF⋅μ{\displaystyle k={\frac {1}{zF}}\cdot \mu } .www-wikipediya.ru
Электрохимический эквивалент — Википедия РУ
Электрохимический эквивалент (устар. электролитический эквивалент) — количество вещества, которое должно выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
m=kQ{\displaystyle m=kQ} ,где Q{\displaystyle Q} — количество электричества (измеряемое как правило в кулонах), а m{\displaystyle m} — масса осаждённого вещества. Коэффициент пропорциональности k{\displaystyle k} зависит от вещества и называется электрохимическим эквивалентом этого вещества.
Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
k=1Fμeq{\displaystyle k={\frac {1}{F}}\mu _{eq}} ,где F={\displaystyle F=} 96 485,33289 Кл/моль — постоянная Фарадея, а μeq{\displaystyle \mu _{eq}} — эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:
μeq=μz{\displaystyle \mu _{eq}={\frac {\mu }{z}}} ,где μ{\displaystyle \mu } — молярная масса, а z{\displaystyle z} — валентное число ионов вещества (число электронов на один ион). Таким образом электрохимический эквивалент может быть вычислен как:
k=1zF⋅μ{\displaystyle k={\frac {1}{zF}}\cdot \mu } .http-wikipediya.ru
Электрохимический эквивалент - Большая Энциклопедия Нефти и Газа, статья, страница 2
Электрохимический эквивалент
Cтраница 2
Электрохимический эквивалент С и плотность у зависят от природы осаждаемого металла и для каждого металла постоянны. [16]
Электрохимический эквивалент кадмия 2 1 - почти вдвое больший, чем цинка ( 1 22), поэтому при одинаковой плотности тока и выходе по току кадмиевое покрытие можно нарастить почти вдвое быстрее, чем цинковое покрытие такой же толщины. [17]
Электрохимический эквивалент кадмия 2 1-почти вдвое больший, чем цинка ( 1 22), поэтому при одинаковой плотности тока и выходе по току кадмиевое покрытие можно нарастить почти вдвое скорее, чем цинковое покрытие такой же толщины. [18]
Электрохимический эквивалент никеля равен 1 095 ( см. стр. [19]
Электрохимический эквивалент осадка в ванне фосфатирования составляет примерно 3 г / а в свежеприготовленной ванне и снижается по мере ее проработки. Таким образом, здесь происходят одновременно цинкование и фосфатирование. Такое комбинирование обеспечивает максимальные защитные свойства лакокрасочных покрытий [28], причем количество операций в цепи технологического процесса сокращается. [21]
Электрохимический эквивалент хрома в связи с осаждением хрома из шестивалентных соединений также невелик. Поэтому, несмотря на применяемую высокую плотность тока, осаждение хрома происходит довольно медленно. [22]
Электрохимический эквивалент хрома при расчете на превращение шестивалентных ионов составляет 0 3235 г / ( А - ч) или 0 0898 мг / ( А. [23]
Электрохимический эквивалент магния составляет теоретически около 2200 а-ч / кг. [24]
Электрохимический эквивалент сплава при этом рассчитывают с учетом его состава, полученного в результате эксперимента. [25]
Электрохимический эквивалент таллия равен 0 70601 мг / Кл. От своих аналогов галлнян индия Т1 сильно отличается по химическим свойствам. [26]
Электрохимические эквиваленты ряда веществ, выраженные в мг / к и в г / а ч, приведены в табл. 2, там же приведены атомный вес, валентность и эквивалентные веса этих веществ. [27]
Электрохимические эквиваленты ряда веществ, выраженные в мг / к и г / а ч, приведены в табл. 2, там же приведены атомный вес, валентность и эквивалентный вес этих веществ. [28]
Низкие электрохимические эквиваленты цинка и окиси серебра ( 1 22 и 2 31 г / А - ч соответственно), сравнительно высокие коэффициенты использования активных масс ( 50 - 60 % для цинкового электрода и до 85 % для окисно-серебряного), достаточно высокое разрядное напряжение ( порядка 1 5 В) - все это обеспечивает СЦ аккумулятору удельную энергию до 120 Вт - ч / кг по сравнению с 20 - 40 Вт - ч / кг для безламельного никель-кадмиевого и 15 - 30 Вт - ч / кг для никель-железного и свинцового аккумуляторов. [29]
Электрохимический эквивалент алюминия Ээ, выход по току е, выход по энергии г рассчитываются по формулам (13.2), (13.3), (13.5) соответственно. [30]
Страницы: 1 2 3 4
www.ngpedia.ru

 ,
, — количество электричества (измеряемое как правило в кулонах), а m{\displaystyle m}
— количество электричества (измеряемое как правило в кулонах), а m{\displaystyle m} — масса осаждённого вещества. Коэффициент пропорциональности k{\displaystyle k}
— масса осаждённого вещества. Коэффициент пропорциональности k{\displaystyle k}
 ,
, 96 485,33289 Кл/моль — постоянная Фарадея, а μeq{\displaystyle \mu _{eq}}
96 485,33289 Кл/моль — постоянная Фарадея, а μeq{\displaystyle \mu _{eq}} — эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:
— эквивалентная масса (называемая также химическим эквивалентом), то есть та доля молярной массы вещества, которая может быть замещена в частице одним атомом водорода:  ,
, — молярная масса, а z{\displaystyle z}
— молярная масса, а z{\displaystyle z} — валентное число ионов вещества (число электронов на один ион). Таким образом электрохимический эквивалент может быть вычислен как:
— валентное число ионов вещества (число электронов на один ион). Таким образом электрохимический эквивалент может быть вычислен как:  .
.